名校
解题方法
1 . 回答下列问题
(1)在25℃,101kpa下,1g甲醇( )燃烧生成
)燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________ 。
(2)已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸气反应的热化学方程式:___________ 。
(3)已知:
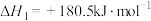

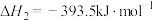
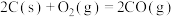
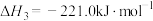
若某反应的平衡常数表达式为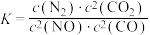 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
(4)根据图示信息写出热化学方程式:___________ 。
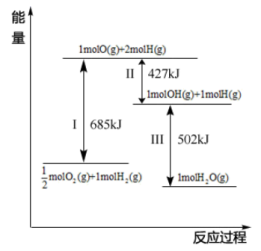
(5)已知:C(s)、CO(g)和 完全燃烧的热化学方程式分别为
完全燃烧的热化学方程式分别为

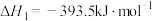


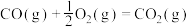
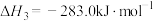
请你根据以上数据,写出C(s)与水蒸气反应生成CO和 的热化学方程式:
的热化学方程式:___________ 。
(1)在25℃,101kpa下,1g甲醇(
 )燃烧生成
)燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为(2)已知几种化学键的键能数据如表所示:
| 化学键 | N—H |  | Br—Br | H—Br |
键能/ | 391 | 946 | 194 | 366 |
(3)已知:

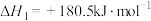

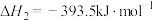
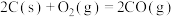
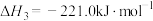
若某反应的平衡常数表达式为
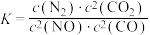 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)根据图示信息写出热化学方程式:

(5)已知:C(s)、CO(g)和
 完全燃烧的热化学方程式分别为
完全燃烧的热化学方程式分别为
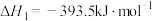


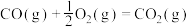
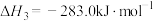
请你根据以上数据,写出C(s)与水蒸气反应生成CO和
 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
解题方法
2 . 现将2.3克的金属钠投入到过量水中,完全反应,按照下列要求进行计算(可能用到的相对原子质量:H—1,O—16,Na—23)
(1)生成的氢气质量为多少?___________
(2)若最终有100克溶液,此时氢氧化钠的质量分数为多少?___________
(1)生成的氢气质量为多少?
(2)若最终有100克溶液,此时氢氧化钠的质量分数为多少?
您最近一年使用:0次
解题方法
3 . 回答下列问题。(lg2=0.3、lg5=0.7)
(1)25℃时,0.01mol/L的NaOH溶液的pH=_____ ;由水电离出的c(H+)=_____ mol/L。
(2)25℃时,pH=2的盐酸与pH=5的盐酸等体积混合后溶液的pH=_____ 。
(3)25℃时,将10mLpH=2醋酸溶液稀释到1000mL后溶液的pH_____ 4(填“大于”“小于”或“等于”)。
(4)某温度下纯水中c(H+)=4×10-7mol/L,则此时溶液中的c(OH-)=_____ mol/L。
(5)某温度时,Ksp[AgI]=9.0×10-16,求AgI饱和溶液中c(Ag+)=_____ mol/L。
(1)25℃时,0.01mol/L的NaOH溶液的pH=
(2)25℃时,pH=2的盐酸与pH=5的盐酸等体积混合后溶液的pH=
(3)25℃时,将10mLpH=2醋酸溶液稀释到1000mL后溶液的pH
(4)某温度下纯水中c(H+)=4×10-7mol/L,则此时溶液中的c(OH-)=
(5)某温度时,Ksp[AgI]=9.0×10-16,求AgI饱和溶液中c(Ag+)=
您最近一年使用:0次
解题方法
4 . 回答下列问题
(1)将Cl2通入KOH溶液,反应后得到KCl、 KClO 、KClO3的混合溶液(无其它溶质),经测定KClO和KClO3的个数之比为9:1,则Cl2和KOH溶液反应时,被还原和被氧化的Cl原子的个数之比为_______________ ,参加反应的Cl2和KOH个数之比为_______ 。
(2)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,NaClO被还原成NaCl,若Na2Sx与NaClO的个数之比为1∶16,则x的值为_______________ 。
(1)将Cl2通入KOH溶液,反应后得到KCl、 KClO 、KClO3的混合溶液(无其它溶质),经测定KClO和KClO3的个数之比为9:1,则Cl2和KOH溶液反应时,被还原和被氧化的Cl原子的个数之比为
(2)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,NaClO被还原成NaCl,若Na2Sx与NaClO的个数之比为1∶16,则x的值为
您最近一年使用:0次
5 . 用NA表示阿伏加德罗常数的值。则:
(1)0.5molCO2的质量为________ ,其中含有______ 个CO2分子,共有______ 个原子,共有______ 个电子。
(2)质量都是100g的H2S、CH4、CO2、N2四种气体中,在相同条件下体积最小的是_______ ,含有原子数目最多的是_______ 。
(3)在标准状况下,由CO和CO2组成的混合气体为4.48L,质量为7.2g,此混合物中C和O原子个数比是___________ 。
(4)欲配制 100mL 1mol/L CuSO4溶液,需称量CuSO4·5H2O_______ g 。
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是_________________ ,氧化产物是___________ ,每生成1 mol Na2FeO4转移_______ mol电子。
(1)0.5molCO2的质量为
(2)质量都是100g的H2S、CH4、CO2、N2四种气体中,在相同条件下体积最小的是
(3)在标准状况下,由CO和CO2组成的混合气体为4.48L,质量为7.2g,此混合物中C和O原子个数比是
(4)欲配制 100mL 1mol/L CuSO4溶液,需称量CuSO4·5H2O
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是
您最近一年使用:0次
解题方法
6 . 填空。
(1)已知乙炔(C2H2)气体的燃烧热为ΔH=-1299.6kJ·mol-1,请写出表示乙炔燃烧热的热化学方程式_______ 。
(2)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-560kJ·mol-l;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1;
①若用标准状况下4.48LCH4还原NO2生成N2,反应中转移的电子总数为_______ ,(用NA表示阿伏加德罗常数值),放出的热量为_______ kJ。
②若1molCH4还原NO2时放出的热量为710kJ,则生成的N2和NO的物质的量之比_______ 。
(1)已知乙炔(C2H2)气体的燃烧热为ΔH=-1299.6kJ·mol-1,请写出表示乙炔燃烧热的热化学方程式
(2)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-560kJ·mol-l;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1;
①若用标准状况下4.48LCH4还原NO2生成N2,反应中转移的电子总数为
②若1molCH4还原NO2时放出的热量为710kJ,则生成的N2和NO的物质的量之比
您最近一年使用:0次
7 . 回答下列问题
(1)标准状况下11.2LHCl的物质的量是_______ ,将这些气体溶于水中配成500mL溶液,所得盐酸的物质的量浓度是_______ 。
(2)0.5molNH3分子中所含原子数为_______ 个,含0.2molAl3+的Al2(SO4)3中所含的SO 的物质的量是
的物质的量是_______ ,12.4gNa2R含Na+0.4mol,则R的摩尔质量为_______ 。
(1)标准状况下11.2LHCl的物质的量是
(2)0.5molNH3分子中所含原子数为
 的物质的量是
的物质的量是
您最近一年使用:0次
8 . 一定温度下,在10L密闭容器中加入5molSO2和3molO2,发生反应:2SO2(g)+O2(g) 2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
(1)反应生成了____ molSO3,v(SO2)=____ 。
(2)平衡时SO3的浓度是____ ,SO2的转化率是____ 。
(3)平衡时容器内气体的总物质的量为___ mol。
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是___ (填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3):n(O2):n(SO2)=2:1:2
(5)该温度下,SO3(g) SO2(g)+
SO2(g)+ O2(g)的平衡常数K=
O2(g)的平衡常数K=___ 。
 2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。(1)反应生成了
(2)平衡时SO3的浓度是
(3)平衡时容器内气体的总物质的量为
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3):n(O2):n(SO2)=2:1:2
(5)该温度下,SO3(g)
 SO2(g)+
SO2(g)+ O2(g)的平衡常数K=
O2(g)的平衡常数K=
您最近一年使用:0次
2022-04-11更新
|
532次组卷
|
2卷引用:广东省揭阳华侨高级中学2021-2022学年高二上学期第一次阶段考试化学试题
9 . 依据化学能与热能的相关知识回答下列问题:
I.已知化学反应N2+3H2 2NH3的能量变化如图所示,回答下列问题:
2NH3的能量变化如图所示,回答下列问题:
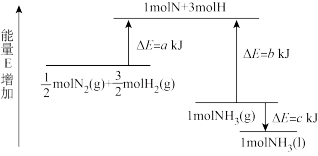
(1)0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程___ (填“吸收”或“放出”)____ kJ能量(用a、b、c字母表示,下同),NH3(g)到NH3(l)过程能量变化为____ kJ。
II.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1):P-P:198;P-O:360;O=O:498。

(2)则发生P4(白磷)+3O2(g)=P4O6(s)的反应是________ (填“吸热”或“放热”)反应;其中,生成1 mol P4O6需要_____ (“吸收或放出”)能量为_____ kJ
I.已知化学反应N2+3H2
 2NH3的能量变化如图所示,回答下列问题:
2NH3的能量变化如图所示,回答下列问题: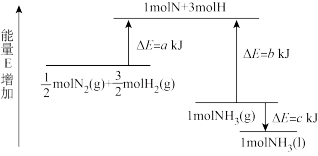
(1)0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程
II.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1):P-P:198;P-O:360;O=O:498。

(2)则发生P4(白磷)+3O2(g)=P4O6(s)的反应是
您最近一年使用:0次
解题方法
10 . 计算
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=___________ 。
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
下表列出了几种化学键的键能:【CO的结构 】
】
298 K时,上述反应的ΔH=___________ 。
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)下表列出了几种化学键的键能:【CO的结构
 】
】| 化学键 | H-H | C-H | H-O |  |
| 键能kJ/mol | 436 | 413 | 467 | 1072 |
您最近一年使用:0次



