硫的氧化物的排放是形成硫酸型酸雨的主要原因,含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答下列问题:
I.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH +Ca2++2OH-+SO
+Ca2++2OH-+SO ⇌CaSO3↓+2NH3•H2O。
⇌CaSO3↓+2NH3•H2O。
(1)已知:25℃时,Kb(NH3•H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=________ (用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:
i.2CO(g)+SO2(g)⇌S(l)+2CO2(g)ΔH1═-37.0kJ•mol-1
ii.2H2(g)+SO2(g)⇌S(l)+2H2O(g)ΔH2=+45.4kJ•mol-1
(2)CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式为________ 。
(3)在一定压强下,发生反应ii。平衡时,SO2的转化率α(SO2)与原料气投料比[ ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。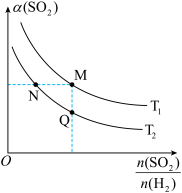 ①H2的转化率α(H2):M
①H2的转化率α(H2):M______ N(填“>”“<”或“=”)。
②逆反应速率:Q______ M(填“>”“<”或“=”)。
(4)T℃,向2L恒容密闭容器中充入2molCO(g)、2molSO2(g)和2molH2(g),发生反应i和反应ii。5min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6mol、1.8mol。
①其他条件不变,6min时缩小容器容积,α(H2)________ (填“增大”“减小”或“不变)。
②该温度下,反应ii的平衡常数K=________ 。
I.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH
 +Ca2++2OH-+SO
+Ca2++2OH-+SO ⇌CaSO3↓+2NH3•H2O。
⇌CaSO3↓+2NH3•H2O。(1)已知:25℃时,Kb(NH3•H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=
Ⅱ.水煤气还原法
已知:
i.2CO(g)+SO2(g)⇌S(l)+2CO2(g)ΔH1═-37.0kJ•mol-1
ii.2H2(g)+SO2(g)⇌S(l)+2H2O(g)ΔH2=+45.4kJ•mol-1
(2)CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式为
(3)在一定压强下,发生反应ii。平衡时,SO2的转化率α(SO2)与原料气投料比[
 ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。 ①H2的转化率α(H2):M
①H2的转化率α(H2):M②逆反应速率:Q
(4)T℃,向2L恒容密闭容器中充入2molCO(g)、2molSO2(g)和2molH2(g),发生反应i和反应ii。5min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6mol、1.8mol。
①其他条件不变,6min时缩小容器容积,α(H2)
②该温度下,反应ii的平衡常数K=
更新时间:2023-06-21 17:07:14
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。回答下列问题:
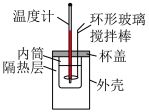
①若将杯盖改为薄铁板,求得的反应热数值将___ (填“偏大”“偏小”或“不变”)。
②若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:___ 。
(2)①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为___ 。
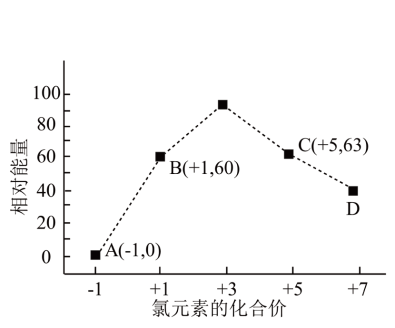
②一定条件下,水溶液中所含离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 各1mol,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应3ClO-(aq)=ClO
各1mol,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应3ClO-(aq)=ClO (aq)+2Cl-(aq)的 △H=
(aq)+2Cl-(aq)的 △H=___ kJ·mol-1。
(1)用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。回答下列问题:

①若将杯盖改为薄铁板,求得的反应热数值将
②若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:
(2)①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
②一定条件下,水溶液中所含离子Cl-、ClO-、ClO
 、ClO
、ClO 、ClO
、ClO 各1mol,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应3ClO-(aq)=ClO
各1mol,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应3ClO-(aq)=ClO (aq)+2Cl-(aq)的 △H=
(aq)+2Cl-(aq)的 △H=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】以黄铁矿(主要成分是FeS2)为原料,某生产硫酸的简要流程图及图中所标出的各阶段1mol含硫物质完全转化时放出的热量如下:
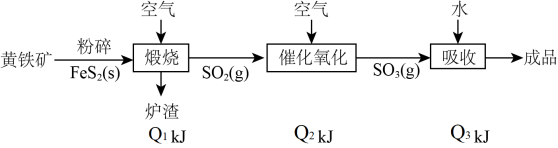
已知催化氧化阶段的反应是可逆反应。回答下列问题:
(1)催化氧化阶段反应的热化学方程式是___________ ;该变化过程需要加入催化剂,加入催化剂___________ (填“能”或“不能”)改变该反应的反应热。
(2)若生成98kgH2S04,放出的总热量___________ (填“>”“<”或“=”)(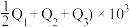 kJ,理由是
kJ,理由是___________ 。
(3)在细菌的作用下,黄铁矿能被湿空气直接氧化为硫酸,同时铁由+2价变为+3价。若生成1molH2S04,放出的热量为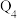 kJ,其热化学方程式是
kJ,其热化学方程式是___________ ,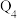
___________ (填“>”“<”或“=”)(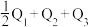 )。
)。

已知催化氧化阶段的反应是可逆反应。回答下列问题:
(1)催化氧化阶段反应的热化学方程式是
(2)若生成98kgH2S04,放出的总热量
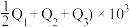 kJ,理由是
kJ,理由是(3)在细菌的作用下,黄铁矿能被湿空气直接氧化为硫酸,同时铁由+2价变为+3价。若生成1molH2S04,放出的热量为
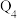 kJ,其热化学方程式是
kJ,其热化学方程式是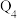
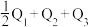 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】党的二十大报告中强调“实现碳达峰、碳中和是一场广泛而深刻的经济社会系统性变革”。利用CO2合成淀粉的研究成果已经被我国科学家发表在《Nature》杂志上,其涉及的关键反应如下:
I.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ•mol-1
Ⅲ.CO(g)+2H2(g)=CH3OH(g) △H3=
(1)反应Ⅲ的△H3=_______ ,该反应自发进行的条件是______ (填“高温自发”、“低温自发”或“任何温度下都自发”)。
(2)在该反应体系中,下列有关说法错误的是______ 。
(3)反应Ⅱ的反应速率v=v正- v逆=k正c(CO2)c(H2)-k逆c(CO)c(H2O),其中k正、k逆分别为正、逆反应速率常数,影响速率常数k的因素有温度和催化剂等。该反应的平衡常数K= ,升高温度时,k正-k逆是
,升高温度时,k正-k逆是_______ (填“增大”、“减小”或“不变”)。
(4)在催化剂作用下,向某恒容密闭容器中通入1molCO2和3molH2,只发生I、Ⅱ两个反应。测得不同温度下CO2的平衡转化率和甲醇的选择率随温度的变化趋势如图所示。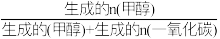 ×100%
×100%
①根据图中数据,温度选择_______ K达到平衡时,反应体系内甲醇的产量最高。随着温度的升高,CO2的平衡转化率增加,但甲醇的选择率降低,请分析其原因:________ 。
②513K时,平衡体系的压强为p0MPa,体系中n(H2O)=_______ mol,反应Ⅱ的Kp=_______ (列出计算式即可)。
I.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ•mol-1
Ⅲ.CO(g)+2H2(g)=CH3OH(g) △H3=
(1)反应Ⅲ的△H3=
(2)在该反应体系中,下列有关说法错误的是
| A.增大H2的浓度有利于提高CO2的转化率 |
| B.升高温度,反应Ⅱ的速率加快,反应I的速率减慢 |
| C.选用合适的催化剂可以提高甲醇在单位时间内的产量 |
| D.达到平衡后,若压缩体积,反应I平衡正向移动,反应Ⅱ平衡不移动 |
(3)反应Ⅱ的反应速率v=v正- v逆=k正c(CO2)c(H2)-k逆c(CO)c(H2O),其中k正、k逆分别为正、逆反应速率常数,影响速率常数k的因素有温度和催化剂等。该反应的平衡常数K=
 ,升高温度时,k正-k逆是
,升高温度时,k正-k逆是(4)在催化剂作用下,向某恒容密闭容器中通入1molCO2和3molH2,只发生I、Ⅱ两个反应。测得不同温度下CO2的平衡转化率和甲醇的选择率随温度的变化趋势如图所示。
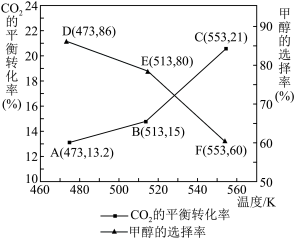
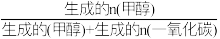 ×100%
×100%①根据图中数据,温度选择
②513K时,平衡体系的压强为p0MPa,体系中n(H2O)=
您最近一年使用:0次
【推荐1】(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______________________ 。
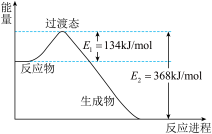
(2)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________ (用K1、K2表示),该反应的ΔH=__________ (用ΔH1、ΔH2表示)。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入空钢瓶中,反应平衡后水的物质的量分数为0.02。H2S的平衡转化率α=
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入空钢瓶中,反应平衡后水的物质的量分数为0.02。H2S的平衡转化率α=__________ %。

(2)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)2NO(g)+Cl2(g)
 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入空钢瓶中,反应平衡后水的物质的量分数为0.02。H2S的平衡转化率α=
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入空钢瓶中,反应平衡后水的物质的量分数为0.02。H2S的平衡转化率α=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是 (填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
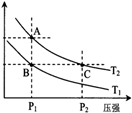
(3)右图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用____________的方法(填“升温”或“降温”)。
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1 ③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式_________________。
 CH3OH(g)
CH3OH(g)(1)判断反应达到平衡状态的依据是 (填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(3)右图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用____________的方法(填“升温”或“降温”)。

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1 ③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式_________________。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】冷冻氨碳捕集技术,要先用氨吸收CO2生成盐,然后在高温下使CO2再生。
吸收CO2的主要化学反应:
2NH3(aq)+CO2(g)+H2O(l) (NH4)2CO3(aq)+99.3kJ
(NH4)2CO3(aq)+99.3kJ
NH3(aq)+CO2(g)+H2O(l) NH4HCO3(aq)+26.4kJ
NH4HCO3(aq)+26.4kJ
2NH3(aq)+CO2(g) NH2COONH4(aq)+135.9kJ
NH2COONH4(aq)+135.9kJ
(1)吸收CO2时宜选用___________ ,(选填“低温”或“高温”)理由___________ 、___________ 。(列举两点)
再生的CO2可直接用于合成乙醇。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
(2)该反应的化学平衡常数表达式K=___________ 。
(3)在恒温恒容的密闭容器中反应,可以判断已达平衡状态的是___________ 。(选填编号)
a.2v(CO2)正=3v(H2O)逆
b.容器中总压强不变
c.容器中混合气体的密度不变
d.容器中CO2的体积分数不变
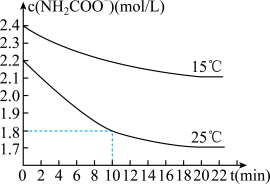
干燥的NH3和CO2可生成较纯净的氨基甲酸铵(NH2COONH4),氨基甲酸铵易水解,产物是碳酸氢铵和一种弱碱。取二份氨基甲酸铵溶液,测定15℃、25℃时水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示。
(4)写出氨基甲酸铵水解的离子方程式___________ 。
(5)根据图中信息回答:25℃,0~10min内NH2COO﹣的平均水解速率v(NH2COO﹣)=___________ 。判断NH2COO﹣的水解速率随温度升高而增大的理由是___________ 。
吸收CO2的主要化学反应:
2NH3(aq)+CO2(g)+H2O(l)
 (NH4)2CO3(aq)+99.3kJ
(NH4)2CO3(aq)+99.3kJNH3(aq)+CO2(g)+H2O(l)
 NH4HCO3(aq)+26.4kJ
NH4HCO3(aq)+26.4kJ2NH3(aq)+CO2(g)
 NH2COONH4(aq)+135.9kJ
NH2COONH4(aq)+135.9kJ(1)吸收CO2时宜选用
再生的CO2可直接用于合成乙醇。
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)(2)该反应的化学平衡常数表达式K=
(3)在恒温恒容的密闭容器中反应,可以判断已达平衡状态的是
a.2v(CO2)正=3v(H2O)逆
b.容器中总压强不变
c.容器中混合气体的密度不变
d.容器中CO2的体积分数不变
干燥的NH3和CO2可生成较纯净的氨基甲酸铵(NH2COONH4),氨基甲酸铵易水解,产物是碳酸氢铵和一种弱碱。取二份氨基甲酸铵溶液,测定15℃、25℃时水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示。

(4)写出氨基甲酸铵水解的离子方程式
(5)根据图中信息回答:25℃,0~10min内NH2COO﹣的平均水解速率v(NH2COO﹣)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】氢能有燃烧热值高、可持续性、储量丰富、零污染等优点,是真正的绿色、清洁、可持续发展能源。下面是我国科学家研究的几种制氢方法。回答下列问题:
(1)水煤气法:发生反应的化学方程式为: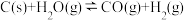
 。
。
①用物质的量浓度表示该反应的化学平衡常数表达式Kc=___________ 。升高温度Kc将___________ (填“变大”“变小”或“不变”)。
②在温度恒定的密闭容器中,加入一定量C(s)和2 mol H2O(g)达到平衡时压强为p,将容器体积缩小一半,此时v (正)___________ (填“大于”“小于”或“等于”)v(逆),再次达到化学平衡状态时压强为p1,则p1的范围为___________ 。
(2)化学硫碘循环分解水制氢气的总反应方程式为:
 。
。
反应原理简化为:
反应历程1: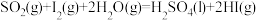
反应历程2: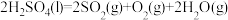
反应历程3:___________。
反应过程中能量变化如图所示:
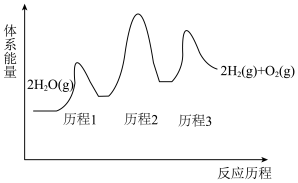
①写出反应历程3的化学方程式___________ 。
②该反应的催化剂是___________ (填化学式),化学硫碘循环分解水制得氢气过程中,决定反应速率快慢的步骤是反应历程___________ (填“1”“2”或“3”),该反应历程的△H_______ 0(填“<”“>”或“=”)
(3)甲烷水蒸气催化重整制得氢气,反应原理为:
I.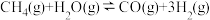
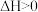
Ⅱ.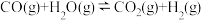
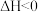
①为了提高CH4的平衡转化率,同时提高CO的浓度,可以采取的措施是_______ (填字母)。
A.使用高效催化剂 B.升高温度
C.增大压强 D.增大CH4和H2O(g)物质的量之比
②某温度下,在刚性密闭容器中加入1 mol CH4(g)和1molH2O(g),在催化剂作用下发生上述反应,达到平衡后测得n(H2O)=0.7mol,n(CO2)=0.1mol,则此温度下反应Ⅱ的化学平衡常数KⅡ=_______ 。
(1)水煤气法:发生反应的化学方程式为:
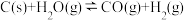
 。
。①用物质的量浓度表示该反应的化学平衡常数表达式Kc=
②在温度恒定的密闭容器中,加入一定量C(s)和2 mol H2O(g)达到平衡时压强为p,将容器体积缩小一半,此时v (正)
(2)化学硫碘循环分解水制氢气的总反应方程式为:

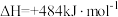 。
。反应原理简化为:
反应历程1:
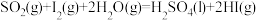
反应历程2:
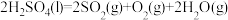
反应历程3:___________。
反应过程中能量变化如图所示:

①写出反应历程3的化学方程式
②该反应的催化剂是
(3)甲烷水蒸气催化重整制得氢气,反应原理为:
I.
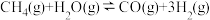
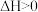
Ⅱ.
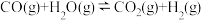
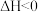
①为了提高CH4的平衡转化率,同时提高CO的浓度,可以采取的措施是
A.使用高效催化剂 B.升高温度
C.增大压强 D.增大CH4和H2O(g)物质的量之比
②某温度下,在刚性密闭容器中加入1 mol CH4(g)和1molH2O(g),在催化剂作用下发生上述反应,达到平衡后测得n(H2O)=0.7mol,n(CO2)=0.1mol,则此温度下反应Ⅱ的化学平衡常数KⅡ=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺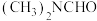 ,简称DMF]制备三甲胺:
,简称DMF]制备三甲胺: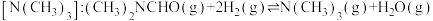
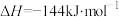 。
。
(1)在上述反应中,每生成1g气态水,放出_______ kJ的热量。
(2)在铜催化剂表面发生上述反应的历程如图所示(催化剂表面吸附物种用“*”表示)。
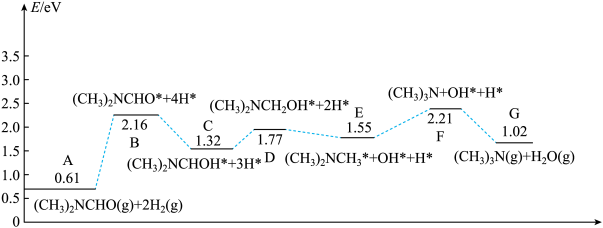
①下列分步反应中,能垒最大的是_______ (填标号)。
a.A→B b.C→D c.F→G
②A→B中,催化剂吸附放出的总能量_______ (填“大于”、“小于”或“等于”)断裂共价键吸收的总能量。
③D→E的化学方程式为_______ 。
(3)向体积相等的I、II两个恒容密闭容器中分别充入1mol DMF(g)和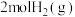 发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
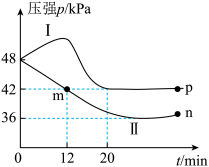
①容器I中为_______ (填“绝热”或“恒温”)过程。判断的依据是_______ 。
②在容器II中,0~12min内 分压变化速率为
分压变化速率为_______  。
。
③n点时反应的平衡常数
_______  。(提示:用分压计算的平衡常数为
。(提示:用分压计算的平衡常数为 ,分压等于总压×物质的量分数)
,分压等于总压×物质的量分数)
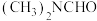 ,简称DMF]制备三甲胺:
,简称DMF]制备三甲胺: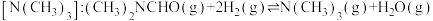
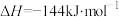 。
。(1)在上述反应中,每生成1g气态水,放出
(2)在铜催化剂表面发生上述反应的历程如图所示(催化剂表面吸附物种用“*”表示)。

①下列分步反应中,能垒最大的是
a.A→B b.C→D c.F→G
②A→B中,催化剂吸附放出的总能量
③D→E的化学方程式为
(3)向体积相等的I、II两个恒容密闭容器中分别充入1mol DMF(g)和
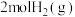 发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
①容器I中为
②在容器II中,0~12min内
 分压变化速率为
分压变化速率为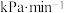 。
。③n点时反应的平衡常数

 。(提示:用分压计算的平衡常数为
。(提示:用分压计算的平衡常数为 ,分压等于总压×物质的量分数)
,分压等于总压×物质的量分数)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】甲醇是一种高效清洁的新能源,已知在常温常压下:
①CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH1=-184.0kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH2=-572.0kJ/mol
(1)则表示CH3OH(l)燃烧热的热化学方程式_______ 。
在恒温恒容的密闭容器中,工业上常用反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH1<0制备甲醇;其中的原料气常用反应②:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH2来制备。根据题意完成下列各题:
(2)判断反应①达到平衡状态的标志是_______ (填字母)。
a.容器中气体的压强不变
b.CO 和CH3OH 浓度相等
c.υ消耗(CH3OH)=υ生成(CO)
d.容器中混合气体的密度保持不变
e.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO的转化率,下列措施可行的是_______ (填字母)。
a.减小容器容积
b.升高温度
c.向装置中再充入He
d.向装置中再充入H2
(4)一定条件下,反应②中CH4的平衡转化率与温度的关系如图所示。
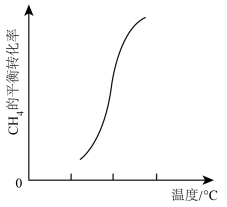
则ΔH2_______ 0(填“<”、“>”或“=”),在T℃时的10L密闭容器中,充入2molCH4和3molH2O(g)发生反应②,经过5min达到平衡,此时CH4的转化率为50%,则从开始到平衡,H2的平均反应速率为_______ 。若向此10L密闭容器中,加入2molCH4、5molH2O(g)、2molCO、和3molH2发生反应②,若温度仍为T℃,此时υ(正)_______ υ(逆)(填“<”、“>”或“=”)。
(5)若某温度下,将2molCH4(g)和2molH2O(g)充入到压强为200kPa的恒压密闭容器中发生反应②,平衡时CH4消耗50%时,求该温度下的分压平衡常数KP=_______ kPa2(分压=总压×物质的量分数)
①CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH1=-184.0kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH2=-572.0kJ/mol
(1)则表示CH3OH(l)燃烧热的热化学方程式
在恒温恒容的密闭容器中,工业上常用反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH1<0制备甲醇;其中的原料气常用反应②:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH2来制备。根据题意完成下列各题:
(2)判断反应①达到平衡状态的标志是
a.容器中气体的压强不变
b.CO 和CH3OH 浓度相等
c.υ消耗(CH3OH)=υ生成(CO)
d.容器中混合气体的密度保持不变
e.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO的转化率,下列措施可行的是
a.减小容器容积
b.升高温度
c.向装置中再充入He
d.向装置中再充入H2
(4)一定条件下,反应②中CH4的平衡转化率与温度的关系如图所示。

则ΔH2
(5)若某温度下,将2molCH4(g)和2molH2O(g)充入到压强为200kPa的恒压密闭容器中发生反应②,平衡时CH4消耗50%时,求该温度下的分压平衡常数KP=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CO2与生活和生产息息相关,其资源化是我国实现“碳达峰”、“碳中和”的有效途径之一、回答下列问题:
(1) CO2甲醇化:CO2、CO与H2反应制备甲醇,涉及的反应有:
Ⅰ. ;
;
Ⅱ.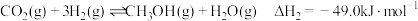 ;
;
Ⅲ. 。
。
①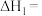
_______  。
。
②现利用反应Ⅰ和反应Ⅱ合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为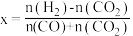 ,则理论上
,则理论上
_______ 时,原料气的利用率最高,生产中往往采用略高于该值的氢碳比,其目的是_______ 。
(2)CO2碳酸酯化:CO2与环氧丙烷反应合成碳酸丙烯酯,其反应历程如图甲所示(*表示某催化剂的活化中心或活性基团)。
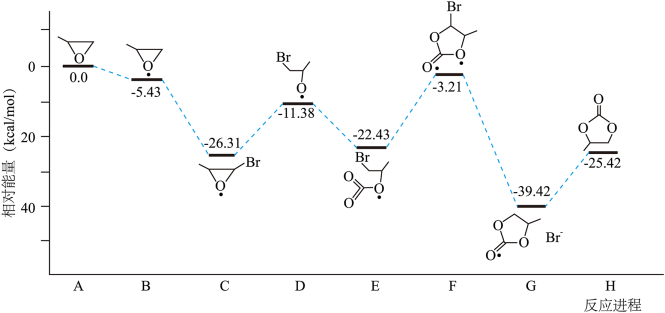
图甲
①H分子中 键与
键与 键的个数之比为
键的个数之比为_______ 。
②决定总反应速率大小的步骤是_______ (填字母),该步骤的能垒(活化能)为_______  。
。
a.A→B b.C→D c.E→F d.F→G
(3)CO2乙烯化:反应原理为2CO2(g)+6H2(g) C2H4(g)+4H2O(g),以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中发生反应,不同温度下平衡时的四种气态物质的物质的量分数如图乙所示,温度为
C2H4(g)+4H2O(g),以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中发生反应,不同温度下平衡时的四种气态物质的物质的量分数如图乙所示,温度为 、反应达到平衡状态时,容器内的压强为
、反应达到平衡状态时,容器内的压强为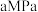 。
。
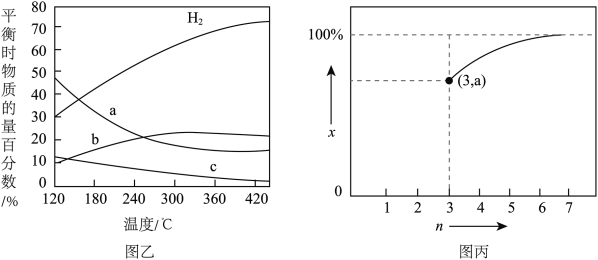
①120℃该反应的平衡常数Kp=_______ (列出算式,以平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②若以H2和CO2的物质的量之比为n:1( )进行投料,温度控制为120℃,相应平衡体系中CO2的转化率为x,x随
)进行投料,温度控制为120℃,相应平衡体系中CO2的转化率为x,x随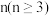 变化的关系如图丙所示,a=
变化的关系如图丙所示,a=_______ %(保留3位有效数字)。
(1) CO2甲醇化:CO2、CO与H2反应制备甲醇,涉及的反应有:
Ⅰ.
 ;
;Ⅱ.
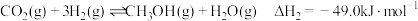 ;
;Ⅲ.
 。
。①
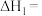
 。
。②现利用反应Ⅰ和反应Ⅱ合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为
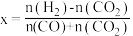 ,则理论上
,则理论上
(2)CO2碳酸酯化:CO2与环氧丙烷反应合成碳酸丙烯酯,其反应历程如图甲所示(*表示某催化剂的活化中心或活性基团)。

图甲
①H分子中
 键与
键与 键的个数之比为
键的个数之比为②决定总反应速率大小的步骤是
 。
。a.A→B b.C→D c.E→F d.F→G
(3)CO2乙烯化:反应原理为2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g),以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中发生反应,不同温度下平衡时的四种气态物质的物质的量分数如图乙所示,温度为
C2H4(g)+4H2O(g),以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中发生反应,不同温度下平衡时的四种气态物质的物质的量分数如图乙所示,温度为 、反应达到平衡状态时,容器内的压强为
、反应达到平衡状态时,容器内的压强为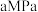 。
。
①120℃该反应的平衡常数Kp=
②若以H2和CO2的物质的量之比为n:1(
 )进行投料,温度控制为120℃,相应平衡体系中CO2的转化率为x,x随
)进行投料,温度控制为120℃,相应平衡体系中CO2的转化率为x,x随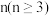 变化的关系如图丙所示,a=
变化的关系如图丙所示,a=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是_______ 。
②若起始时向容器内放入2molN2和6molH2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)_______ 184.4kJ。
③已知:

1molN-H键断裂吸收的能量等于_______ kJ。
④理论上,为了增大平衡时H2的转化率,可采取的措施是_______ (填序号)。
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的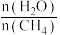 恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
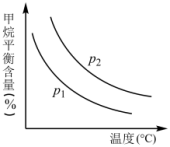
上图中两条曲线表示的压强的关系是:P1_______ P2(填“>”“=”或“<”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为_______ 。
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_______ (填序号)。
a.混合气体的平均相对分子质量不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中P(CO)、P(H2O)不随时间改变
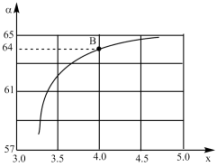
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(1),在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)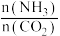 =x,下图是氨碳比(x)与CO2平衡转化率(α:%)的关系。下图中的B点处,NH3的平衡转化率为
=x,下图是氨碳比(x)与CO2平衡转化率(α:%)的关系。下图中的B点处,NH3的平衡转化率为_______ 。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是
②若起始时向容器内放入2molN2和6molH2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)
③已知:

1molN-H键断裂吸收的能量等于
④理论上,为了增大平衡时H2的转化率,可采取的措施是
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
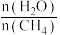 恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
上图中两条曲线表示的压强的关系是:P1
(3)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
a.混合气体的平均相对分子质量不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中P(CO)、P(H2O)不随时间改变
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(1),在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
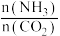 =x,下图是氨碳比(x)与CO2平衡转化率(α:%)的关系。下图中的B点处,NH3的平衡转化率为
=x,下图是氨碳比(x)与CO2平衡转化率(α:%)的关系。下图中的B点处,NH3的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】研究硫、氮及其化合物的性质,可以有效改善人类的生存环境。回答下列问题:
(1)利用电化学原理可将 、
、 转化为重要的化工原料,装置如图所示。
转化为重要的化工原料,装置如图所示。
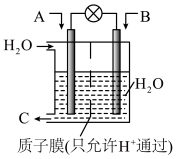
①若A为CO,B为 ,C为
,C为 ,则通入CO的一极为
,则通入CO的一极为_______ (填“正”或“负”)极,电极反应式为_______ 。
②若A为 ,B为O2,C为H2SO4,则负极的电极反应式为
,B为O2,C为H2SO4,则负极的电极反应式为_______ 。
(2)一定温度下,将 气体充入1L抽空的密闭容器中,发生反应:
气体充入1L抽空的密闭容器中,发生反应: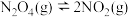 ,隔一定时间对该容器内的物质进行分析,得到下表:
,隔一定时间对该容器内的物质进行分析,得到下表:
根据以上信息回答下列问题:
①a_______ (填“>”、“<”或“=”)b,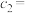
_______ (保留3位有效数字) 。
。
②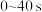 内,NO2的平均生成速率为
内,NO2的平均生成速率为_______  。
。
③反应时间为100s时,N2O4的转化率为_______ %。
(1)利用电化学原理可将
 、
、 转化为重要的化工原料,装置如图所示。
转化为重要的化工原料,装置如图所示。
①若A为CO,B为
 ,C为
,C为 ,则通入CO的一极为
,则通入CO的一极为②若A为
 ,B为O2,C为H2SO4,则负极的电极反应式为
,B为O2,C为H2SO4,则负极的电极反应式为(2)一定温度下,将
 气体充入1L抽空的密闭容器中,发生反应:
气体充入1L抽空的密闭容器中,发生反应: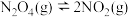 ,隔一定时间对该容器内的物质进行分析,得到下表:
,隔一定时间对该容器内的物质进行分析,得到下表:时间/s 浓度/(  ) ) | 0 | 20 | 40 | 60 | 80 | 100 |
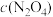 | 0.100 | 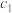 | 0.050 | 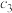 | a | b |
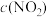 | 0.000 | 0.060 |  | 0.120 | 0.120 | 0.120 |
根据以上信息回答下列问题:
①a
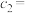
 。
。②
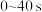 内,NO2的平均生成速率为
内,NO2的平均生成速率为 。
。③反应时间为100s时,N2O4的转化率为
您最近一年使用:0次



