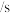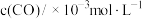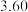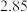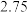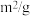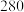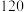1 . 下图是部分短周期元素的常见化合价与原子序数的关系图: 在周期表中的位置是
在周期表中的位置是______________________ 。
(2)用电子式表示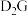 的形成过程为
的形成过程为_________________ 。
(3)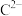 ,
,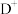 ,
,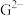 离子半径由大到小的顺序是
离子半径由大到小的顺序是______ (用离子符号表示)。
(4)某同学利用上图装置设计实验证明 ,
, ,
, 的非金属性强弱关系(已知硅酸难溶于水)。
的非金属性强弱关系(已知硅酸难溶于水)。______ (填化学式);溶液ⅲ为______ (填选项字母)。
a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液
c.饱和氢氧化钠溶液 d.饱和硅酸钠溶液
②装置丙中发生反应的离子方程式为_______________ 。
(5)将 投入
投入 的最高价氧化物对应的水化物中,其离子方程式为
的最高价氧化物对应的水化物中,其离子方程式为____________ 。

 在周期表中的位置是
在周期表中的位置是(2)用电子式表示
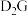 的形成过程为
的形成过程为(3)
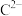 ,
,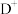 ,
,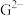 离子半径由大到小的顺序是
离子半径由大到小的顺序是(4)某同学利用上图装置设计实验证明
 ,
, ,
, 的非金属性强弱关系(已知硅酸难溶于水)。
的非金属性强弱关系(已知硅酸难溶于水)。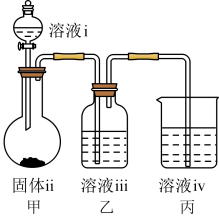
a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液
c.饱和氢氧化钠溶液 d.饱和硅酸钠溶液
②装置丙中发生反应的离子方程式为
(5)将
 投入
投入 的最高价氧化物对应的水化物中,其离子方程式为
的最高价氧化物对应的水化物中,其离子方程式为
您最近一年使用:0次
解题方法
2 . 某溶液呈酸性,可能含有: 、
、 、
、 、
、 、
、 、
、 中的若干种。对其进行如下实验:
中的若干种。对其进行如下实验:
Ⅰ.取少量溶液,向其中加入过量 ,生成白色沉淀
,生成白色沉淀 和无色气体
和无色气体 ,该无色气体在空气中变为红棕色。
,该无色气体在空气中变为红棕色。
Ⅱ.将Ⅰ中所得溶液滤去沉淀后,加入过量浓 溶液,生成无色气体,最终得到红棕色沉淀
溶液,生成无色气体,最终得到红棕色沉淀 。
。
(1)上述6种离子中,该溶液肯定存在的为____________ ,肯定不存在 的为______ ,不能 确定是否存在的为______ 。
(2)请设计实验检验原溶液中是否存在 ,写出操作方法、现象及结论
,写出操作方法、现象及结论___________ 。
(3)生成无色气体 的离子方程式为
的离子方程式为____________ 。
(4)步骤Ⅱ中发生反应的离子方程式为___________________ 。
 、
、 、
、 、
、 、
、 、
、 中的若干种。对其进行如下实验:
中的若干种。对其进行如下实验:Ⅰ.取少量溶液,向其中加入过量
 ,生成白色沉淀
,生成白色沉淀 和无色气体
和无色气体 ,该无色气体在空气中变为红棕色。
,该无色气体在空气中变为红棕色。Ⅱ.将Ⅰ中所得溶液滤去沉淀后,加入过量浓
 溶液,生成无色气体,最终得到红棕色沉淀
溶液,生成无色气体,最终得到红棕色沉淀 。
。(1)上述6种离子中,该溶液肯定存在的为
(2)请设计实验检验原溶液中是否存在
 ,写出操作方法、现象及结论
,写出操作方法、现象及结论(3)生成无色气体
 的离子方程式为
的离子方程式为(4)步骤Ⅱ中发生反应的离子方程式为
您最近一年使用:0次
名校
3 . 利用催化技术可将汽车尾气中的CO和NO转化为 和
和 ,化学方程式:
,化学方程式: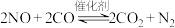 。
。
(1)某温度下,在恒容的密闭容器中通入CO和NO,测得不同时间CO的浓度如下表:
用CO的浓度变化表示0-2s的平均反应速率为______  。
。
(2)下列可说明反应达到平衡状态的是______ 。
a.CO的浓度不再改变
b.容器中的气体质量保持不变
c.NO、CO、 、
、 的浓度之比为2∶2∶2∶1
的浓度之比为2∶2∶2∶1
d.相同时间内,反应消耗2molNO同时消耗
(3)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
【实验分析与结论】
①补全表格a.______ ,b.______ ,c.______ 。
②测得 ,对比实验Ⅰ、Ⅲ,可得结论:
,对比实验Ⅰ、Ⅲ,可得结论:______ 。
③通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验Ⅰ、Ⅱ,
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
 和
和 ,化学方程式:
,化学方程式: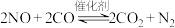 。
。(1)某温度下,在恒容的密闭容器中通入CO和NO,测得不同时间CO的浓度如下表:
时间 |
|
|
|
| …… |
|
|
|
|
| …… |
 。
。(2)下列可说明反应达到平衡状态的是
a.CO的浓度不再改变
b.容器中的气体质量保持不变
c.NO、CO、
 、
、 的浓度之比为2∶2∶2∶1
的浓度之比为2∶2∶2∶1d.相同时间内,反应消耗2molNO同时消耗

(3)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
实验编号 | 实验目的 |
| 同种催化剂的比表面积 | 达平衡时所用的时间 |
Ⅰ | 对照实验 |
|
|
|
Ⅱ |
|
|
|
|
Ⅲ | 研究温度对尾气转化速率的影响 |
|
|
|
①补全表格a.
②测得
 ,对比实验Ⅰ、Ⅲ,可得结论:
,对比实验Ⅰ、Ⅲ,可得结论:③通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验Ⅰ、Ⅱ,

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2024-05-08更新
|
201次组卷
|
6卷引用:北京市西城区2020-2021学年高一下学期期末联考化学试题
北京市西城区2020-2021学年高一下学期期末联考化学试题北京市第十四中学2022-2023学年高一下学期期中化学试题北京市第三中学2022-2023学年高一下学期期中考试化学试题北京市第二十二中学2023-2024学年高一下学期期中考试化学试题(已下线)重难点02 速率与平衡综合题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)名校期末好题汇编-化学反应与能量(非选择题)
4 . 从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78,回答下列问题:
(1)A的电子式为_______ ,B的结构简式为_______ 。
(2)A能使溴的四氯化碳溶液褪色的化学反应方程式为_______ ,反应类型为_______ 。
(3)在碘水中加入B振荡静置后的现象是_______ 。
(4)B与浓硫酸和浓硝酸在 反应的化学反应方程式为
反应的化学反应方程式为______ ,反应类型为______ 。
(1)A的电子式为
(2)A能使溴的四氯化碳溶液褪色的化学反应方程式为
(3)在碘水中加入B振荡静置后的现象是
(4)B与浓硫酸和浓硝酸在
 反应的化学反应方程式为
反应的化学反应方程式为
您最近一年使用:0次
5 . 为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯(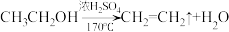 ),生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。请回答下列问题:
),生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。请回答下列问题:
(1)甲同学设计的实验___  填“能”或“不能”
填“能”或“不能” 验证乙烯与溴水发生了加成反应,其理由是
验证乙烯与溴水发生了加成反应,其理由是____  填字母
填字母 。
。
A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯 D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中必定含有一种杂质气体是_______ ,它与溴水反应的化学方程式是_______ ,在验证过程中必须全部除去。为此乙同学设计了如图所示的实验装置:_______ Ⅱ_______ Ⅲ_______ Ⅳ_______  选填序号
选填序号 。
。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液。
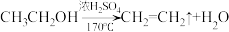 ),生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。请回答下列问题:
),生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。请回答下列问题:(1)甲同学设计的实验
 填“能”或“不能”
填“能”或“不能” 验证乙烯与溴水发生了加成反应,其理由是
验证乙烯与溴水发生了加成反应,其理由是 填字母
填字母 。
。A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯 D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中必定含有一种杂质气体是
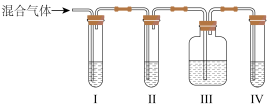
 选填序号
选填序号 。
。A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液。
您最近一年使用:0次
解题方法
6 . A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物均未列出)。_______ ;物质E的结构式为_______ ;反应①的化学方程式为_______ 。
(2)若A是常见的金属单质,D是气态非金属单质,F是液态非金属单质,反应①、②都在溶液中进行,写出A所含元素在周期表中的位置:____ ;物质C与等物质的量的Cl2在溶液中反应的离子方程式为_____ 。
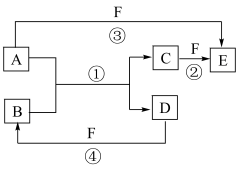
(2)若A是常见的金属单质,D是气态非金属单质,F是液态非金属单质,反应①、②都在溶液中进行,写出A所含元素在周期表中的位置:
您最近一年使用:0次
7 . 下列物质之间有如下反应关系:
(1)写出下列物质的化学式:
A___________ B___________ D___________ 甲___________ 乙___________ 丙___________ ;
(2)写出E→C反应的化学方程式:___________ ;
(3)写出B+丙反应的离子方程式:___________ 。
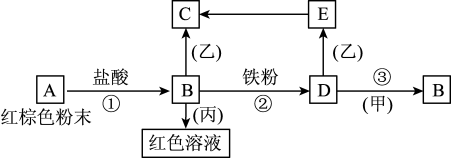
(1)写出下列物质的化学式:
A
(2)写出E→C反应的化学方程式:
(3)写出B+丙反应的离子方程式:
您最近一年使用:0次
8 . (Ⅰ)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。
(1)①A与E形成的化合物的化学式是___________ 。
②B的最高价氧化物化学式为___________ 。
③C元素的名称为___________ 。
(2)D的单质与水反应的化学方程式为:___________ 。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是___________ ,有关反应的离子方程式为:
___________ ,___________ 。
(Ⅱ) A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子。其中A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;常温下E是一种强氧化性气体。请回答:
(4)用化学符号表示上述5种微粒:A___________ ,B___________ ,C___________ ,D___________ ,E___________ 。
(5)在水溶液中A跟B反应的离子方程式是___________ 。
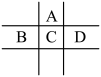
(1)①A与E形成的化合物的化学式是
②B的最高价氧化物化学式为
③C元素的名称为
(2)D的单质与水反应的化学方程式为:
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
(Ⅱ) A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子。其中A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;常温下E是一种强氧化性气体。请回答:
(4)用化学符号表示上述5种微粒:A
(5)在水溶液中A跟B反应的离子方程式是
您最近一年使用:0次
9 . 拟用如图装置设计实验来探究纯净、干燥的氯气与氨气的反应。___________ 。
(2)如图中的装置连接顺序为A→___________ (用大写字母表示)。若按照正确顺序连接实验装置后,整套实验装置存在的主要缺点___________ 。
(3)写出F装置中的反应的一种工业用途:___________ 。
(4)在工业上利用反应N2+3H2 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是___________ (填字母)。
A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)

(2)如图中的装置连接顺序为A→
(3)写出F装置中的反应的一种工业用途:
(4)在工业上利用反应N2+3H2
 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)
您最近一年使用:0次
名校
解题方法
10 . 工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为 和
和 ),其反应的化学方程式为
),其反应的化学方程式为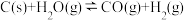 ,请回答下列问题:
,请回答下列问题:
(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是__________。
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是__________。
(3)在体积均为 的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和
的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和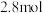 水蒸气,在不同温度下反应的过程如下图所示:
水蒸气,在不同温度下反应的过程如下图所示: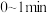 内的平均反应速率
内的平均反应速率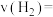
________ 。
②甲容器中,A点正反应速率__________ B点的逆反应速率(填“<”“>”或“=”)。
③反应过程中,两个容器温度:甲__________ 乙(填“<” “>”或“=”)。
④乙容器中C点时, 的物质的量百分数为
的物质的量百分数为__________ 。
(4)在 溶液条件下,以
溶液条件下,以 为原料,可制成一种燃料电池,写出该电池的负极反应式
为原料,可制成一种燃料电池,写出该电池的负极反应式____________________ ,当燃料电池消耗 (标况下)时,正极上有
(标况下)时,正极上有_________ 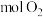 参与反应。
参与反应。
 和
和 ),其反应的化学方程式为
),其反应的化学方程式为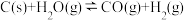 ,请回答下列问题:
,请回答下列问题:(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是__________。
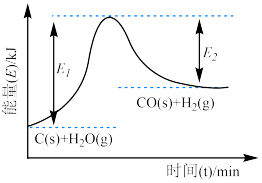
| A.铝粉与氧化铁的反应 | B.氯化铵与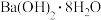 的反应 的反应 |
| C.锌片与稀硫酸的反应 | D.钠与冷水的反应 |
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是__________。
A.充入 使容器压强增大,提高反应速率 使容器压强增大,提高反应速率 |
B.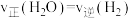 ,说明反应达到平衡状态 ,说明反应达到平衡状态 |
| C.容器中焦炭的质量不再变化,说明反应达到平衡状态 |
D.容器中水蒸气与氢气的体积比为 时,说明反应达到平衡状态 时,说明反应达到平衡状态 |
(3)在体积均为
 的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和
的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和 水蒸气,在不同温度下反应的过程如下图所示:
水蒸气,在不同温度下反应的过程如下图所示: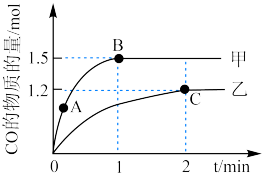
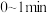 内的平均反应速率
内的平均反应速率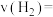
②甲容器中,A点正反应速率
③反应过程中,两个容器温度:甲
④乙容器中C点时,
 的物质的量百分数为
的物质的量百分数为(4)在
 溶液条件下,以
溶液条件下,以 为原料,可制成一种燃料电池,写出该电池的负极反应式
为原料,可制成一种燃料电池,写出该电池的负极反应式 (标况下)时,正极上有
(标况下)时,正极上有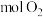 参与反应。
参与反应。
您最近一年使用:0次
2024-04-10更新
|
475次组卷
|
3卷引用:广东省深圳市宝安中学高中部2020-2021学年高一下学期期中考试化学试卷