名校
解题方法
1 . 醋酸亚铬 为砖红色晶体,难溶于冷水,易与酸反应,可用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌将三价铬反应为二价铬;二价铬再与醋酸钠
为砖红色晶体,难溶于冷水,易与酸反应,可用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌将三价铬反应为二价铬;二价铬再与醋酸钠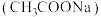 溶液作用即可制得醋酸亚铬。实验装置如图所示,试回答下列问题:
溶液作用即可制得醋酸亚铬。实验装置如图所示,试回答下列问题:___________ ,仪器a的名称是___________ 。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开 ,关闭
,关闭 ,c中溶液由绿色逐渐变为亮蓝色,同时c中有气体产生,写出生成该气体的化学方程式
,c中溶液由绿色逐渐变为亮蓝色,同时c中有气体产生,写出生成该气体的化学方程式___________ ,在这一步中该气体的作用是___________ 。
(3)打开___________ ,关闭___________ ,c中亮蓝色溶液流入d,d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________ 、___________ 、洗涤、干燥。
(4)指出装置d可能存在的缺点___________ 。
 为砖红色晶体,难溶于冷水,易与酸反应,可用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌将三价铬反应为二价铬;二价铬再与醋酸钠
为砖红色晶体,难溶于冷水,易与酸反应,可用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌将三价铬反应为二价铬;二价铬再与醋酸钠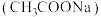 溶液作用即可制得醋酸亚铬。实验装置如图所示,试回答下列问题:
溶液作用即可制得醋酸亚铬。实验装置如图所示,试回答下列问题:
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开
 ,关闭
,关闭 ,c中溶液由绿色逐渐变为亮蓝色,同时c中有气体产生,写出生成该气体的化学方程式
,c中溶液由绿色逐渐变为亮蓝色,同时c中有气体产生,写出生成该气体的化学方程式(3)打开
(4)指出装置d可能存在的缺点
您最近一年使用:0次
2 . 回答下列问题。
Ⅰ.某实验小组有盐酸、氢氧化钠、碳酸钠和氯化钠4种无色溶液。各取少量于4支试管中,分别向试管中滴入紫色石蕊试液。
(1)先被鉴别出来的两种物质为_______ 、_______ (填写化学式),鉴别依据为_______ 。
(2)该小组不用其他试剂即将另外两种溶液鉴别开来,请写出其中一个有明显现象的化学方程式_______ 。
Ⅱ.证据推理是科学探究的基本方法。已知某无色溶液A中的溶质可能是 和
和 或两者之一,另一种无色溶液B,其中的溶质可能是
或两者之一,另一种无色溶液B,其中的溶质可能是 和
和 或两者之一、按下图所示进行探究实验,出现的现象如图所述(设过程中所有发生的反应都恰好完全反应)。
或两者之一、按下图所示进行探究实验,出现的现象如图所述(设过程中所有发生的反应都恰好完全反应)。
(3)将气体F通入紫色石蕊试液,试液变_______ 色。
(4)在溶液G中,一定存在的阳离子是_______ (填写离子符号)。
(5)写出步骤③中生成沉淀H的化学方程式:_______ 。
(6)根据上述实验,在样品溶液B中,能够确定存在的溶质是_______ (填写化学式),得出此结论的理由是_______ 。
Ⅰ.某实验小组有盐酸、氢氧化钠、碳酸钠和氯化钠4种无色溶液。各取少量于4支试管中,分别向试管中滴入紫色石蕊试液。
(1)先被鉴别出来的两种物质为
(2)该小组不用其他试剂即将另外两种溶液鉴别开来,请写出其中一个有明显现象的化学方程式
Ⅱ.证据推理是科学探究的基本方法。已知某无色溶液A中的溶质可能是
 和
和 或两者之一,另一种无色溶液B,其中的溶质可能是
或两者之一,另一种无色溶液B,其中的溶质可能是 和
和 或两者之一、按下图所示进行探究实验,出现的现象如图所述(设过程中所有发生的反应都恰好完全反应)。
或两者之一、按下图所示进行探究实验,出现的现象如图所述(设过程中所有发生的反应都恰好完全反应)。
(3)将气体F通入紫色石蕊试液,试液变
(4)在溶液G中,一定存在的阳离子是
(5)写出步骤③中生成沉淀H的化学方程式:
(6)根据上述实验,在样品溶液B中,能够确定存在的溶质是
您最近一年使用:0次
名校
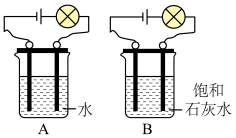
3 . 某化学兴趣小组用如图所示的装置,对氢氧化钙溶液进行探究。_______ ;通电相同时间,发现B装置中两个电极附近产生气泡比A装置多,此条件下产生气泡的化学方程式为_______ 。
(2)接通直流电,同时利用温度传感器测量溶液的温度。观察到B装置中插入溶液的两个碳棒(石墨)电极附近有气泡产生,一段时间后发现烧杯中的溶液的温度由 变为
变为 ,同时出现白色浑浊,这可能是因为析出了氢氧化钙固体,析出氢氧化钙固体的原因可能是
,同时出现白色浑浊,这可能是因为析出了氢氧化钙固体,析出氢氧化钙固体的原因可能是_______ ,还可能是_______ 。
(3)仔细观察,发现B装置中,白色浑浊出现在正极附近。联想电解水时,与电源正极相连的电极附近产生的_______ 气,它可能与石墨电极中的碳反应生成二氧化碳而使石灰水变浑浊,如果假设成立,则最后一步反应的化学方程式为_______ 。为了验证白色浑浊液体的成分,取上述实验得到的浑浊液体少量,滴加酚酞变红色,说明浑浊液体中还存在_______ 。
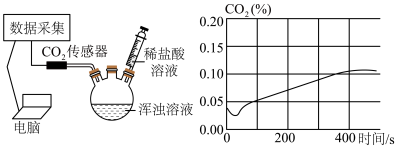
(4)将B装置中剩余浑浊液搅拌均匀后分成等体积的两份,第一组同学取一份加入一定量的稀盐酸,没有发现气泡产生。第二组同学取另一份倒入密封的三颈烧瓶中进行数字化实验。连接好传感器等装置,先开启测量二氧化碳含量的数据传感器,然后用注射器注入足量的稀盐酸数字化实验装置及所测量到的二氧化碳体积分数变化情况如图。_______ (除水外)。
实验反思:
①第一组同学的实验中,没有发现产生气泡,原因可能是_______ 。
②第二组同学在数字化实验中,发现曲线图开始时段的 百分比下降,可能的原因是
百分比下降,可能的原因是_______ 。
(2)接通直流电,同时利用温度传感器测量溶液的温度。观察到B装置中插入溶液的两个碳棒(石墨)电极附近有气泡产生,一段时间后发现烧杯中的溶液的温度由
 变为
变为 ,同时出现白色浑浊,这可能是因为析出了氢氧化钙固体,析出氢氧化钙固体的原因可能是
,同时出现白色浑浊,这可能是因为析出了氢氧化钙固体,析出氢氧化钙固体的原因可能是(3)仔细观察,发现B装置中,白色浑浊出现在正极附近。联想电解水时,与电源正极相连的电极附近产生的
(4)将B装置中剩余浑浊液搅拌均匀后分成等体积的两份,第一组同学取一份加入一定量的稀盐酸,没有发现气泡产生。第二组同学取另一份倒入密封的三颈烧瓶中进行数字化实验。连接好传感器等装置,先开启测量二氧化碳含量的数据传感器,然后用注射器注入足量的稀盐酸数字化实验装置及所测量到的二氧化碳体积分数变化情况如图。
实验反思:
①第一组同学的实验中,没有发现产生气泡,原因可能是
②第二组同学在数字化实验中,发现曲线图开始时段的
 百分比下降,可能的原因是
百分比下降,可能的原因是
您最近一年使用:0次
4 . 下表列出9种元素在元素周期表(元素周期表只给出部分)中的位置
(1)考古工作者利用表中某元素的一种核素测定一些文物的年代,这种核素的原子符号是________ 。
(2)由元素②和元素④形成原子个数比为1:2的化合物的电子式为________ 。
(3)元素⑦的最高价氧化物与元素⑥的最高价氧化物的水化物的水溶液反应的离子方程式为________ 。
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是________ (填化学式,用“>”连接)。
(5)元素④和⑥形成的淡黄色固体与元素①和④形成的常用化合物反应的离子方程式为________ 。
(6)将元素⑧的单质通入元素⑥和⑨形成的化合物水溶液中,观察到的现象是________ 。

(1)考古工作者利用表中某元素的一种核素测定一些文物的年代,这种核素的原子符号是
(2)由元素②和元素④形成原子个数比为1:2的化合物的电子式为
(3)元素⑦的最高价氧化物与元素⑥的最高价氧化物的水化物的水溶液反应的离子方程式为
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是
(5)元素④和⑥形成的淡黄色固体与元素①和④形成的常用化合物反应的离子方程式为
(6)将元素⑧的单质通入元素⑥和⑨形成的化合物水溶液中,观察到的现象是
您最近一年使用:0次
5 . 《物理小识·金石类》记载:“青矾厂气熏人,衣服当之易烂,载木不盛”,“青矾强热,得赤色固体,气凝即得矾油”。“青矾”是指 ,“青矾厂气”是指
,“青矾厂气”是指 和
和 ,“矾油”是指硫酸溶液。实验室模拟古法制硫酸并进行
,“矾油”是指硫酸溶液。实验室模拟古法制硫酸并进行 性质探究。
性质探究。 熔点
熔点 ,沸点
,沸点 熔点
熔点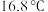 ,沸点
,沸点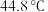 。
。
回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。
(1)盛放钡盐溶液仪器的名称为_______ 。A装置中反应后所得固体的化学式为_______ 。
(2)B装置的作用_______ 。
(3)D的作用是_______ (用离子方程式表示)。
Ⅱ.探究 的性质
的性质
在装置 中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通入
中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通入 流速一致。两次实验分别得到如图
流速一致。两次实验分别得到如图 图:
图:_______ 。
(5) 图中,②的曲线出现骤降,这是因为
图中,②的曲线出现骤降,这是因为 _______ (用化学方程式表示)。对比分析上述两组数据,可得出的结论是_______ 。
 ,“青矾厂气”是指
,“青矾厂气”是指 和
和 ,“矾油”是指硫酸溶液。实验室模拟古法制硫酸并进行
,“矾油”是指硫酸溶液。实验室模拟古法制硫酸并进行 性质探究。
性质探究。
 熔点
熔点 ,沸点
,沸点 熔点
熔点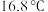 ,沸点
,沸点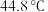 。
。回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞
 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。(1)盛放钡盐溶液仪器的名称为
(2)B装置的作用
(3)D的作用是
Ⅱ.探究
 的性质
的性质在装置
 中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通入
中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通入 流速一致。两次实验分别得到如图
流速一致。两次实验分别得到如图 图:
图:
(5)
 图中,②的曲线出现骤降,这是因为
图中,②的曲线出现骤降,这是因为
您最近一年使用:0次
名校
6 . 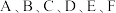 是原子序数依次增大的短周期主族元素,A元素的一种原子原子核内没有中子,C的最外层电子数是次外层电子数的3倍,
是原子序数依次增大的短周期主族元素,A元素的一种原子原子核内没有中子,C的最外层电子数是次外层电子数的3倍, 最外层电子数相同,F原子核外排布与氟相同,
最外层电子数相同,F原子核外排布与氟相同, 的最外层电子数与B的核外电子总数相等,D为同周期原子半径最大的元素。
的最外层电子数与B的核外电子总数相等,D为同周期原子半径最大的元素。
(1)B元素在元素周期表中的位置为_______ 。
(2)D的最高价氧化物的水化物中含有的化学键类型_______ (填离子键、极性键、非极性键)。由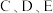 形成的简单离子的半径由大到小排列
形成的简单离子的半径由大到小排列_______ (用离子符号表示)。
(3)由元素A和B可形成四核10电子的分子,写出该分子的化学式:_______ 。
(4)请写出D最高价氧化物对应水化物与 最高价氧化物对应水化物反应的离子方程式:
最高价氧化物对应水化物反应的离子方程式:_______ 。
(5)元素 与元素
与元素 相比,非金属性较强的是
相比,非金属性较强的是_______ (用元素符号表示)。
(6)化合物 的名称为碘酸碘,其中碘元素的化合价有
的名称为碘酸碘,其中碘元素的化合价有 和
和 价两种,则
价两种,则 的化学式为_______。
的化学式为_______。
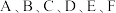 是原子序数依次增大的短周期主族元素,A元素的一种原子原子核内没有中子,C的最外层电子数是次外层电子数的3倍,
是原子序数依次增大的短周期主族元素,A元素的一种原子原子核内没有中子,C的最外层电子数是次外层电子数的3倍, 最外层电子数相同,F原子核外排布与氟相同,
最外层电子数相同,F原子核外排布与氟相同, 的最外层电子数与B的核外电子总数相等,D为同周期原子半径最大的元素。
的最外层电子数与B的核外电子总数相等,D为同周期原子半径最大的元素。(1)B元素在元素周期表中的位置为
(2)D的最高价氧化物的水化物中含有的化学键类型
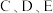 形成的简单离子的半径由大到小排列
形成的简单离子的半径由大到小排列(3)由元素A和B可形成四核10电子的分子,写出该分子的化学式:
(4)请写出D最高价氧化物对应水化物与
 最高价氧化物对应水化物反应的离子方程式:
最高价氧化物对应水化物反应的离子方程式:(5)元素
 与元素
与元素 相比,非金属性较强的是
相比,非金属性较强的是(6)化合物
 的名称为碘酸碘,其中碘元素的化合价有
的名称为碘酸碘,其中碘元素的化合价有 和
和 价两种,则
价两种,则 的化学式为_______。
的化学式为_______。A.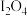 | B.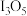 | C.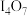 | D.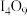 |
您最近一年使用:0次
名校
7 . 铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有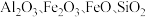 等)来制备绿矾
等)来制备绿矾 和
和 ,其工艺流程如图:
,其工艺流程如图: 、
、 。
。
回答下列问题:
(1)滤渣1的成分是:_______ (填化学式)。
(2)往滤液2中加入过量的试剂A是_______ (填标号)。
 氨水
氨水  盐酸
盐酸  氢氧化钠溶液
氢氧化钠溶液
(3)过程1涉及的分离操作为_______ 。
(4)若向溶液A中加入硫氰化钾所发生的离子方程式为:_______ 。
(5)写出 溶液与酸性高锰酸钾溶液所发生的离子方程式并用单线桥表示电子转移的方向与数目:
溶液与酸性高锰酸钾溶液所发生的离子方程式并用单线桥表示电子转移的方向与数目:_______ 。
(6)由溶液B得到绿矾晶体,须进行的实验操作为_______ 、冷却结晶、过滤、洗涤、干燥。
(7)某工厂用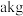 矿石(含铁元素
矿石(含铁元素 )制备绿矾
)制备绿矾 ,最终得到产品
,最终得到产品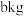 ,产率为
,产率为_______ 。
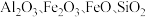 等)来制备绿矾
等)来制备绿矾 和
和 ,其工艺流程如图:
,其工艺流程如图: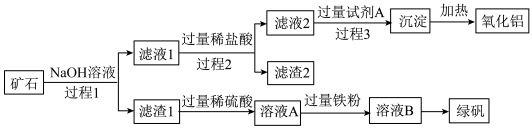
 、
、 。
。回答下列问题:
(1)滤渣1的成分是:
(2)往滤液2中加入过量的试剂A是
 氨水
氨水  盐酸
盐酸  氢氧化钠溶液
氢氧化钠溶液(3)过程1涉及的分离操作为
(4)若向溶液A中加入硫氰化钾所发生的离子方程式为:
(5)写出
 溶液与酸性高锰酸钾溶液所发生的离子方程式并用单线桥表示电子转移的方向与数目:
溶液与酸性高锰酸钾溶液所发生的离子方程式并用单线桥表示电子转移的方向与数目:(6)由溶液B得到绿矾晶体,须进行的实验操作为
(7)某工厂用
 矿石(含铁元素
矿石(含铁元素 )制备绿矾
)制备绿矾 ,最终得到产品
,最终得到产品 ,产率为
,产率为
您最近一年使用:0次
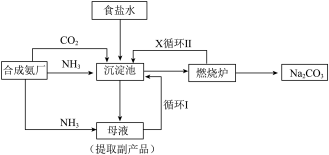
8 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示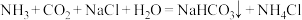 。
。
(1)“侯氏制碱法”誉满全球,其中的“碱”为_______ ,俗称_______ 。
(2)实验室模拟“侯氏制碱法”,下列操作未涉及的是_______。
(3)燃烧炉中发生反应的化学方程式为_______ 。
(4)使用原料氯化钠的利用率从70%提高到90%以上,主要是设计了_______ (填I或Ⅱ)的循环。上述流程中X的分子式_______ 。
(5)该流程提取的副产品为_______ 。
(6)为验证产品是否含有NaCl,可取少量试样溶于水后,_______ ,则证明含有NaCl。
 。
。(1)“侯氏制碱法”誉满全球,其中的“碱”为
(2)实验室模拟“侯氏制碱法”,下列操作未涉及的是_______。
A. | B. | C. | D. |
(3)燃烧炉中发生反应的化学方程式为
(4)使用原料氯化钠的利用率从70%提高到90%以上,主要是设计了
(5)该流程提取的副产品为
(6)为验证产品是否含有NaCl,可取少量试样溶于水后,
您最近一年使用:0次
9 . 为充分利用资源,变废为宝,某研究小组采用废铁(主要成分为铁)制备硫酸铁,主要流程如下(部分 条件省略) :
(1)步骤①中主要反应的离子方程式是___________ 。
(2)分离废渣与FeSO4溶液的操作是___________ (选填“过滤”或“蒸发”)。
(3)步骤②中加入H2O2溶液发生的反应类型是___________ (选填“氧化还原反应”或“非氧化还原反应”);产生的现象是___________ 。
(4)检验SO42-的实验操作是___________ 。
(5)废铁中含有少量硫化物,反应产生的副产物与H2S,可用___________ 吸收(填选项代号)。
A.稀硫酸 B.氢氧化钠溶液 C.硫酸钠溶液
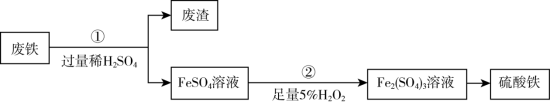
(1)步骤①中主要反应的离子方程式是
(2)分离废渣与FeSO4溶液的操作是
(3)步骤②中加入H2O2溶液发生的反应类型是
(4)检验SO42-的实验操作是
(5)废铁中含有少量硫化物,反应产生的副产物与H2S,可用
A.稀硫酸 B.氢氧化钠溶液 C.硫酸钠溶液
您最近一年使用:0次
解题方法
10 . 工业上以黄铁矿为原料制备硫酸的原理示意图如下。
(1)黄铁矿主要成分的化学式是_______ 。
(2)SO2使品红溶液褪色,体现SO2具有_______ 性。
(3)步骤Ⅲ的化学方程式是_______ 。
(4)下列说法不正确 的是_______。

(1)黄铁矿主要成分的化学式是
(2)SO2使品红溶液褪色,体现SO2具有
(3)步骤Ⅲ的化学方程式是
(4)下列说法
| A.步骤Ⅰ前需将黄铁矿粉碎,目的是增大接触面积,加快反应速率 |
| B.步骤Ⅱ中使用催化剂,能使SO2的转化率达到100% |
| C.步骤Ⅲ中选用98.3%的浓硫酸作吸收剂 |
| D.图中每一步含硫物质均发生氧化反应 |
您最近一年使用:0次



