1 . 抗肿瘤药Pelitinib的合成
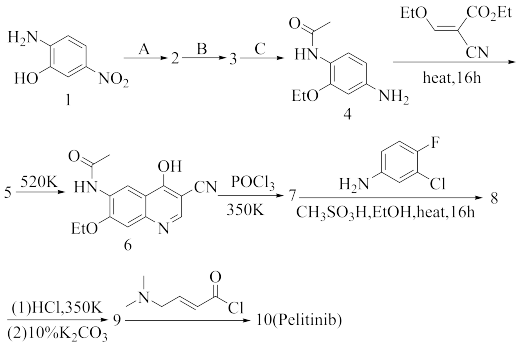
(1)写出上述各步合成反应产物2,3,5,7,8,9,10的结构简式、步骤A,B,C所需的试剂及必要的反应条件_______ 。
(2)化合物4在加热回流条件下与2-氰基-3-乙氧基丙烯酸乙酯反应经中间体5a转化为5,化合物5在250℃条件下经6a,6b中间体得到6:

画出中间体5a,6a,6b的结构简式_______ 。

(1)写出上述各步合成反应产物2,3,5,7,8,9,10的结构简式、步骤A,B,C所需的试剂及必要的反应条件
(2)化合物4在加热回流条件下与2-氰基-3-乙氧基丙烯酸乙酯反应经中间体5a转化为5,化合物5在250℃条件下经6a,6b中间体得到6:

画出中间体5a,6a,6b的结构简式
您最近一年使用:0次
2 . 光刻胶
化合物E是一种负型光致抗蚀剂(又称光刻胶),大量用于印刷制版和电子工业的光刻技术中。其合成方法如下:
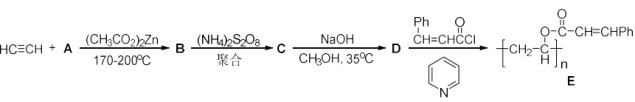
(1)用结构简式表示A,B,C,D的结构_______ 、_______ 、_______ 、_______ 。
(2)光刻制版时,光刻胶E在紫外光照射下生成F,溶解度下降。不见光的部分不反应,用溶剂溶解后得到影像。画出F的结构简式_______ 。
化合物E是一种负型光致抗蚀剂(又称光刻胶),大量用于印刷制版和电子工业的光刻技术中。其合成方法如下:

(1)用结构简式表示A,B,C,D的结构
(2)光刻制版时,光刻胶E在紫外光照射下生成F,溶解度下降。不见光的部分不反应,用溶剂溶解后得到影像。画出F的结构简式
您最近一年使用:0次
3 . 立方晶系二元合金
有一立方晶系二元合金,单胞参数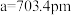 。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体
。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体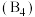 ,已知晶胞中
,已知晶胞中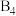 的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
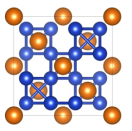
(1)写出二元合金的化学式_______ 。
(2)已知金属A和B的原子量分别为24.31和53.55,计算合金的理论密度_______ 。
(3)晶胞的单位点阵型式_______ 。
(4)实际上,大部分该类结构二元合金的原子半径比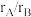 处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和
处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和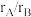 值
值_______ 、_______ 。
有一立方晶系二元合金,单胞参数
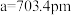 。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体
。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体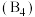 ,已知晶胞中
,已知晶胞中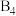 的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
(1)写出二元合金的化学式
(2)已知金属A和B的原子量分别为24.31和53.55,计算合金的理论密度
(3)晶胞的单位点阵型式
(4)实际上,大部分该类结构二元合金的原子半径比
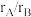 处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和
处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和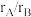 值
值
您最近一年使用:0次
解题方法
4 . 氟及化合物
(1)德国人斯瓦恩哈德是从事玻璃加工的一名工人。1670年,他无意中将萤石与浓硫酸1∶1混合在一起,结果产生了一种具有刺激性气味的烟雾,他发现这种气体能腐蚀玻璃,从而研究出一种不用金刚石或其他磨料也可以在玻璃上刻蚀图案的方法。利用这种方法,斯瓦恩哈德制成了许多玻璃艺术品,成为有名的玻璃雕刻艺术家。写出上述化学反应方程式_______ 。
(2)单质氟的制备是化学史上一段悲壮的历史,有多位化学家中毒,甚至付出生命,但是化学家们不畏艰难、前仆后继。终于,1886年法国化学家莫瓦桑在总结前人经验与教训的基础上,在低温下电解熔融的氟化氢钾制得单质氟,这距离氢氟酸的发现已经过去一百多年之久。写出电解制备单质氟的反应方程式_______ 。
(3)又过了整整一百年,化学方法制取F2获得成功。其步骤如下:在 存在下,用
存在下,用 氧化
氧化 ;
; 和HF反应;
和HF反应;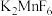 和
和 反应。写出各步的化学反应方程式
反应。写出各步的化学反应方程式_______ 、_______ 、_______ 。
(4)氟单质的反应性非常强,可与稀有气体氙发生反应。已知:
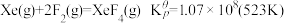 ,
,
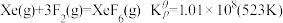 ,
,
XeF6的立方晶型中有四聚体单元, 与其中5个F的键长为
与其中5个F的键长为 ,与第6个F的键长为
,与第6个F的键长为 。
。
①在满足反应速率的前题下,应如何控制温度才有利于 的生成
的生成_______ 。
②若在523K下以Xe和F2制取XeF6,并使产物中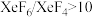 ,计算说明F2的平衡分压至少应保持在标准压力的
,计算说明F2的平衡分压至少应保持在标准压力的_______ 倍(精确到小数点后第一位)?
③指出XeF6气体的分子构型_______ 。
④说明XeF6晶体中存在着什么样的离子_______ ?画出正离子的构型简图_______ 。
⑤按照电子理论,将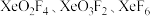 酸性从大到小的顺序排列
酸性从大到小的顺序排列_______ 。
(5)法国科学家盖·吕萨克也曾试图制备氢氟酸。1809年,他把氟化钙与硼酸混和加热,但是却意外地制成了一种所谓的“氟酸气”A。气体A可与 发生反应,生成多卤阳离子B和一四面体阴离子C,写出离子反应方程式
发生反应,生成多卤阳离子B和一四面体阴离子C,写出离子反应方程式_______ ,画B的结构简图_______ ;将A通入碳酸钠溶液也可发生反应,写出离子反应方程式_______ 。
(6)氟与硼可形成一系列硼的低卤化物,如,具有平面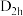 结构的
结构的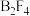 、类似乙硼烷结构的
、类似乙硼烷结构的 ,画出
,画出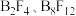 的结构简图
的结构简图_______ 、_______ 。
(7)在 溶液中加入
溶液中加入 ,然后再加入
,然后再加入 ,通过计算说明能否发生氧化还原反应
,通过计算说明能否发生氧化还原反应_______ 。(已知 ,
, ,
, ,设有关物质的浓度都为
,设有关物质的浓度都为 )。
)。
(1)德国人斯瓦恩哈德是从事玻璃加工的一名工人。1670年,他无意中将萤石与浓硫酸1∶1混合在一起,结果产生了一种具有刺激性气味的烟雾,他发现这种气体能腐蚀玻璃,从而研究出一种不用金刚石或其他磨料也可以在玻璃上刻蚀图案的方法。利用这种方法,斯瓦恩哈德制成了许多玻璃艺术品,成为有名的玻璃雕刻艺术家。写出上述化学反应方程式
(2)单质氟的制备是化学史上一段悲壮的历史,有多位化学家中毒,甚至付出生命,但是化学家们不畏艰难、前仆后继。终于,1886年法国化学家莫瓦桑在总结前人经验与教训的基础上,在低温下电解熔融的氟化氢钾制得单质氟,这距离氢氟酸的发现已经过去一百多年之久。写出电解制备单质氟的反应方程式
(3)又过了整整一百年,化学方法制取F2获得成功。其步骤如下:在
 存在下,用
存在下,用 氧化
氧化 ;
; 和HF反应;
和HF反应;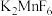 和
和 反应。写出各步的化学反应方程式
反应。写出各步的化学反应方程式(4)氟单质的反应性非常强,可与稀有气体氙发生反应。已知:
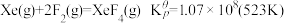 ,
,
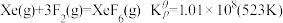 ,
,
XeF6的立方晶型中有四聚体单元,
 与其中5个F的键长为
与其中5个F的键长为 ,与第6个F的键长为
,与第6个F的键长为 。
。①在满足反应速率的前题下,应如何控制温度才有利于
 的生成
的生成②若在523K下以Xe和F2制取XeF6,并使产物中
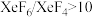 ,计算说明F2的平衡分压至少应保持在标准压力的
,计算说明F2的平衡分压至少应保持在标准压力的③指出XeF6气体的分子构型
④说明XeF6晶体中存在着什么样的离子
⑤按照电子理论,将
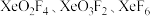 酸性从大到小的顺序排列
酸性从大到小的顺序排列(5)法国科学家盖·吕萨克也曾试图制备氢氟酸。1809年,他把氟化钙与硼酸混和加热,但是却意外地制成了一种所谓的“氟酸气”A。气体A可与
 发生反应,生成多卤阳离子B和一四面体阴离子C,写出离子反应方程式
发生反应,生成多卤阳离子B和一四面体阴离子C,写出离子反应方程式(6)氟与硼可形成一系列硼的低卤化物,如,具有平面
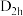 结构的
结构的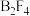 、类似乙硼烷结构的
、类似乙硼烷结构的 ,画出
,画出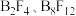 的结构简图
的结构简图(7)在
 溶液中加入
溶液中加入 ,然后再加入
,然后再加入 ,通过计算说明能否发生氧化还原反应
,通过计算说明能否发生氧化还原反应 ,
, ,
, ,设有关物质的浓度都为
,设有关物质的浓度都为 )。
)。
您最近一年使用:0次
5 . 某地出产的矿石A可看作由主要成分硅酸铜盐X·7H2O (摩尔质量=406 g·mol-1 )与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液I和II中滴入KSCN溶液,前者无现象,后者显血红色。所有数据均已折算为标准状况。
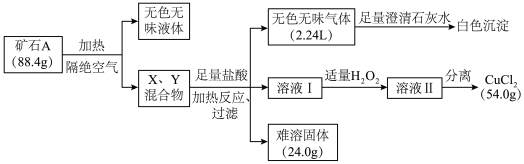
请回答:
(1)写出Y中除氧以外的元素符号_________ ,X的化学式为________ 。
(2)如果往溶液II中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所致,写出反应的离子方程式________ ; 加足量H2O2后对溶液II进行分离,可得到该元素的氧化物Z 4.0g,写出杂质Y与盐酸反应的化学方程式________ 。
(3)将Z与KNO3、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成KNO2和H2O。写出该反应的化学方程式________ 。
(4)通过完全电解上述流程所得的54.0 g CuCl2 (熔融状态)制备Cu,但还原产物也可能是Cu2O,试设计实验证明还原产物的组成__________ 。

请回答:
(1)写出Y中除氧以外的元素符号
(2)如果往溶液II中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所致,写出反应的离子方程式
(3)将Z与KNO3、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成KNO2和H2O。写出该反应的化学方程式
(4)通过完全电解上述流程所得的54.0 g CuCl2 (熔融状态)制备Cu,但还原产物也可能是Cu2O,试设计实验证明还原产物的组成
您最近一年使用:0次
6 . 请回答下列问题。
(1)金属铝的卤化物熔点如下表:
请画出其中不属于分子晶体的卤化铝的电子式_______ ,加热分解某种铵盐X,可以1:3的物质的量比获得该卤化铝与一种离子化合物Y,Y的阳离子与阴离子具有相同的核外电子数,写出X的化学式_______ 。
(2)广义氢键理论认为除了与N、O、F原子形成氢键外,H原子还可以与很多带部分负电荷的原子形成氢键,请用广义氢键理论解释氮硼烷(H3N-BH3) 的沸点比乙烷(H3C-CH3)高285°C的原因________ 。
(1)金属铝的卤化物熔点如下表:
| 化学式 | AlF3 | AlCl3 | AlBr3 | AlI3 |
| 熔点/°C | 1290 | 180 | 97.5 | 188 |
请画出其中不属于分子晶体的卤化铝的电子式
(2)广义氢键理论认为除了与N、O、F原子形成氢键外,H原子还可以与很多带部分负电荷的原子形成氢键,请用广义氢键理论解释氮硼烷(H3N-BH3) 的沸点比乙烷(H3C-CH3)高285°C的原因
您最近一年使用:0次
解题方法
7 . 我国承诺 2030年前做到“碳达峰和碳中和”,这里的碳主要指CO2, CO2与我们生活和生产息息相关。请回答:
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g) CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1
II. CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
副反应:
III. CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
IV. 2CH3OH(g) CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
请回答:
①△H3=________ kJ·mol-1。
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x= ,则理论上x=
,则理论上x=_______ 时,原料气的利用率最高。但生产中往往采用略高于该值的氢碳比,理由是___________ 。
(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g) CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
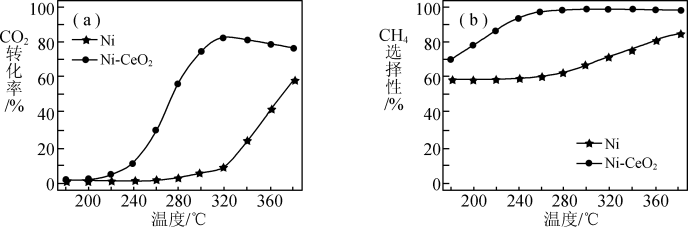
下列说法正确的是 。
(3)CO2可以与环氧丙烷反应合成碳酸丙烯酯:
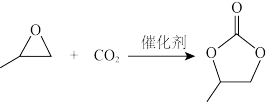 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1
通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):
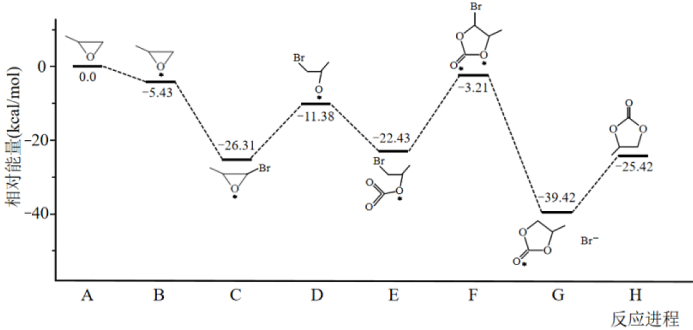
①决定总反应速率大小的步骤是______ (用图中字母表示), 该步骤的能垒(活化能)为_________ 。
②下列说法正确的是__________ 。
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
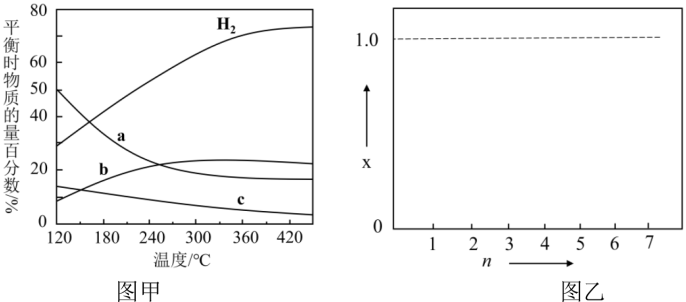
在120°C达到平衡时,CO2的转化率为________ ;若H2和CO2的物质的量之比为 n:1 (n≥3)进行投料,温度控制为120°C,相应平衡体系中CO2的转化率为x,在图乙中绘制x随n (n≥3 )变化的示意图________ (标出曲线的起点坐标)。
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g)
 CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1II. CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1副反应:
III. CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3IV. 2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1请回答:
①△H3=
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x=
 ,则理论上x=
,则理论上x=(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g)
 CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
下列说法正确的是 。
| A.高于320°C后,以Ni- CeO2为催化剂,CO2转化率略有下降的原因一定是CO2甲烷化反应已达平衡,升高温度平衡右移 |
| B.高于320°C后,以Ni为催化剂,CO2转化率上升的原因一定是CO2甲烷化反应速率较慢,升高温度反应速率加快,反应相同时间时CO2转化率增加 |
| C.工业上应选择的催化剂是Ni- CeO2 |
| D.工业上应使用的合适温度为360°C |
 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):

①决定总反应速率大小的步骤是
②下列说法正确的是
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
在120°C达到平衡时,CO2的转化率为
您最近一年使用:0次
解题方法
8 . 工业上可用粗硅(含有铁、铝、硼、磷等杂质)与干燥的HCl气体反应制SiHCl3:Si+3HCl = SiHCl3+H2,SiHCl3可与过量H2在1000~1100°C反应制得纯硅。有关物质的物理常数见下表:
请回答:
(1)粗硅与HCl反应完全后的混合物冷却到标准状况,可通过________ 操作提纯得到SiHCl3。
(2)实验室也可以采用如右图装置(加热、夹持及尾气处理装置均略去)用SiHCl3与过量干燥H2反应制取纯硅。
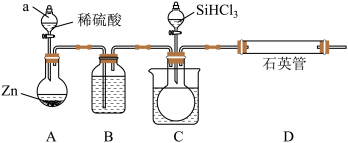
①仪器a的名称为_______ , 装置 B中的试剂为________ 。
②装置C为水浴加热,目的是________ , 反应一段时间后,D中可以观察到晶体硅生成,同时生成一种气体产物,写出其化学式_______ 。
③为保证实验安全,加热D装置前必须完成的操作是_________ 。
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | SiHCl3 | PCl5 |
| 沸点/°C | 57.7 | 12.8 | —— | 315 | 33.0 | —— |
| 熔点/°C | -70.0 | -107.2 | —— | —— | -126.5 | —— |
| 升华温度/°C | —— | —— | 180 | 300 | —— | 162 |
(1)粗硅与HCl反应完全后的混合物冷却到标准状况,可通过
(2)实验室也可以采用如右图装置(加热、夹持及尾气处理装置均略去)用SiHCl3与过量干燥H2反应制取纯硅。

①仪器a的名称为
②装置C为水浴加热,目的是
③为保证实验安全,加热D装置前必须完成的操作是
您最近一年使用:0次
9 . 将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是___ 。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是___ 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d..升高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)___ 。
 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d..升高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)
您最近一年使用:0次
解题方法
10 . 镉可用于制作某些发光电子组件。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO 杂质)为原料制备镉的工艺流程如图:

(1)写出“滤渣1”的主要成分_____ 。
(2)写出“氧化”步骤中除铁、除锰的离子方程式_______ 。
(3)“置换”中镉置换率与 的关系如图所示,其中锌的理论用量以溶液中Cd2+的量为依据。
的关系如图所示,其中锌的理论用量以溶液中Cd2+的量为依据。

①实际生产中 比值最佳为1.3,请说明不宜超过该比值的原因
比值最佳为1.3,请说明不宜超过该比值的原因_____ 。
②若需置换出112 kg镉,且使镉置换率达到98%,实际加入的锌应为多少_____
③用化学式表示“置换”后滤液溶质的主要成分_____ 。
(4)“熔炼”时,将海绵镉(含镉和锌)与NaOH混合反应,写出反应的化学方程式_____

(1)写出“滤渣1”的主要成分
(2)写出“氧化”步骤中除铁、除锰的离子方程式
(3)“置换”中镉置换率与
 的关系如图所示,其中锌的理论用量以溶液中Cd2+的量为依据。
的关系如图所示,其中锌的理论用量以溶液中Cd2+的量为依据。
①实际生产中
 比值最佳为1.3,请说明不宜超过该比值的原因
比值最佳为1.3,请说明不宜超过该比值的原因②若需置换出112 kg镉,且使镉置换率达到98%,实际加入的锌应为多少
③用化学式表示“置换”后滤液溶质的主要成分
(4)“熔炼”时,将海绵镉(含镉和锌)与NaOH混合反应,写出反应的化学方程式
您最近一年使用:0次



