解题方法
1 . 实验室现有质量分数为36.5%、密度为1.19g·cm-3的浓盐酸,回答下列问题:
(1)浓盐酸的物质的量浓度为___________ mol·L-1。
(2)某化学兴趣小组进行盐酸性质的实验探究时,需要100mL 1mol·L-1稀盐酸,则需用量筒量取___________ mL的浓盐酸,量取浓盐酸所用的量筒的规格为___________ (填标号)。
A.10mL B.25mL C.50mL D.100mL
(3)整个实验中用到的玻璃仪器除烧杯、玻璃棒、量筒外还有___________ 。
(4)下列情况对所配制的稀盐酸浓度有何影响。
①所用的浓盐酸长时间放置在密封不好的容器中:___________ (填“偏大”“偏小”或“无影响”,下同)。
②将溶液注入未经干燥的容量瓶中。___________
③转移溶液时用过的烧杯、玻璃棒未洗涤:___________ 。
④定容时俯视刻度线:___________ 。
⑤量取浓盐酸时仰视刻度线:___________
(1)浓盐酸的物质的量浓度为
(2)某化学兴趣小组进行盐酸性质的实验探究时,需要100mL 1mol·L-1稀盐酸,则需用量筒量取
A.10mL B.25mL C.50mL D.100mL
(3)整个实验中用到的玻璃仪器除烧杯、玻璃棒、量筒外还有
(4)下列情况对所配制的稀盐酸浓度有何影响。
①所用的浓盐酸长时间放置在密封不好的容器中:
②将溶液注入未经干燥的容量瓶中。
③转移溶液时用过的烧杯、玻璃棒未洗涤:
④定容时俯视刻度线:
⑤量取浓盐酸时仰视刻度线:
您最近一年使用:0次
2 . 已知:①A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2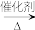 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
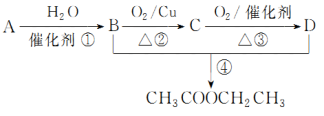
回答下列问题:
(1)写出A的结构简式___________ 。
(2)B、D分子中的官能团名称分别是___________ 、___________ 。
(3)写出下列反应的反应类型:①___________ ,②___________ ,④___________ 。
(4)写出下列反应的化学方程式:②___________ ;④___________ 。
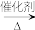 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的结构简式
(2)B、D分子中的官能团名称分别是
(3)写出下列反应的反应类型:①
(4)写出下列反应的化学方程式:②
您最近一年使用:0次
解题方法
3 . 碳氧化物一直以来都是工业发展的重要组成物质,根据下列信息填空:
(1)CO2的重整用CO2和H2为原料可得到CH4燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1
②CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH2=+205 kJ·mol-1
则CO2重整的热化学方程式为___________ 。
(2)利用反应CO(g)+H2O(g) H2(g)+CO2(g)可得到清洁能源H2。
H2(g)+CO2(g)可得到清洁能源H2。
①该反应化学平衡常数表达式K=___________ 。
②该反应的平衡常数随温度的变化如表:
从上表可以推断:此反应是___________ (填“吸热”或“放热”)反应。
③830℃时,向容积为2L的密闭容器中充入1molCO与1molH2O,2min时CO为0.6mol。2min内 (CO2)=
(CO2)=___________ ,此时反应进行的方向是___________ ,依据是___________ ,可以判断该反应达到平衡的标志是___________ (填字母)。
a.体系的压强不再发生变化 b.混合气体的密度不变
c.CO的消耗速率与CO2的消耗速率相等 d.各组分的物质的量浓度不再改变
(1)CO2的重整用CO2和H2为原料可得到CH4燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1
②CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH2=+205 kJ·mol-1
则CO2重整的热化学方程式为
(2)利用反应CO(g)+H2O(g)
 H2(g)+CO2(g)可得到清洁能源H2。
H2(g)+CO2(g)可得到清洁能源H2。①该反应化学平衡常数表达式K=
②该反应的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
③830℃时,向容积为2L的密闭容器中充入1molCO与1molH2O,2min时CO为0.6mol。2min内
 (CO2)=
(CO2)=a.体系的压强不再发生变化 b.混合气体的密度不变
c.CO的消耗速率与CO2的消耗速率相等 d.各组分的物质的量浓度不再改变
您最近一年使用:0次
解题方法
4 . 在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
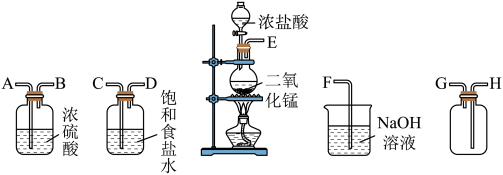
(1)上述仪器的正确连接顺序为(填各接口处的字母):___________ 。
(2)装置中,饱和食盐水的作用是___________ ;NaOH溶液的作用是___________ 。
(3)化学实验中常用湿润的淀粉碘化钾试纸检验是否有Cl2产生。如果有Cl2产生,可观察到___________ ,反应的化学方程式为___________ 。
(4)写出下列反应的化学方程式
①气体发生装置中进行反应的化学方程式:___________ ;
②NaOH溶液中发生反应的化学方程式:___________ 。
(5)实验室用10mL 12mol/L的浓盐酸和过量二氧化锰反应制取氯气,最终得到224mL的氯气(标准状况),计算该过程中氯气的产率(精确到0.01)___________ 。( )
)

(1)上述仪器的正确连接顺序为(填各接口处的字母):
(2)装置中,饱和食盐水的作用是
(3)化学实验中常用湿润的淀粉碘化钾试纸检验是否有Cl2产生。如果有Cl2产生,可观察到
(4)写出下列反应的化学方程式
①气体发生装置中进行反应的化学方程式:
②NaOH溶液中发生反应的化学方程式:
(5)实验室用10mL 12mol/L的浓盐酸和过量二氧化锰反应制取氯气,最终得到224mL的氯气(标准状况),计算该过程中氯气的产率(精确到0.01)
 )
)
您最近一年使用:0次
5 . Simmons-Smith反应
杜邦公司的HowardE.Simmons,Jr.和Ron.D.Smith发现烯烃与类卡宾发生反应可以生成环丙烷类化合物(Simmons-Smith反应)。常用的类卡宾试剂是有机锌化合物,通式为X(CR1R2)ZnY,可以通过1,1-二卤化物如二碘甲烷与锌铜偶(Zn(Cu))或者二乙基锌(Et2Zn)在醚类溶剂中反应制取。
(1)化合物A发生Simmons-Smith反应后高产率得到产物B,请写出化合物B在酸性条件下的水解产物C的结构式_____ 。

(2)写出烯醇硅醚化合物D发生Simmons-Smith反应生成的产物E的结构式,E在三氯化铁和醋酸钠的作用下,可以生成产物F,产物F是一个六元碳环,分子量为96。请写出E和F的结构式,用楔形式标注产物E中的立体化学_____ 、_____ 。

(3)化合物G在低温下与强碱LDA(二异丙基氨基锂)反应生成烯醇负离子,然后和氯甲酸甲酯反应高效获得产物H,H发生经由关键中间体I的Simmons-Smith反应得到产物J,J比H分子量大14,请分别写出产物H、J和关键中间体I(提示:含有9个碳原子)的结构式_____ 、_____ 、_____ 。

杜邦公司的HowardE.Simmons,Jr.和Ron.D.Smith发现烯烃与类卡宾发生反应可以生成环丙烷类化合物(Simmons-Smith反应)。常用的类卡宾试剂是有机锌化合物,通式为X(CR1R2)ZnY,可以通过1,1-二卤化物如二碘甲烷与锌铜偶(Zn(Cu))或者二乙基锌(Et2Zn)在醚类溶剂中反应制取。
(1)化合物A发生Simmons-Smith反应后高产率得到产物B,请写出化合物B在酸性条件下的水解产物C的结构式

(2)写出烯醇硅醚化合物D发生Simmons-Smith反应生成的产物E的结构式,E在三氯化铁和醋酸钠的作用下,可以生成产物F,产物F是一个六元碳环,分子量为96。请写出E和F的结构式,用楔形式标注产物E中的立体化学

(3)化合物G在低温下与强碱LDA(二异丙基氨基锂)反应生成烯醇负离子,然后和氯甲酸甲酯反应高效获得产物H,H发生经由关键中间体I的Simmons-Smith反应得到产物J,J比H分子量大14,请分别写出产物H、J和关键中间体I(提示:含有9个碳原子)的结构式

您最近一年使用:0次
6 . 点击化学及其应用
2001年诺贝尔化学奖获得者K.B.Sharpless教授发现,在亚铜的催化下,末端炔烃可以高区域选择性地与叠氮化合物发生高效的点击(Click)反应,类似炔烃与叠氮化合物发生了1,3-偶极环加成反应。这一反应目前已经应用于生物化学等交叉领域,Sharpless教授也因此获得了2022年度诺贝尔化学奖。
Click反应示例:
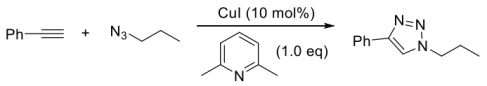
科学家以环己烯为原料,经过多步转化和click反应合成化合物E,请按要求回答下面的问题。在四氢呋喃溶剂中,环己烯与NBS(N-溴代丁二酰亚胺)反应生成关键中间体A,A与水发生反应生成化合物B化合物B经过碳酸钾处理可以高产率合成化合物C,化合物C也可以通过环己烯与间氯过氧苯甲酸反应直接制得;化合物C与叠氮化钠反应可以合成D,D与苯乙炔在碱的存在下及碘化亚铜的催化下发生Click反应生成E。
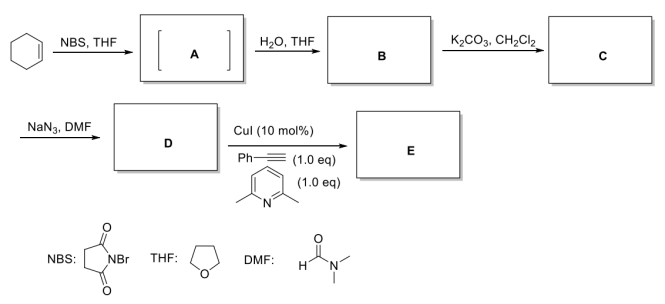
请给出关键中间体A,产物B、C、D、E的结构式,请用楔形式标注产物中的立体化学_____ 、_____ 、_____ 、_____ 、_____ 。
2001年诺贝尔化学奖获得者K.B.Sharpless教授发现,在亚铜的催化下,末端炔烃可以高区域选择性地与叠氮化合物发生高效的点击(Click)反应,类似炔烃与叠氮化合物发生了1,3-偶极环加成反应。这一反应目前已经应用于生物化学等交叉领域,Sharpless教授也因此获得了2022年度诺贝尔化学奖。
Click反应示例:

科学家以环己烯为原料,经过多步转化和click反应合成化合物E,请按要求回答下面的问题。在四氢呋喃溶剂中,环己烯与NBS(N-溴代丁二酰亚胺)反应生成关键中间体A,A与水发生反应生成化合物B化合物B经过碳酸钾处理可以高产率合成化合物C,化合物C也可以通过环己烯与间氯过氧苯甲酸反应直接制得;化合物C与叠氮化钠反应可以合成D,D与苯乙炔在碱的存在下及碘化亚铜的催化下发生Click反应生成E。

请给出关键中间体A,产物B、C、D、E的结构式,请用楔形式标注产物中的立体化学
您最近一年使用:0次
7 . 新型含钴催化剂
最近,JohnAnderson课题组合成了一种基于钻元素的均相催化氢化催化剂,它在催化氢化反应中表现出了不同寻常的反应性。请根据所学知识,回答下列问题。
这一催化剂X的合成方法如图所示:
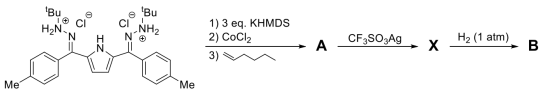
已知KHMDS结构式为 ,A中钻元素含量为11.02%,X中钻元素含量为9.09%,B的化学式与X仅相差两个原子。红外光谱显示,只有B中包含N-H键,而A与X中均不包含N-H键。单晶X射线衍射结果表明,A分子存在对称面与六元螯环,在A与X中,Co的配位数没有发生变化,均为4。
,A中钻元素含量为11.02%,X中钻元素含量为9.09%,B的化学式与X仅相差两个原子。红外光谱显示,只有B中包含N-H键,而A与X中均不包含N-H键。单晶X射线衍射结果表明,A分子存在对称面与六元螯环,在A与X中,Co的配位数没有发生变化,均为4。
(1)请推断A、B和X的结构_____ 、_____ 、_____ 。
(2)给出合成初始反应物所需的羰基化合物与氨基化合物(只考虑对应的中性反应原料即可,无需将其写成盐酸盐的形式)_____ 。
(3)已知B是催化氢化中的活性物种,在高于0℃的条件下不稳定,尚未分离得到晶体结构。实验发现,只有X才能与 反应生成B,而A则不反应。进一步的机理研究表明,X的一个配位位点上的配体发生解离对其反应活性有重要影响。据此,请分析为何A与X的反应活性不同
反应生成B,而A则不反应。进一步的机理研究表明,X的一个配位位点上的配体发生解离对其反应活性有重要影响。据此,请分析为何A与X的反应活性不同_____ 。
B与烯烃反应可以将其氢化。通常来说,过渡金属催化剂参与氢化时,按照氧化加成-氢迁移-还原消除的顺序进行,这些反应有些包含氧化还原反应,有些则是按协同反应机理进行。在这一过程中金属原子的氧化态先升高后下降,且反应通常有良好的立体选择性。然而,在B参与的氢化反应中,使用2-甲基-1,3-戊二烯不仅同时得到了顺式和反式4-甲基-2-戊烯,还得到了2-甲基-2-戊烯。电子顺磁共振表明,在反应中金属原子的氧化态没有发生变化。
(4)根据以上信息,请判断这一催化剂进行氢化反应的机理对底物来说属于哪种类型_____ (正离子,负离子,自由基,协同反应),并解释之_____ 。
(5)请给出第一步反应中使用1-己烯的目的_____ 。
最近,JohnAnderson课题组合成了一种基于钻元素的均相催化氢化催化剂,它在催化氢化反应中表现出了不同寻常的反应性。请根据所学知识,回答下列问题。
这一催化剂X的合成方法如图所示:

已知KHMDS结构式为
 ,A中钻元素含量为11.02%,X中钻元素含量为9.09%,B的化学式与X仅相差两个原子。红外光谱显示,只有B中包含N-H键,而A与X中均不包含N-H键。单晶X射线衍射结果表明,A分子存在对称面与六元螯环,在A与X中,Co的配位数没有发生变化,均为4。
,A中钻元素含量为11.02%,X中钻元素含量为9.09%,B的化学式与X仅相差两个原子。红外光谱显示,只有B中包含N-H键,而A与X中均不包含N-H键。单晶X射线衍射结果表明,A分子存在对称面与六元螯环,在A与X中,Co的配位数没有发生变化,均为4。(1)请推断A、B和X的结构
(2)给出合成初始反应物所需的羰基化合物与氨基化合物(只考虑对应的中性反应原料即可,无需将其写成盐酸盐的形式)
(3)已知B是催化氢化中的活性物种,在高于0℃的条件下不稳定,尚未分离得到晶体结构。实验发现,只有X才能与
 反应生成B,而A则不反应。进一步的机理研究表明,X的一个配位位点上的配体发生解离对其反应活性有重要影响。据此,请分析为何A与X的反应活性不同
反应生成B,而A则不反应。进一步的机理研究表明,X的一个配位位点上的配体发生解离对其反应活性有重要影响。据此,请分析为何A与X的反应活性不同B与烯烃反应可以将其氢化。通常来说,过渡金属催化剂参与氢化时,按照氧化加成-氢迁移-还原消除的顺序进行,这些反应有些包含氧化还原反应,有些则是按协同反应机理进行。在这一过程中金属原子的氧化态先升高后下降,且反应通常有良好的立体选择性。然而,在B参与的氢化反应中,使用2-甲基-1,3-戊二烯不仅同时得到了顺式和反式4-甲基-2-戊烯,还得到了2-甲基-2-戊烯。电子顺磁共振表明,在反应中金属原子的氧化态没有发生变化。
(4)根据以上信息,请判断这一催化剂进行氢化反应的机理对底物来说属于哪种类型
(5)请给出第一步反应中使用1-己烯的目的
您最近一年使用:0次
8 . S2F10的分子结构问题
分子构型对其性质有着显著的影响。对无机物来说,其结构通常可以通过红外光谱拟合或气态电子衍射得到。请根据所学知识,回答下列问题。
(1)为了拟合红外光谱,需要先拟定分子的可能构型。运用VSEPR理论,请给出SF 离子可能的构型
离子可能的构型_____ 。与理想多面体相比,你预计SF 离子的实际结构将会发生怎样的变形?请解释理由
离子的实际结构将会发生怎样的变形?请解释理由_____ 。
(2)电子衍射结果表明,S2F10中存在S-S键。请画出其最稳定的结构_____ 。
(3)已知S2F10中,赤道面上的S-F键长为157.4pm,S-S键长为227.4pm,请根据你在上一问中所画的结构,计算不同S原子上F原子之间的最短间距_____ ,并与F原子的范德华半径147pm比较。通常情况下,F原子的范德华半径与共价半径谁更大_____ ?
(4)请写出S2F10分子所具有的对称元素(仅考虑旋转轴、对称面与对称中心)_____ 。
(5)将S2F10与N2F4混合后,可以制得一种具有单根S-N键的化合物,与许多高价氟化物不同,它对水是稳定的。请画出这种化合物的结构,并解释其对水的稳定性_____ 。
分子构型对其性质有着显著的影响。对无机物来说,其结构通常可以通过红外光谱拟合或气态电子衍射得到。请根据所学知识,回答下列问题。
(1)为了拟合红外光谱,需要先拟定分子的可能构型。运用VSEPR理论,请给出SF
 离子可能的构型
离子可能的构型 离子的实际结构将会发生怎样的变形?请解释理由
离子的实际结构将会发生怎样的变形?请解释理由(2)电子衍射结果表明,S2F10中存在S-S键。请画出其最稳定的结构
(3)已知S2F10中,赤道面上的S-F键长为157.4pm,S-S键长为227.4pm,请根据你在上一问中所画的结构,计算不同S原子上F原子之间的最短间距
(4)请写出S2F10分子所具有的对称元素(仅考虑旋转轴、对称面与对称中心)
(5)将S2F10与N2F4混合后,可以制得一种具有单根S-N键的化合物,与许多高价氟化物不同,它对水是稳定的。请画出这种化合物的结构,并解释其对水的稳定性
您最近一年使用:0次
9 . 硫酸制备工艺
对于V2O5催化剂存在下的反应:2SO2(g)+O2(g) 2SO3(g),当SO2与空气(O2与N2的体积分数分别为0.210与0.790)投料比为1∶5,总压保持100kPa下,分别在673K和873K下达到平衡,测得SO2的平衡转化率分别为99.3%和74.5%。
2SO3(g),当SO2与空气(O2与N2的体积分数分别为0.210与0.790)投料比为1∶5,总压保持100kPa下,分别在673K和873K下达到平衡,测得SO2的平衡转化率分别为99.3%和74.5%。
(1)计算两个温度下的标准平衡常数Kθ_____ 。
(2)请说明该反应的实际温度控制在673K左右的原因_____ 。
(3)保持其他条件不变,只把总压增大为原来的5倍,温度为673K下达到平衡。求这时SO2的平衡转化率_____ 。
(4)根据计算结果说明实际工艺中如何控制压力条件_____ ?
对于V2O5催化剂存在下的反应:2SO2(g)+O2(g)
 2SO3(g),当SO2与空气(O2与N2的体积分数分别为0.210与0.790)投料比为1∶5,总压保持100kPa下,分别在673K和873K下达到平衡,测得SO2的平衡转化率分别为99.3%和74.5%。
2SO3(g),当SO2与空气(O2与N2的体积分数分别为0.210与0.790)投料比为1∶5,总压保持100kPa下,分别在673K和873K下达到平衡,测得SO2的平衡转化率分别为99.3%和74.5%。(1)计算两个温度下的标准平衡常数Kθ
(2)请说明该反应的实际温度控制在673K左右的原因
(3)保持其他条件不变,只把总压增大为原来的5倍,温度为673K下达到平衡。求这时SO2的平衡转化率
(4)根据计算结果说明实际工艺中如何控制压力条件
您最近一年使用:0次
10 . 完成下列问题
(1)请画出反应产物的结构简式并标出产物中不对称碳原子的构型。_________
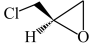

(2)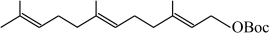

(BDSB:[Et2SBr][SbC15Br])
①请画出以上反应产物的最稳定构象:_________
②请预测将反应溶剂从硝基甲烷换成甲苯时,反应产率的变化(升高或降低)。_________
③请分别画出以下卡宾与 反应的产物的结构简式:
反应的产物的结构简式:
a.
_________
b.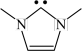
_________
(3)请分别画出A和B的结构简式:A_________ ,B_________
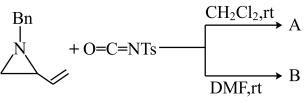
(4)环丁二烯与溴反应生成(1Z,3Z,5Z,7R,8R)-7,8-二溴环辛-1,3,5-三烯及其对映体。请画出反应的关键中间体(3个)。_________
(1)请画出反应产物的结构简式并标出产物中不对称碳原子的构型。
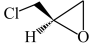

(2)


(BDSB:[Et2SBr][SbC15Br])
①请画出以上反应产物的最稳定构象:
②请预测将反应溶剂从硝基甲烷换成甲苯时,反应产率的变化(升高或降低)。
③请分别画出以下卡宾与
 反应的产物的结构简式:
反应的产物的结构简式:a.

b.
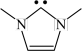
(3)请分别画出A和B的结构简式:A

(4)环丁二烯与溴反应生成(1Z,3Z,5Z,7R,8R)-7,8-二溴环辛-1,3,5-三烯及其对映体。请画出反应的关键中间体(3个)。
您最近一年使用:0次



