1 . I.已知A、B、C、D、E、F、G、H8种短周期元素的原子半径和某些化合价如下表所示:
元素 | A | B | C | D | E | F | G | H |
化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 | +7、-1 | +4、-4 |
原子半径/nm | 0.073 | 0.075 | 0.077 | 0.102 | 0.130 | 0.154 | 0.099 | 0.111 |
(1)元素D在元素周期表中的位置为
 与元素
与元素 所形成的晶体属于
所形成的晶体属于(2)如图中阴影部分所示区域的元素称为

A.Ba B.Fe C.Br D.Rb
Ⅱ.现有A、B、C、D、E、F、G、H元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A | 核外电子数和电子层数相等 |
B | 形成化合物种类最多的元素 |
C | 基态原子的核外p能级电子数比s能级电子数少1 |
D | 基态原子的核外p轨道中有两个未成对电子 |
E | 气态基态原子的第一至第四电离能分别是I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol |
F | 主族序数与周期数的差为4 |
G | 前四周期中电负性最小的元素 |
H | 位于元素周期表中的第11列 |
(4)某同学推断E元素基态原子的核外电子轨道表示式如图。该同学所画的电子轨道表示式违背了
 远远大于
远远大于 ,其原因是
,其原因是
(5)D、E、F三种元素的简单离子半径由大到小的顺序是
(6)H位于元素周期表中
 位于同一周期,其原子基态时未成对电子数在同周期中最多的元素是
位于同一周期,其原子基态时未成对电子数在同周期中最多的元素是(7)写出一种由A、B、C、D四种元素组成离子化合物
您最近一年使用:0次
2 . 回答下列问题:
(1)基态碳原子的核外电子排布式为___________ 。非金属元素N的第一电离能大于O的第一电离能,原因是___________ 。
(2)下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
下列说法正确的是___________(填序号)。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子排布式:___________ ,比较两元素的I2、I3可知,气态Mn2+和气态Fe2+相比,___________ 更难再失去1个电子。
(4)卤族元素F、Cl、Br、I的电负性由小到大的顺序是___________ 。
(5)基态B原子的价电子轨道表示式为___________ ;B和N相比,电负性较大的是___________ ;BN中B元素的化合价为___________ 。
(1)基态碳原子的核外电子排布式为
(2)下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A.甲的金属性比乙强 | B.乙有+1价 |
| C.丙不可能为非金属元素 | D.丁一定为金属元素 |
| 元素 | Mn | Fe | |
| 电离能/(kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)卤族元素F、Cl、Br、I的电负性由小到大的顺序是
(5)基态B原子的价电子轨道表示式为
您最近一年使用:0次
3 . 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸(
的沸点低于异硫氰酸(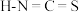 ),其原因是
),其原因是___________ 。
(2) 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为___________ ; 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为___________ 。
(3)卤素互化物如 等与卤素单质结构和性质相似。
等与卤素单质结构和性质相似。 沸点由高到低的顺序为
沸点由高到低的顺序为___________ 。
(4)请推测① 、②
、②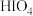 、③
、③ 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为___________ (填序号)。
(5) 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如图所示),
晶体的相似(如图所示), 晶体中的哑铃形
晶体中的哑铃形 的存在,使晶胞沿一个方向拉长。此晶体中1个
的存在,使晶胞沿一个方向拉长。此晶体中1个 周围距离最近的
周围距离最近的 为
为___________ 个;若该晶胞的边长为 ,则该晶体的密度为
,则该晶体的密度为___________  (写出表达式)。
(写出表达式)。

(1)拟卤素
 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸(
的沸点低于异硫氰酸(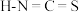 ),其原因是
),其原因是(2)
 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为(3)卤素互化物如
 等与卤素单质结构和性质相似。
等与卤素单质结构和性质相似。 沸点由高到低的顺序为
沸点由高到低的顺序为(4)请推测①
 、②
、②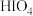 、③
、③ 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为(5)
 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如图所示),
晶体的相似(如图所示), 晶体中的哑铃形
晶体中的哑铃形 的存在,使晶胞沿一个方向拉长。此晶体中1个
的存在,使晶胞沿一个方向拉长。此晶体中1个 周围距离最近的
周围距离最近的 为
为 ,则该晶体的密度为
,则该晶体的密度为 (写出表达式)。
(写出表达式)。
您最近一年使用:0次
4 . 氧化钴(Co2O3)在工业、电子、电讯等领域都有着广阔的应用前景。以铜钴矿石(主要成分为 和SiO2,还有Fe、Mg、Ca的氧化物)为原料制备氧化钴(Co2O3)的工艺流程如图所示:
和SiO2,还有Fe、Mg、Ca的氧化物)为原料制备氧化钴(Co2O3)的工艺流程如图所示:
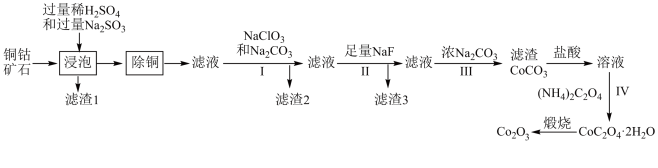
已知:常温下 ;Fe3+完全沉淀的pH约为3.2。
;Fe3+完全沉淀的pH约为3.2。
请回答下列问题:
(1)“浸泡”过程中,所得滤渣1中的物质是___________ ,写出此过程中CoO(OH)与Na2SO3反应的离子方程式___________ 。
(2)“除铜”过程中需加入FeS固体,写出该过程发生反应的离子方程式___________ 。
(3)除铜后加入NaClO3将Fe2+氧化为Fe3+,产物中氯元素处于最低化合价,该反应的离子方程式为___________ 。
(4)过程Ⅰ加入Na2CO3溶液调节pH至4.0左右,其目的为___________ 。
(5)已知某温度下 。该温度下,步骤Ⅱ中加入足量的NaF溶液可将Ca2+、Mg2+沉淀除去,若所得滤液中c(Mg2+)=1.0×10-5mol·L-1,则滤液中c(Ca2+)为
。该温度下,步骤Ⅱ中加入足量的NaF溶液可将Ca2+、Mg2+沉淀除去,若所得滤液中c(Mg2+)=1.0×10-5mol·L-1,则滤液中c(Ca2+)为___________ 。
 和SiO2,还有Fe、Mg、Ca的氧化物)为原料制备氧化钴(Co2O3)的工艺流程如图所示:
和SiO2,还有Fe、Mg、Ca的氧化物)为原料制备氧化钴(Co2O3)的工艺流程如图所示:
已知:常温下
 ;Fe3+完全沉淀的pH约为3.2。
;Fe3+完全沉淀的pH约为3.2。请回答下列问题:
(1)“浸泡”过程中,所得滤渣1中的物质是
(2)“除铜”过程中需加入FeS固体,写出该过程发生反应的离子方程式
(3)除铜后加入NaClO3将Fe2+氧化为Fe3+,产物中氯元素处于最低化合价,该反应的离子方程式为
(4)过程Ⅰ加入Na2CO3溶液调节pH至4.0左右,其目的为
(5)已知某温度下
 。该温度下,步骤Ⅱ中加入足量的NaF溶液可将Ca2+、Mg2+沉淀除去,若所得滤液中c(Mg2+)=1.0×10-5mol·L-1,则滤液中c(Ca2+)为
。该温度下,步骤Ⅱ中加入足量的NaF溶液可将Ca2+、Mg2+沉淀除去,若所得滤液中c(Mg2+)=1.0×10-5mol·L-1,则滤液中c(Ca2+)为
您最近一年使用:0次
5 . 钠、氯及其化合物有如图转化关系,请按要求填空:

(1)一小块金属钠投入水中其反应的化学方程式是_________ 。
(2)将灼热的细铁丝放入盛有氯气的集气瓶中,观察到_________ 现象,其反应的化学方程式为_________ 。
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为_________ 。
(4)工业上用氯气和石灰乳反应制漂白粉,其反应的化学方程式为_________ 。漂白粉的有效成分是_________ 。

(1)一小块金属钠投入水中其反应的化学方程式是
(2)将灼热的细铁丝放入盛有氯气的集气瓶中,观察到
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为
(4)工业上用氯气和石灰乳反应制漂白粉,其反应的化学方程式为
您最近一年使用:0次
解题方法
6 . 钠及其化合物在生产、生活中有着重要的用途。如图所示实验装置用于验证Na2O2的某些性质,如证明过氧化钠可作供氧剂。

(1)A是实验室制取CO2的装置,写出A中发生反应的离子方程式:_________ 。
(2)填写表中空格:
(3)写出过氧化钠与二氧化碳反应的化学方程式:_________ 。
(4)检验E中收集到的气体方法是_________ 。

(1)A是实验室制取CO2的装置,写出A中发生反应的离子方程式:
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | 与CO2和水反应 | |
| D | NaOH溶液 |
(3)写出过氧化钠与二氧化碳反应的化学方程式:
(4)检验E中收集到的气体方法是
您最近一年使用:0次
名校
解题方法
7 . 实验室用CuSO4固体配制250mL0.25mol/LCuSO4溶液。
(1)用到的仪器有:电子天平、药匙、量筒、烧杯、胶头滴管、玻璃棒和___________ 。
(2)请将以下配置溶液的操作步骤补充完整。
a.计算:计算需要CuSO4固体___________ g。
b.称量:根据计算结果,称量CuSO4固体。
c.溶解:将固体放入烧杯中完全溶解。
d.转移、洗涤:冷却至室温后,将烧杯中的溶液沿___________ 注入容量瓶中,并洗涤烧杯和玻璃棒,将洗涤液也都注入容量瓶。
e.定容、摇匀:将蒸馏水注入容量瓶,当液面离刻度线1-2cm时改用___________ 滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
f.贴标签:将配置好的溶液倒入试剂瓶中,贴好标签。
(3)下列操作中,会造成所配制溶液的物质的量浓度偏小的是___________ (填字母)。
a.定容时,俯视刻度线 b.配置过程中忘记洗涤烧杯和玻璃棒
c.转移时有少量溶液洒出 d.配制溶液时未冷却
(4)若用胆矾晶体配制该CuSO4溶液过程中实验操作无任何差错,但配制的浓度总是大于0.25mol/L,分析其原因可能是___________ 。
(1)用到的仪器有:电子天平、药匙、量筒、烧杯、胶头滴管、玻璃棒和
(2)请将以下配置溶液的操作步骤补充完整。
a.计算:计算需要CuSO4固体
b.称量:根据计算结果,称量CuSO4固体。
c.溶解:将固体放入烧杯中完全溶解。
d.转移、洗涤:冷却至室温后,将烧杯中的溶液沿
e.定容、摇匀:将蒸馏水注入容量瓶,当液面离刻度线1-2cm时改用
f.贴标签:将配置好的溶液倒入试剂瓶中,贴好标签。
(3)下列操作中,会造成所配制溶液的物质的量浓度偏小的是
a.定容时,俯视刻度线 b.配置过程中忘记洗涤烧杯和玻璃棒
c.转移时有少量溶液洒出 d.配制溶液时未冷却
(4)若用胆矾晶体配制该CuSO4溶液过程中实验操作无任何差错,但配制的浓度总是大于0.25mol/L,分析其原因可能是
您最近一年使用:0次
解题方法
8 . 利用石油化工产品CH2=CHCH3合成高分子化合物D的流程如图。请回答下列问题:
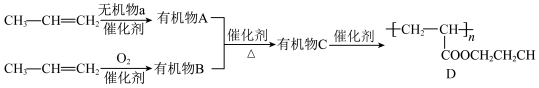
(1)CH2=CHCH3的名称为________ 。
(2)A、B的结构简式分别为________ 、________ 。
(3)C中官能团的名称为________ 。
(4)A+B→C的反应类型为________ 。
(5)C→D的化学方程式为________ 。
(6)有机物E与C互为同分异构体,则E中含有两个甲基、碳碳双键和羧基的结构有________ 种。

(1)CH2=CHCH3的名称为
(2)A、B的结构简式分别为
(3)C中官能团的名称为
(4)A+B→C的反应类型为
(5)C→D的化学方程式为
(6)有机物E与C互为同分异构体,则E中含有两个甲基、碳碳双键和羧基的结构有
您最近一年使用:0次
9 . 氨是重要的化工产品。氮肥工业,有机合成工业及制造硝酸、铵盐和纯碱都离不开氨。某同学在实验室中利用如图所示的装置制备氨气,并对NH3和Cl2的反应进行探究。回答下列问题:
(1)氨气的制备

①装置A能产生NH3的原因为___________ 。
②欲收集干燥的氨气,装置C中盛放的物质为___________ (填标号)。
a.氯化钙 b.碱石灰 c.五氧化二磷
③选择上图中的装置,按气流方向,用小写字母表示出其连接顺序: a→ ___→ ___→__→____→____→____。_________ 。
(2)NH3和Cl2反应的探究(如图,已知氨气的扩散速率比氯气快,试管和导管的强度足够大)

①步骤1:打开K1、关闭K2,现象为__________________ ,反应的化学方程式为___________ 。
②步骤2:打开K2,产生的现象为________ ,原因为___________ 。
(1)氨气的制备

①装置A能产生NH3的原因为
②欲收集干燥的氨气,装置C中盛放的物质为
a.氯化钙 b.碱石灰 c.五氧化二磷
③选择上图中的装置,按气流方向,用小写字母表示出其连接顺序: a→ ___→ ___→__→____→____→____。
(2)NH3和Cl2反应的探究(如图,已知氨气的扩散速率比氯气快,试管和导管的强度足够大)

①步骤1:打开K1、关闭K2,现象为
②步骤2:打开K2,产生的现象为
您最近一年使用:0次
名校
解题方法
10 . 制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。
(1)方案一:用下图所示方法和步骤进行实验:

①操作I、II涉及的实验名称依次是___________ 、洗涤、干燥、称量。
②该方案中涉及有关反应的离子方程式为___________ 。
(2)方案二:利用下图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

a.按图连接装置,并检查气密性;
b.准确称得盛有碱石灰的装置D的质量为86.2g;
c.准确称得5.9g纯碱样品放入容器II中;
d.打开分液漏斗I的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
e.打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得装置D的总质量为88.4g。
①装置D的名称是___________ 。
②若d、e两步的实验操作太快,则会导致测定结果___________ (填“偏大”或“偏小”)。
③装置E的作用是___________ 。
④根据实验中测得的有关数据,计算纯碱样品中Na2CO3的质量分数为___________ %(结果保留到小数点后一位)。
(1)方案一:用下图所示方法和步骤进行实验:

①操作I、II涉及的实验名称依次是
②该方案中涉及有关反应的离子方程式为
(2)方案二:利用下图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

a.按图连接装置,并检查气密性;
b.准确称得盛有碱石灰的装置D的质量为86.2g;
c.准确称得5.9g纯碱样品放入容器II中;
d.打开分液漏斗I的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
e.打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得装置D的总质量为88.4g。
①装置D的名称是
②若d、e两步的实验操作太快,则会导致测定结果
③装置E的作用是
④根据实验中测得的有关数据,计算纯碱样品中Na2CO3的质量分数为
您最近一年使用:0次
2023-09-16更新
|
105次组卷
|
2卷引用:湖北省十堰市郧阳中学2022-2023学年高一上学期10月月考化学试题



