名校
解题方法
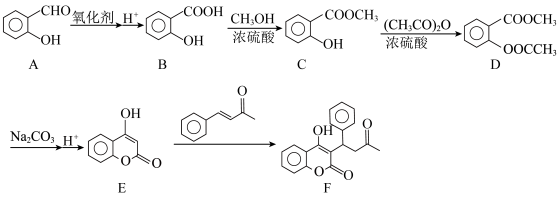
1 . 血栓栓塞类疾病漏诊、误诊、致残率高,是危害患者健康的重要疾病之一、华法林(物质F)可用于预防血栓栓塞类疾病,某种合成华法林的路线如图所示,请回答相关问题:________ ,物质E中的含氧官能团名称是________ 。
(2)A→B的氧化剂可以是________ (填序号)。
a.银氨溶液 b.氧气 c.新制 悬浊液 d.酸性
悬浊液 d.酸性 溶液
溶液
(3)C→D的化学方程式为________ 。
(4)E→F反应类型为________ 。
(5)物质C的同分异构体中符合下列条件的有________ 种。
①苯环上有三个取代基
②能够与 溶液反应显紫色
溶液反应显紫色
③能与碳酸氢钠溶液反应放出无色气体
(6)阿司匹林因被称为“销量最好的止痛药”被列入吉尼斯世界记录,其结构示意图为:_____ (所用试剂均从上述流程中选取)。
(2)A→B的氧化剂可以是
a.银氨溶液 b.氧气 c.新制
 悬浊液 d.酸性
悬浊液 d.酸性 溶液
溶液(3)C→D的化学方程式为
(4)E→F反应类型为
(5)物质C的同分异构体中符合下列条件的有
①苯环上有三个取代基
②能够与
 溶液反应显紫色
溶液反应显紫色③能与碳酸氢钠溶液反应放出无色气体
(6)阿司匹林因被称为“销量最好的止痛药”被列入吉尼斯世界记录,其结构示意图为:

您最近一年使用:0次
解题方法
2 . 浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图所示的实验。请据此回答下列问题。___________ 。
(2)浓硫酸和木炭粉发生的反应化学方程式___________ 。
(3)装置A中出现___________ 现象,证明气体产物中有 。
。
(4)为验证产物中是否含有 ,该同学思考如下:
,该同学思考如下:
①装置可证明产物中有 生成,现象是
生成,现象是___________ 。
②该同学认为,如果去掉装置B也能实现产物 的验证,该同学依据的实验现象是
的验证,该同学依据的实验现象是___________ 。
③在不影响实验检验结果的情况下,理论上以下试剂中可以用来代替装置B中的品红溶液的有___________ (填序号)。
a. 溶液 b.饱和
溶液 b.饱和 溶液 c.氯水 d.
溶液 c.氯水 d. 溶液
溶液
(5)D装置的作用是___________ 。

(2)浓硫酸和木炭粉发生的反应化学方程式
(3)装置A中出现
 。
。(4)为验证产物中是否含有
 ,该同学思考如下:
,该同学思考如下:①装置可证明产物中有
 生成,现象是
生成,现象是②该同学认为,如果去掉装置B也能实现产物
 的验证,该同学依据的实验现象是
的验证,该同学依据的实验现象是③在不影响实验检验结果的情况下,理论上以下试剂中可以用来代替装置B中的品红溶液的有
a.
 溶液 b.饱和
溶液 b.饱和 溶液 c.氯水 d.
溶液 c.氯水 d. 溶液
溶液(5)D装置的作用是
您最近一年使用:0次
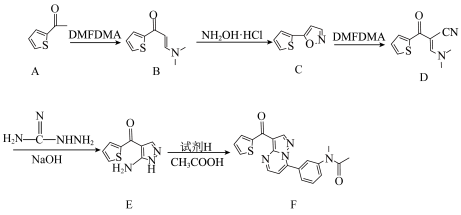
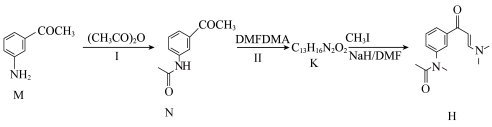
3 . 一种新型镇静催眠药茚地普隆(F)的合成路线如图,请回答下列问题: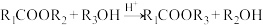 。
。
(1)A中含氧官能团的名称为___________ 。
(2)B的化学式为___________ 。
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成离域π键,如苯分子中的离域π键可表示为 ,则
,则 (噻吩)中的离域π键可表示为
(噻吩)中的离域π键可表示为___________ 。
(4)A有多种同分异构体,符合下列条件的A的同分异构体有___________ 种。
①与 溶液发生显色反应 ②含有―SH结构
溶液发生显色反应 ②含有―SH结构
(5)试剂H可通过如下流程制得。 的化学方程式:
的化学方程式:___________ ,该反应的反应类型为___________ 。
②写出K的结构简式:___________ ,K分子所含元素的第一电离能由大到小的顺序为___________ 。
已知:①DMFDMA的结构简式为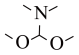 。
。
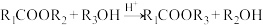 。
。(1)A中含氧官能团的名称为
(2)B的化学式为
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成离域π键,如苯分子中的离域π键可表示为
 ,则
,则 (噻吩)中的离域π键可表示为
(噻吩)中的离域π键可表示为(4)A有多种同分异构体,符合下列条件的A的同分异构体有
①与
 溶液发生显色反应 ②含有―SH结构
溶液发生显色反应 ②含有―SH结构(5)试剂H可通过如下流程制得。
 的化学方程式:
的化学方程式:②写出K的结构简式:
您最近一年使用:0次
2024-06-01更新
|
172次组卷
|
3卷引用:湖北省十堰市2023-2024学年高三下学期4月调研考试化学试题
名校
解题方法
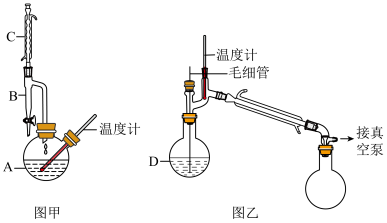
4 . 苯甲酸乙酯可用于配制香水及食用香精。某实验小组利用苯甲酸和乙醇制备苯甲酸乙酯,反应装置和相关数据如下,加热和夹持仪器未画出。
Ⅰ.合成苯甲酸乙酯粗产品:按图甲装置,在仪器A中加入2.44g苯甲酸、15mL乙醇、3.0mL浓硫酸和适量环己烷(环己烷与乙醇、水形成共沸物,沸点为62.1℃),控制一定温度,2h后停止加热。
(1)仪器C的名称是______ ,其作用是______ 。
(2)仪器A中生成苯甲酸乙酯的化学方程式为______ 。
Ⅱ.分离与提纯苯甲酸乙酯粗产品:
①将仪器A中的反应液倒入盛有适量水的烧杯中,分批加入饱和溶液至溶液呈中性。
②用分液漏斗分出步骤①中的有机层,用乙醚萃取水层中残留产品,然后合并有机层,并向其中加入无水 ,经“一定操作”后得到粗产品。
,经“一定操作”后得到粗产品。
③将粗产品转移至图乙的仪器D中进行减压蒸馏,收集211~213℃的馏分,制得产品2.25g。
(3)加入饱和 溶液的作用主要是①溶解乙醇,②中和
溶液的作用主要是①溶解乙醇,②中和______ (填物质名称),③降低苯甲酸乙酯的溶解度。
(4)加入无水 后的“一定操作”的名称是
后的“一定操作”的名称是______ 。
(5)乙中毛细管的作用是______ 。
(6)本实验的产率为______ 。
| 物质 | 乙醇 | 苯甲酸 | 乙醚 | 苯甲酸乙酯 |
密度(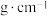 ) ) | 0.7893 | 1.2659 | 0.7318 | 1.0500 |
| 沸点/℃ | 78.5 | 249 | 34.5 | 212.0 |
| 相对分子质量 | 46 | 122 | 74 | 150 |
(1)仪器C的名称是
(2)仪器A中生成苯甲酸乙酯的化学方程式为
Ⅱ.分离与提纯苯甲酸乙酯粗产品:
①将仪器A中的反应液倒入盛有适量水的烧杯中,分批加入饱和溶液至溶液呈中性。
②用分液漏斗分出步骤①中的有机层,用乙醚萃取水层中残留产品,然后合并有机层,并向其中加入无水
 ,经“一定操作”后得到粗产品。
,经“一定操作”后得到粗产品。③将粗产品转移至图乙的仪器D中进行减压蒸馏,收集211~213℃的馏分,制得产品2.25g。
(3)加入饱和
 溶液的作用主要是①溶解乙醇,②中和
溶液的作用主要是①溶解乙醇,②中和(4)加入无水
 后的“一定操作”的名称是
后的“一定操作”的名称是(5)乙中毛细管的作用是
(6)本实验的产率为
您最近一年使用:0次
2024-06-01更新
|
231次组卷
|
2卷引用:湖北省宜荆荆随恩2023-2024学年高二下学期5月联考化学试题
解题方法
5 . 已知草酸镍晶体(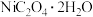 )难溶于水,其在高温下煅烧可制得三氧化二镍。以含镍合金废料(主要成分为镍,含有一定量的铁、铜和硅)为原料生产草酸镍的工艺流程如图:
)难溶于水,其在高温下煅烧可制得三氧化二镍。以含镍合金废料(主要成分为镍,含有一定量的铁、铜和硅)为原料生产草酸镍的工艺流程如图: 、
、 、
、 、
、 、
、 、
、 。
。
②草酸的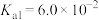 、
、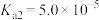 。
。
③氨水的 。
。
回答下列问题:
(1)实验室进行“酸浸”操作时,需要在通风橱中进行,其原因是___________ 。
(2) 的VSEPR模型为
的VSEPR模型为___________ 。
(3)“过滤”后,需要往滤液中加入 溶液制备草酸镍,
溶液制备草酸镍, 溶液呈
溶液呈___________ (填“酸”“碱”或“中”)性,溶液中离子浓度由大到小的顺序是___________ 。
(4)已知常温下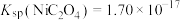 ,当溶液pH=2时,
,当溶液pH=2时, 沉淀完全[
沉淀完全[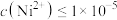
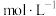 时认为沉淀完全],则此时溶液中草酸的浓度
时认为沉淀完全],则此时溶液中草酸的浓度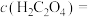
___________ 。
(5)镍钛记忆合金可用于制造飞机和宇宙飞船。已知一种镍钛合金的晶胞结构如图所示,其中Ti原子采用面心立方最密堆积方式,该合金中与Ti原子距离最近且相等的Ni原子个数为___________ ;若该合金的密度为 ,
, 代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是
代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是___________ (用含 和
和 的计算式表示,不必化简)pm。
的计算式表示,不必化简)pm。
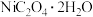 )难溶于水,其在高温下煅烧可制得三氧化二镍。以含镍合金废料(主要成分为镍,含有一定量的铁、铜和硅)为原料生产草酸镍的工艺流程如图:
)难溶于水,其在高温下煅烧可制得三氧化二镍。以含镍合金废料(主要成分为镍,含有一定量的铁、铜和硅)为原料生产草酸镍的工艺流程如图: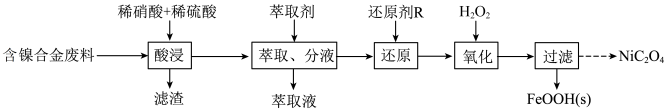
 、
、 、
、 、
、 、
、 、
、 。
。②草酸的
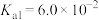 、
、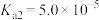 。
。③氨水的
 。
。回答下列问题:
(1)实验室进行“酸浸”操作时,需要在通风橱中进行,其原因是
(2)
 的VSEPR模型为
的VSEPR模型为(3)“过滤”后,需要往滤液中加入
 溶液制备草酸镍,
溶液制备草酸镍, 溶液呈
溶液呈(4)已知常温下
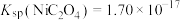 ,当溶液pH=2时,
,当溶液pH=2时, 沉淀完全[
沉淀完全[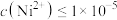
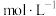 时认为沉淀完全],则此时溶液中草酸的浓度
时认为沉淀完全],则此时溶液中草酸的浓度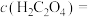
(5)镍钛记忆合金可用于制造飞机和宇宙飞船。已知一种镍钛合金的晶胞结构如图所示,其中Ti原子采用面心立方最密堆积方式,该合金中与Ti原子距离最近且相等的Ni原子个数为
 ,
, 代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是
代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是 和
和 的计算式表示,不必化简)pm。
的计算式表示,不必化简)pm。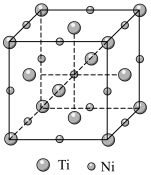
您最近一年使用:0次
2024-06-01更新
|
175次组卷
|
4卷引用:湖北省十堰市2023-2024学年高三下学期4月调研考试化学试题
解题方法
6 .  -呋喃丙烯酸是一种重要的有机酸,其实验室制备原理如下:
-呋喃丙烯酸是一种重要的有机酸,其实验室制备原理如下: -呋喃丙烯酸的步骤如下:向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入装有100mL蒸馏水的烧杯中,加入固体碳酸钠中和至弱碱性,加入活性炭后煮沸5~10min脱色,趁热过滤;滤液在冰水浴中边搅拌边滴加浓盐酸至不再有沉淀生成,抽滤,用冷水洗涤2~3次,得到粗产品。实验装置如图所示。
-呋喃丙烯酸的步骤如下:向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入装有100mL蒸馏水的烧杯中,加入固体碳酸钠中和至弱碱性,加入活性炭后煮沸5~10min脱色,趁热过滤;滤液在冰水浴中边搅拌边滴加浓盐酸至不再有沉淀生成,抽滤,用冷水洗涤2~3次,得到粗产品。实验装置如图所示。___________ 。
(2)与酒精灯加热相比,使用油浴加热的优点是___________ 。
(3)三颈烧瓶中反应已完成的标志是___________ 。
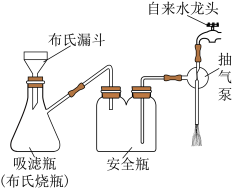
(4)分离出晶体时需减压抽滤,装置如图所示,抽滤的优点是___________ 。
称取mg -呋喃丙烯酸样品,加入1∶1的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为
-呋喃丙烯酸样品,加入1∶1的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为 的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为VmL。
的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为VmL。
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为___________ 。
②产品的纯度是___________ (以质量分数表示)。
③下列操作会使测定结果偏大的是___________ (填标号)。
A.称量样品时,将样品放在托盘天平的右盘
B.加热回流阶段,油浴时没有搅拌,出现焦化现象
C.滴定过程中,读数时,滴定前仰视,滴定后俯视
D.滴定前,尖嘴管有气泡,滴定后无气泡
 -呋喃丙烯酸是一种重要的有机酸,其实验室制备原理如下:
-呋喃丙烯酸是一种重要的有机酸,其实验室制备原理如下: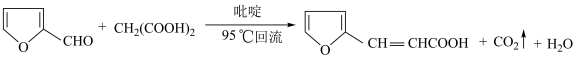
 -呋喃丙烯酸的步骤如下:向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入装有100mL蒸馏水的烧杯中,加入固体碳酸钠中和至弱碱性,加入活性炭后煮沸5~10min脱色,趁热过滤;滤液在冰水浴中边搅拌边滴加浓盐酸至不再有沉淀生成,抽滤,用冷水洗涤2~3次,得到粗产品。实验装置如图所示。
-呋喃丙烯酸的步骤如下:向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入装有100mL蒸馏水的烧杯中,加入固体碳酸钠中和至弱碱性,加入活性炭后煮沸5~10min脱色,趁热过滤;滤液在冰水浴中边搅拌边滴加浓盐酸至不再有沉淀生成,抽滤,用冷水洗涤2~3次,得到粗产品。实验装置如图所示。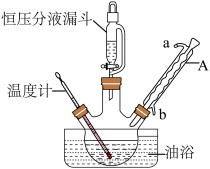
(2)与酒精灯加热相比,使用油浴加热的优点是
(3)三颈烧瓶中反应已完成的标志是
(4)分离出晶体时需减压抽滤,装置如图所示,抽滤的优点是
称取mg
 -呋喃丙烯酸样品,加入1∶1的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为
-呋喃丙烯酸样品,加入1∶1的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为 的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为VmL。
的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为VmL。①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为
②产品的纯度是
③下列操作会使测定结果偏大的是
A.称量样品时,将样品放在托盘天平的右盘
B.加热回流阶段,油浴时没有搅拌,出现焦化现象
C.滴定过程中,读数时,滴定前仰视,滴定后俯视
D.滴定前,尖嘴管有气泡,滴定后无气泡
您最近一年使用:0次
2024-06-01更新
|
146次组卷
|
3卷引用:湖北省十堰市2023-2024学年高三下学期4月调研考试化学试题
名校
7 . 钛(Ti)、铬(Cr)、锰(Mn)、钴(Co)、镉(Cd)等过渡金属及其化合物在生产生活中应用广泛,回答下列问题。
(1)基态Cr原子的价层电子轨道表示式为___________ 。
(2)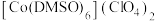 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中Cl原子的杂化轨道类型是
中Cl原子的杂化轨道类型是___________ , 中键角<C-S-O
中键角<C-S-O___________  中键角<C-C-O(填“大于”“小于”或“等于”)。
中键角<C-C-O(填“大于”“小于”或“等于”)。
(3) 与
与 等配体可形成配离子。
等配体可形成配离子。 中2个
中2个 被2个
被2个 替代只得到1种结构,则
替代只得到1种结构,则 的空间构型是
的空间构型是___________ 。
(4)钛与卤素形成的化合物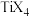 熔点如下表:
熔点如下表:
它们熔点差异的原因___________ 。
(5)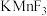 晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在
晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在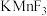 晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为
晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为___________ (填阿拉伯数字序号)。 占据
占据 形成的
形成的___________ (填“四面体空隙”或“八面体空隙”)。 为阿伏加德罗常数的值,钴蓝晶体的密度为
为阿伏加德罗常数的值,钴蓝晶体的密度为___________  (列计算式)。
(列计算式)。
(1)基态Cr原子的价层电子轨道表示式为
(2)
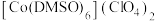 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中Cl原子的杂化轨道类型是
中Cl原子的杂化轨道类型是 中键角<C-S-O
中键角<C-S-O 中键角<C-C-O(填“大于”“小于”或“等于”)。
中键角<C-C-O(填“大于”“小于”或“等于”)。(3)
 与
与 等配体可形成配离子。
等配体可形成配离子。 中2个
中2个 被2个
被2个 替代只得到1种结构,则
替代只得到1种结构,则 的空间构型是
的空间构型是(4)钛与卤素形成的化合物
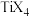 熔点如下表:
熔点如下表: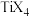 |  |  |  |  |
| 熔点℃ | 377 |  | 38.3 | 153 |
(5)
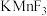 晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在
晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在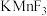 晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为
晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为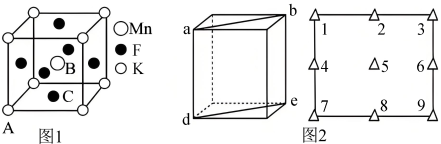
 占据
占据 形成的
形成的 为阿伏加德罗常数的值,钴蓝晶体的密度为
为阿伏加德罗常数的值,钴蓝晶体的密度为 (列计算式)。
(列计算式)。
您最近一年使用:0次
名校
8 . A、B、C、D、E为短周期元素且它们的原子序数依次增大,A原子的核外电子总数与其周期数相同:D原子的L能层中,成对电子与未成对电子占据的轨道数相同,并且无空轨道;B原子的L能层中未成对电子数与D原子的相同,但有空轨道:D与E同族。回答下列问题。
(1)A与上述其他元素形成的二元共价化合物中,有一种化合物分子呈三角锥形,该分子的化学式为___________ ,其中心原子的杂化方式为___________ ,A分别与B、C、D形成的共价化合物中既含有极性共价键,又含有非极性共价键的化合物有___________ (填化学式,任意写出两种)。
(2)这些元素形成的含氧酸根离子中,其中心原子的价层电子对数为3的酸根离子是___________ (填化学式,下同);酸根离子呈三角锥形结构的是___________ 。
(3) 分子的空间结构为
分子的空间结构为___________ ;根据电子云重叠方式的不同,该分子中共价键的类型为___________ 。
(4)B的一种氢化物的相对分子质量是26,其分子中 键和
键和 键的数目之比为
键的数目之比为___________ 。
(1)A与上述其他元素形成的二元共价化合物中,有一种化合物分子呈三角锥形,该分子的化学式为
(2)这些元素形成的含氧酸根离子中,其中心原子的价层电子对数为3的酸根离子是
(3)
 分子的空间结构为
分子的空间结构为(4)B的一种氢化物的相对分子质量是26,其分子中
 键和
键和 键的数目之比为
键的数目之比为
您最近一年使用:0次
9 . 元素周期表反映了元素之间的内在联系,是研究物质性质的重要工具。下表是元素周期表的一部分,请回答:_________ 。
(2)②③④简单氢化物的稳定性由强到弱的顺序为_________ (填化学式);④⑤⑥形成的简单离子半径由大到小的顺序为_________ (填离子符号)。
(3)用电子式表示④的简单氢化物的形成过程_______________ 。
(4)①~⑦号元素中,金属性最强的是_________ (写元素符号),其最高价氧化物对应的水化物与元素⑥
的单质反应的化学方程式为。
(5)⑧在元素周期表中的位置是____________ 。
(6)下列性质的比较,不能用元素周期律解释的是__________。

(2)②③④简单氢化物的稳定性由强到弱的顺序为
(3)用电子式表示④的简单氢化物的形成过程
(4)①~⑦号元素中,金属性最强的是
的单质反应的化学方程式为。
(5)⑧在元素周期表中的位置是
(6)下列性质的比较,不能用元素周期律解释的是__________。
A.酸性: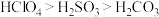 | B.碱性: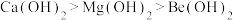 |
C.稳定性: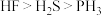 | D.沸点高低: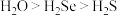 |
您最近一年使用:0次
解题方法
10 . 四氯化锡( )是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
)是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
回答下列问题:
(1)“仪器a”的名称是___________ ,A中反应的离子方程式为___________ 。
(2)实验前应进行的操作是___________ ,实验开始时,应先点燃___________ (填“A”或“D”)处的酒精灯。
(3)若无“洗气瓶B”,可能会导致的问题是___________ 。
(4)实验结束后,“小试管b”内收集到的液体呈淡黄色,其原因是___________ 。
(5)“洗气瓶F”中所盛放的药品是___________ 。
 )是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
)是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。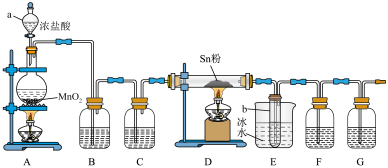
| 药品 | 颜色、状态 | 熔点(℃) | 沸点(℃) | 其他性质 |
| Sn | 银白色固体 | 231 | 2260 | 较活泼金属能与 、HCl等气体发生反应 、HCl等气体发生反应 |
 | 无色液体 | ﹣33 | 114 | 极易与水反应产生 溶胶 溶胶 |
(1)“仪器a”的名称是
(2)实验前应进行的操作是
(3)若无“洗气瓶B”,可能会导致的问题是
(4)实验结束后,“小试管b”内收集到的液体呈淡黄色,其原因是
(5)“洗气瓶F”中所盛放的药品是
您最近一年使用:0次



