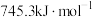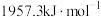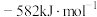名校
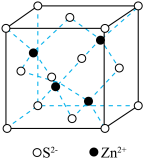
1 . 一种可吸附甲醇的材料,其化学式为 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 所有原子共平面。
所有原子共平面。
回答下列问题:
(1) 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有_____ (填序号)。
a.金属键 b.离子键 c.配位键 d.氢键
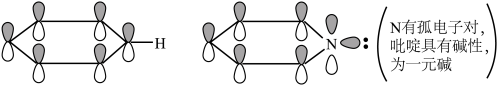
(2)下列关于胍(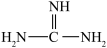 )的说法正确的是
)的说法正确的是________ (填序号)。
a.胍中C的杂化方式与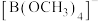 中B的相同
中B的相同
b.与 互为等电子体
互为等电子体
c.有大 键:
键:
d.为一元碱
(3) 酸性条件下的水解产物是
酸性条件下的水解产物是__________ 和__________ (均写结构简式)。
(4)化合物A(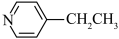 )具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
)具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
①化合物A最多有__________ 个碳原子共平面。
②化合物A的碱性比吡啶__________ (填“强”或“弱”)。
③化合物A的六元环芳香同分异构体有__________ 种。
 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 所有原子共平面。
所有原子共平面。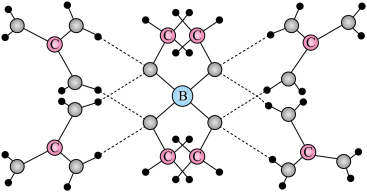
苯( | 吡啶( | |
重原子数 | 6 |
|
价电子数 |
|
|
关系 | 互为等电子体 | |
| ||
共同特点 | 有大 | |
具有芳香性 | ||
(1)
 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有a.金属键 b.离子键 c.配位键 d.氢键
(2)下列关于胍(
 )的说法正确的是
)的说法正确的是a.胍中C的杂化方式与
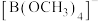 中B的相同
中B的相同b.与
 互为等电子体
互为等电子体c.有大
 键:
键: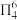
d.为一元碱
(3)
 酸性条件下的水解产物是
酸性条件下的水解产物是(4)化合物A(
 )具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
)具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。①化合物A最多有
②化合物A的碱性比吡啶
③化合物A的六元环芳香同分异构体有
您最近一年使用:0次
名校
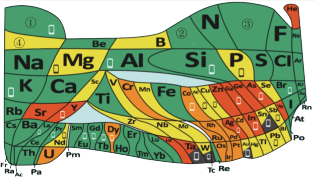
2 . 化学教材后的元素周期表为通用元素周期表,2019年是门捷列夫提出元素周期表诞生150周年,联合国宣布2019年为“国际化学元素周期表年”。同年,欧洲化学学会(EuChemS)发布了1张“扭曲”的元素周期表,指出:由于过度使用,部分元素可能在未来的100年内从地球上消失。每种元素在周期表上所占面积的大小,呈现出元素的稀缺程度。___________ ;④是手机电池的主要构成元素,④的单质在③的常见单质中点燃的方程式为___________ 。
(2)用电子式表示①与③形成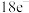 化合物的过程:
化合物的过程:___________ 。
(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有___________ (填序号)。___________ 。
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为___________ 。
② 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与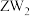 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式___________ 。
(2)用电子式表示①与③形成
 化合物的过程:
化合物的过程:(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有
a. 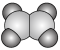 b.
b.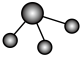 c.
c. 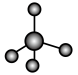 d.
d.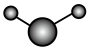
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。
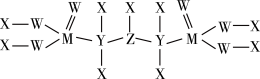
 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为②
 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与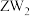 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式
您最近一年使用:0次
名校
3 . 铜及其化合物在生活、生产中用途广泛。回答下列问题:
(1)基态铁原子的价层电子的轨道表示式为__________ ,其原子核外电子的空间运动状态有__________ 种。
(2)高温下CuO能转化为 ,说明高温下
,说明高温下 比
比 稳定,原因是
稳定,原因是__________ 。
(3)在水溶液中 则不如
则不如 稳定,因为
稳定,因为 在水溶液中可以
在水溶液中可以 的形式存在。请结合表中信息加以解释
的形式存在。请结合表中信息加以解释__________ 。
(注:水合能指的是气态基态离子与水分子结合生成 水合离子时所释放的能量。)
水合离子时所释放的能量。)
(4)H、N、O与Cu能形成一种阳离子M,呈轴向狭长的八面体结构(如下图所示)。__________ ,加热时,M首先失去的组分分子空间结构名称为__________ 。
(5) 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为__________ 。晶胞参数分别为 ,
, 、
、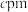 ,晶胞棱边夹角均为90°,该晶体的密度为
,晶胞棱边夹角均为90°,该晶体的密度为__________  (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
(1)基态铁原子的价层电子的轨道表示式为
(2)高温下CuO能转化为
 ,说明高温下
,说明高温下 比
比 稳定,原因是
稳定,原因是(3)在水溶液中
 则不如
则不如 稳定,因为
稳定,因为 在水溶液中可以
在水溶液中可以 的形式存在。请结合表中信息加以解释
的形式存在。请结合表中信息加以解释第一电离能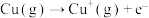 | 第二电离能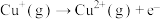 | 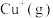 水合能( 水合能( ) ) | 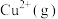 水合能( 水合能( ) ) |
|
|
|
|
 水合离子时所释放的能量。)
水合离子时所释放的能量。)(4)H、N、O与Cu能形成一种阳离子M,呈轴向狭长的八面体结构(如下图所示)。
(5)
 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为 ,
, 、
、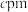 ,晶胞棱边夹角均为90°,该晶体的密度为
,晶胞棱边夹角均为90°,该晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
4 . 我国自主研发的用氟硼铍酸钾(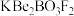 )晶体制造深紫外固体激光器技术领先世界。回答下列问题:
)晶体制造深紫外固体激光器技术领先世界。回答下列问题:
(1)基态K原子核外有_____ 种不同运动状态的电子,能量最低的空轨道的符号是_____ 。
(2)在1000℃时,氯化铍以 形式存在,该分子的空间构型为
形式存在,该分子的空间构型为_____ ;在500~600℃气相中,氯化铍则以二聚体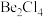 的形式存在,画出
的形式存在,画出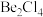 的结构:
的结构:_____ (标出配位键)。
(3)在第二周期中第一电离能介于B和O两种元素之间的元素有_____ (填元素符号)。
(4) 分子中的
分子中的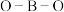 的键角大于
的键角大于 中的
中的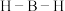 的键角,判断依据是
的键角,判断依据是_____ (从中心原子杂化方式的角度来解释)。
(5)一定条件下,实验测得的HF的相对分子质量总是大于理论值,原因是_____ 。
(6)六方氮化硼在高温高压下,可以转化为立方氮化硼,二者晶体结构如图所示: 六方氮化硼晶体中含有六元环的数目为
六方氮化硼晶体中含有六元环的数目为_____  (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
②立方氮化硼晶体中,设晶胞中最近的B、N原子之间的距离为apm,晶体的密度为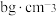 。则阿伏加德罗常数为
。则阿伏加德罗常数为_____  。(列式即可,用含a、b的代数式表示)
。(列式即可,用含a、b的代数式表示)
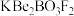 )晶体制造深紫外固体激光器技术领先世界。回答下列问题:
)晶体制造深紫外固体激光器技术领先世界。回答下列问题:(1)基态K原子核外有
(2)在1000℃时,氯化铍以
 形式存在,该分子的空间构型为
形式存在,该分子的空间构型为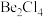 的形式存在,画出
的形式存在,画出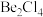 的结构:
的结构:(3)在第二周期中第一电离能介于B和O两种元素之间的元素有
(4)
 分子中的
分子中的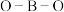 的键角大于
的键角大于 中的
中的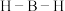 的键角,判断依据是
的键角,判断依据是(5)一定条件下,实验测得的HF的相对分子质量总是大于理论值,原因是
(6)六方氮化硼在高温高压下,可以转化为立方氮化硼,二者晶体结构如图所示:

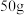 六方氮化硼晶体中含有六元环的数目为
六方氮化硼晶体中含有六元环的数目为 (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。②立方氮化硼晶体中,设晶胞中最近的B、N原子之间的距离为apm,晶体的密度为
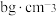 。则阿伏加德罗常数为
。则阿伏加德罗常数为 。(列式即可,用含a、b的代数式表示)
。(列式即可,用含a、b的代数式表示)
您最近一年使用:0次
名校
5 . 氨硼烷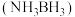 具有含氢量高,热稳定性好的特点,是一种具有潜力的固体储氢材料,回答下列问题。
具有含氢量高,热稳定性好的特点,是一种具有潜力的固体储氢材料,回答下列问题。
(1)基态N原子核外电子占据的最高能级的电子云轮廓图为___________ 形,基态N原子的轨道表示式为___________ 。
(2)已知 的第一电离能
的第一电离能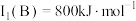 ,判断
,判断
___________ (填“>”或“<”)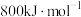 ,从核外电子排布的角度说明理由:
,从核外电子排布的角度说明理由:___________
(3) 分子中,与
分子中,与 原子相连的
原子相连的 原子对键合电子的吸引力小于
原子对键合电子的吸引力小于 原子,与
原子,与 原子相连的
原子相连的 原子对键合电子的吸引力大于
原子对键合电子的吸引力大于 原子。则在
原子。则在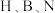 三种元素中:
三种元素中:
①电负性大小顺序是___________ (用元素符号表示,下同);
②原子半径大小顺序是___________ ;
③在元素周期表中的分区与其他两种元素不同的是___________ ;
(4)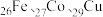 是目前氨硼烷水解产氢催化剂的研究热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。
是目前氨硼烷水解产氢催化剂的研究热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。___________ ,催化效果最差的金属的基态原子的价层电子排布式为___________ 。
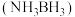 具有含氢量高,热稳定性好的特点,是一种具有潜力的固体储氢材料,回答下列问题。
具有含氢量高,热稳定性好的特点,是一种具有潜力的固体储氢材料,回答下列问题。(1)基态N原子核外电子占据的最高能级的电子云轮廓图为
(2)已知
 的第一电离能
的第一电离能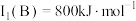 ,判断
,判断
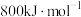 ,从核外电子排布的角度说明理由:
,从核外电子排布的角度说明理由:(3)
 分子中,与
分子中,与 原子相连的
原子相连的 原子对键合电子的吸引力小于
原子对键合电子的吸引力小于 原子,与
原子,与 原子相连的
原子相连的 原子对键合电子的吸引力大于
原子对键合电子的吸引力大于 原子。则在
原子。则在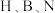 三种元素中:
三种元素中:①电负性大小顺序是
②原子半径大小顺序是
③在元素周期表中的分区与其他两种元素不同的是
(4)
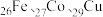 是目前氨硼烷水解产氢催化剂的研究热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。
是目前氨硼烷水解产氢催化剂的研究热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。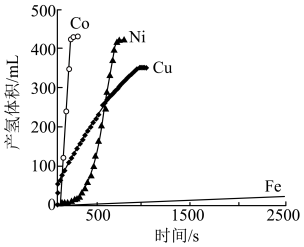
您最近一年使用:0次
名校
6 . 钛(Ti)、铬(Cr)、锰(Mn)、钴(Co)、镉(Cd)等过渡金属及其化合物在生产生活中应用广泛,回答下列问题。
(1)基态Cr原子的价层电子轨道表示式为___________ 。
(2)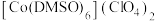 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中Cl原子的杂化轨道类型是
中Cl原子的杂化轨道类型是___________ , 中键角<C-S-O
中键角<C-S-O___________  中键角<C-C-O(填“大于”“小于”或“等于”)。
中键角<C-C-O(填“大于”“小于”或“等于”)。
(3) 与
与 等配体可形成配离子。
等配体可形成配离子。 中2个
中2个 被2个
被2个 替代只得到1种结构,则
替代只得到1种结构,则 的空间构型是
的空间构型是___________ 。
(4)钛与卤素形成的化合物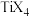 熔点如下表:
熔点如下表:
它们熔点差异的原因___________ 。
(5) 晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在
晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在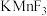 晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为
晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为___________ (填阿拉伯数字序号)。 占据
占据 形成的
形成的___________ (填“四面体空隙”或“八面体空隙”)。 为阿伏加德罗常数的值,钴蓝晶体的密度为
为阿伏加德罗常数的值,钴蓝晶体的密度为___________  (列计算式)。
(列计算式)。
(1)基态Cr原子的价层电子轨道表示式为
(2)
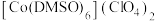 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中Cl原子的杂化轨道类型是
中Cl原子的杂化轨道类型是 中键角<C-S-O
中键角<C-S-O 中键角<C-C-O(填“大于”“小于”或“等于”)。
中键角<C-C-O(填“大于”“小于”或“等于”)。(3)
 与
与 等配体可形成配离子。
等配体可形成配离子。 中2个
中2个 被2个
被2个 替代只得到1种结构,则
替代只得到1种结构,则 的空间构型是
的空间构型是(4)钛与卤素形成的化合物
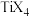 熔点如下表:
熔点如下表: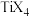 |  |  |  |  |
| 熔点℃ | 377 |  | 38.3 | 153 |
(5)
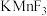 晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在
晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在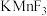 晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为
晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为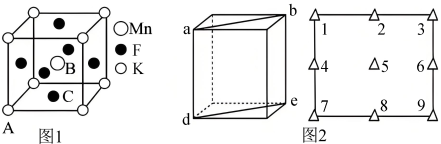
 占据
占据 形成的
形成的 为阿伏加德罗常数的值,钴蓝晶体的密度为
为阿伏加德罗常数的值,钴蓝晶体的密度为 (列计算式)。
(列计算式)。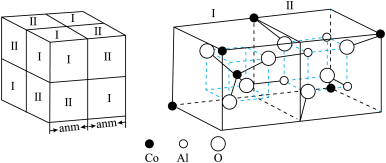
您最近一年使用:0次
名校
解题方法
7 . 已知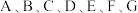 为元素周期表中前四周期元素,其原子序数依次增大。请根据下列信息,回答问题。
为元素周期表中前四周期元素,其原子序数依次增大。请根据下列信息,回答问题。
(1)请写出 元素与其他六种元素形成的18电子的分子的电子式
元素与其他六种元素形成的18电子的分子的电子式_____________ (写一种即可)。
(2)基态 原子中能量最高的电子,其电子云在空间有
原子中能量最高的电子,其电子云在空间有_________ 个伸展方向,原子轨道呈_________________ 形。
(3)某同学根据上述信息,推断基态 原子的轨道表示式为
原子的轨道表示式为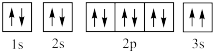 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了_____________________ 。
(4)请比较基态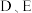 原子的第一电离能大小
原子的第一电离能大小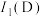
_________ 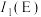 (填“
(填“ ”或“
”或“ ”)。
”)。
(5)检验 元素的实验方法是
元素的实验方法是_____________ ,请用原子结构的知识解释该方法的原理:_________________ 。
(6) 位于元素周期表
位于元素周期表_________ 族_________ 区,基态原子价层电子轨道表示式为_____________________ 。
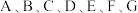 为元素周期表中前四周期元素,其原子序数依次增大。请根据下列信息,回答问题。
为元素周期表中前四周期元素,其原子序数依次增大。请根据下列信息,回答问题。元素 | 相关信息 |
A | 基态原子核外电子数和电子层数相等 |
| 基态原子的 电子数比 电子数比 电子数少1 电子数少1 |
C | 基态原子的第一至第四电离能分别是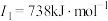 ; ;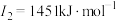 ; ;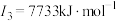 ; ;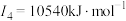 |
D | 基态原子在同周期元素中未成对电子最多 |
| 基态原子有2个未成对电子 |
| 是前四周期中电负性最小的元素 |
| 位于元素周期表的第七列 |
(1)请写出
 元素与其他六种元素形成的18电子的分子的电子式
元素与其他六种元素形成的18电子的分子的电子式(2)基态
 原子中能量最高的电子,其电子云在空间有
原子中能量最高的电子,其电子云在空间有(3)某同学根据上述信息,推断基态
 原子的轨道表示式为
原子的轨道表示式为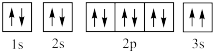 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了(4)请比较基态
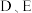 原子的第一电离能大小
原子的第一电离能大小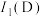
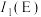 (填“
(填“ ”或“
”或“ ”)。
”)。(5)检验
 元素的实验方法是
元素的实验方法是(6)
 位于元素周期表
位于元素周期表
您最近一年使用:0次
名校
解题方法
8 . 晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着他具有不同的性质和用途,回答下列问题:
(1) 可写成
可写成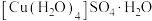 ,其结构示意图如下图,则硫酸铜晶体中
,其结构示意图如下图,则硫酸铜晶体中 的配位数为
的配位数为___________ ,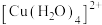 中配位原子是
中配位原子是___________ 。 原子立方晶格的八面体空隙中,晶胞结构如图所示。
原子立方晶格的八面体空隙中,晶胞结构如图所示。___________ , 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为___________ 。
(3)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞(如图1)内部的碳原子被N原子代替,顶点和面心的碳原子被 原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为
原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为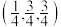 ,则原子2和4的原子分数坐标为
,则原子2和4的原子分数坐标为___________ 、___________ 。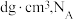 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 的晶胞中
的晶胞中 的配位数为
的配位数为___________ ; 和
和 之间的最短核间距(x)为
之间的最短核间距(x)为___________  (用代数式表示)。
(用代数式表示)。
(1)
 可写成
可写成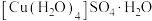 ,其结构示意图如下图,则硫酸铜晶体中
,其结构示意图如下图,则硫酸铜晶体中 的配位数为
的配位数为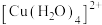 中配位原子是
中配位原子是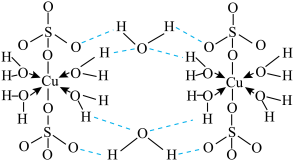
 原子立方晶格的八面体空隙中,晶胞结构如图所示。
原子立方晶格的八面体空隙中,晶胞结构如图所示。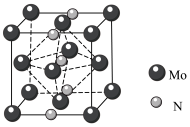
 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为(3)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞(如图1)内部的碳原子被N原子代替,顶点和面心的碳原子被
 原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为
原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为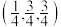 ,则原子2和4的原子分数坐标为
,则原子2和4的原子分数坐标为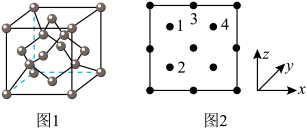
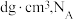 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 的晶胞中
的晶胞中 的配位数为
的配位数为 和
和 之间的最短核间距(x)为
之间的最短核间距(x)为 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
名校
9 . 回答以下关于元素及其化合物的问题.
(1)下列状态的铝中,最外层电离出一个电子所需要能量由大到小的顺序______________ (填标号)。______________ ,基态氧原子的价层电子不是重排结构,原因是不符合______________ 。
(3)下图中分别代表了碳单质的两种常见晶体,碳元素位于元素周期表的______________ 区;图1晶体中1个最小六元环平均含有C原子数与图2晶体中1个最小六元环平均含有C原子数之比为______________ ;图3是石墨层间插入氟得到层状结构化合物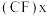 ,该物质仍具润滑性,与石墨相比,
,该物质仍具润滑性,与石墨相比,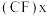 导电性
导电性______________ (填“增强”或“减弱”)。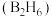 、丁硼烷
、丁硼烷 等.乙硼烷的结构式如图
等.乙硼烷的结构式如图 。分子中B原子通过氢桥键(
。分子中B原子通过氢桥键(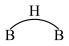 )形成一个四元环。丁硼烷
)形成一个四元环。丁硼烷 分子中存在4个氢桥键且有两个五元环,写出其结构式
分子中存在4个氢桥键且有两个五元环,写出其结构式______________ 。
(1)下列状态的铝中,最外层电离出一个电子所需要能量由大到小的顺序
A.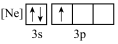 B.
B.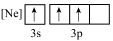 C.
C.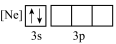 D.
D.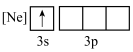
(3)下图中分别代表了碳单质的两种常见晶体,碳元素位于元素周期表的
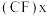 ,该物质仍具润滑性,与石墨相比,
,该物质仍具润滑性,与石墨相比,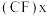 导电性
导电性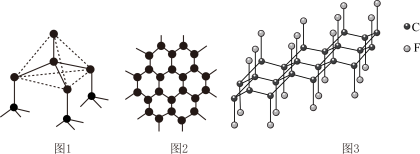
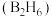 、丁硼烷
、丁硼烷 等.乙硼烷的结构式如图
等.乙硼烷的结构式如图 。分子中B原子通过氢桥键(
。分子中B原子通过氢桥键( )形成一个四元环。丁硼烷
)形成一个四元环。丁硼烷 分子中存在4个氢桥键且有两个五元环,写出其结构式
分子中存在4个氢桥键且有两个五元环,写出其结构式
您最近一年使用:0次
解题方法
10 . 碳酸氢钠广泛应用于化工、医药、食品和纺织等领域。
(1)实验室用碳酸氢钠固体配制 溶液,需要的仪器有药匙、胶头滴管、量筒、
溶液,需要的仪器有药匙、胶头滴管、量筒、_____ (从下图中选择,写出仪器名称)。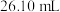 碳酸氢钠溶液于锥形瓶中,滴入2滴甲基橙作指示剂,用浓度为
碳酸氢钠溶液于锥形瓶中,滴入2滴甲基橙作指示剂,用浓度为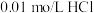 溶液滴定未知浓度的碳酸氢钠溶液。
溶液滴定未知浓度的碳酸氢钠溶液。
①滴定终点的现象是_____ 。
②重复4次的实验数据如下表(待测液的体积均为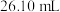 )。
)。
标准 溶液体积的平均值为
溶液体积的平均值为_____  ,用该数据可计算出碳酸氢钠溶液的浓度。
,用该数据可计算出碳酸氢钠溶液的浓度。
(3) 时,向
时,向 溶液中滴加
溶液中滴加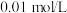 的盐酸,溶液的
的盐酸,溶液的 随加入的盐酸的体积变化如图所示。下列说法正确的是_____(填标号)。
随加入的盐酸的体积变化如图所示。下列说法正确的是_____(填标号)。
(4)某化学小组探究外界因素对 水解程度的影响。甲同学设计实验方案如下
水解程度的影响。甲同学设计实验方案如下
(表中溶液浓度均为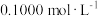 ):
):
i.实验1和2探究加水稀释对 水解程度的影响;
水解程度的影响;
ii.实验1和3探究加入 对
对 水解程度的影响;
水解程度的影响;
iii.实验1和4探究温度对 水解程度的影响。
水解程度的影响。
①根据甲同学的实验方案,补充数据:
_____  。加水稀释
。加水稀释 的水解程度
的水解程度_____ (填“增大”或“减小”)。
②已知 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测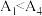 ,但实验结果为
,但实验结果为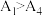 。实验结果与预测不一致的原因可能是
。实验结果与预测不一致的原因可能是_____ 。
(1)实验室用碳酸氢钠固体配制
 溶液,需要的仪器有药匙、胶头滴管、量筒、
溶液,需要的仪器有药匙、胶头滴管、量筒、
 碳酸氢钠溶液于锥形瓶中,滴入2滴甲基橙作指示剂,用浓度为
碳酸氢钠溶液于锥形瓶中,滴入2滴甲基橙作指示剂,用浓度为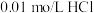 溶液滴定未知浓度的碳酸氢钠溶液。
溶液滴定未知浓度的碳酸氢钠溶液。①滴定终点的现象是
②重复4次的实验数据如下表(待测液的体积均为
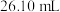 )。
)。| 实验次数 | 1 | 2 | 3 | 4 |
 溶液体积/ 溶液体积/ | 26.10 | 28.20 | 26.12 | 26.08 |
 溶液体积的平均值为
溶液体积的平均值为 ,用该数据可计算出碳酸氢钠溶液的浓度。
,用该数据可计算出碳酸氢钠溶液的浓度。(3)
 时,向
时,向 溶液中滴加
溶液中滴加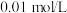 的盐酸,溶液的
的盐酸,溶液的 随加入的盐酸的体积变化如图所示。下列说法正确的是_____(填标号)。
随加入的盐酸的体积变化如图所示。下列说法正确的是_____(填标号)。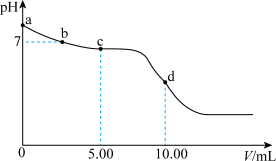
A.若a点坐标为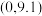 ,则 ,则 水解常数的数量级为 水解常数的数量级为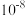 |
B.b点, |
C.c点,溶液中的 主要来自 主要来自 的电离 的电离 |
D.d点,溶液中微粒浓度存在关系: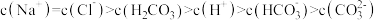 |
(4)某化学小组探究外界因素对
 水解程度的影响。甲同学设计实验方案如下
水解程度的影响。甲同学设计实验方案如下(表中溶液浓度均为
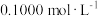 ):
):i.实验1和2探究加水稀释对
 水解程度的影响;
水解程度的影响;ii.实验1和3探究加入
 对
对 水解程度的影响;
水解程度的影响;iii.实验1和4探究温度对
 水解程度的影响。
水解程度的影响。| 序号 | 温度 | 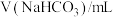 |  |  |  |
| 1 |  | 30.0 | 0 | 0 | 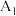 |
| 2 |  | 8.0 | 0 | 22.0 |  |
| 3 |  | 15.0 | a | b | 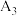 |
| 4 |  | 30.1 | 0 | 0 | 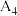 |

 。加水稀释
。加水稀释 的水解程度
的水解程度②已知
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测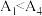 ,但实验结果为
,但实验结果为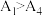 。实验结果与预测不一致的原因可能是
。实验结果与预测不一致的原因可能是
您最近一年使用:0次
2024-04-29更新
|
38次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题

 )
)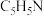 )
)
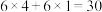


 (
(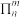 ,其中
,其中 为形成大
为形成大