真题
解题方法
1 . 学习小组为探究 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。
已知: 为粉红色、
为粉红色、 为蓝色、
为蓝色、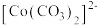 为红色、
为红色、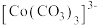 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:
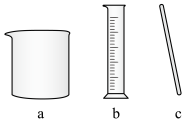
(1)配制 的
的 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的_______ (填标号)。
_______ (填“能”或“不能”)催化 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是_______ 。实验Ⅲ初步表明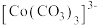 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式_______ 、_______ 。
(3)实验I表明,反应 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因_______ 。_______ 、_______ 。
 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。| 实验I | 实验Ⅱ | 实验Ⅲ |
|
|
|
| 无明显变化 | 溶液变为红色,伴有气泡产生 | 溶液变为墨绿色,并持续产生能使带火星木条复燃的气体 |
 为粉红色、
为粉红色、 为蓝色、
为蓝色、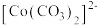 为红色、
为红色、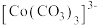 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:(1)配制
 的
的 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的a.  b.
b. 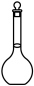 c.
c.  d.
d.

 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是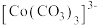 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式(3)实验I表明,反应
 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因实验Ⅳ:
您最近一年使用:0次
名校
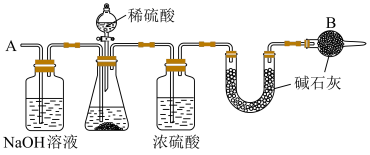
2 . 过氧乙酸(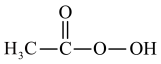 )在卫生医疗、食品消毒及漂白等领域有广泛应用。实验室利用醋酸与双氧水共热,在固体酸的催化下制备过氧乙酸,其装置如下图所示。
)在卫生医疗、食品消毒及漂白等领域有广泛应用。实验室利用醋酸与双氧水共热,在固体酸的催化下制备过氧乙酸,其装置如下图所示。
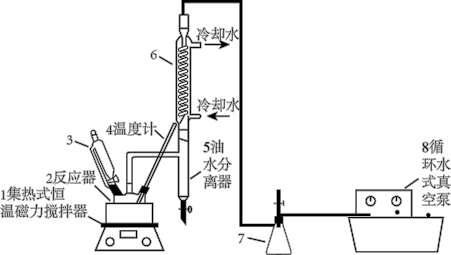
ⅰ.先向仪器2中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
ⅱ.待真空度达到反应要求时,通入冷却水,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水;
ⅲ.从仪器5定期放出水,待反应结束后分离反应器2中的混合物,得到粗产品。
回答下列问题:
(1)仪器2的名称是
(2)分离反应器2中的混合物得到粗产品,分离的方法是
(3)实验中加入乙酸丁酯的主要作用是
(4)过氧乙酸(含
 等)含量的测定:取一定体积的样品
等)含量的测定:取一定体积的样品 ,分成6等份,用过量
,分成6等份,用过量 还原,以
还原,以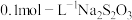 溶液滴定
溶液滴定 (
( ),重复2次,平均消耗量为
),重复2次,平均消耗量为 。再以
。再以 的酸性高锰酸钾溶液滴定样品(滴定过程中
的酸性高锰酸钾溶液滴定样品(滴定过程中 不与过氧乙酸反应),重复2次,平均消耗量为
不与过氧乙酸反应),重复2次,平均消耗量为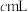 。涉及下列反应:
。涉及下列反应:ⅰ.

ⅱ.
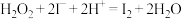
ⅲ.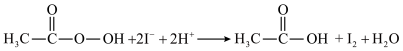
 溶液滴定
溶液滴定 时选用的指示剂是
时选用的指示剂是②用
 的酸性高锰酸钾溶液滴定样品,标志滴定终点的现象是
的酸性高锰酸钾溶液滴定样品,标志滴定终点的现象是③样品中的过氧乙酸的浓度为
 。(用含
。(用含 、
、 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
3 . 某学习小组为探究Mg与酸、碱、盐溶液的反应。完成如下实验:
回答下列问题:
(1)实验前除去镁表面氧化物的方法是______ 。
(2)实验Ⅰ的离子方程式为____________ 。
(3)经实验分析,实验Ⅲ中产生的气体为 和
和 混合气体。产生
混合气体。产生 气体的原因是
气体的原因是____________ 。
(4)该组同学们比较实验Ⅱ、Ⅲ后,分析认为:实验Ⅲ能快速反应的原因,与溶液中白色沉淀有关。为探究其成分,设计了如下实验。
取出镁条,将沉淀过滤、洗涤、低温烘干,得到纯净固体 。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在
。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在 处通入足量空气。最后称量
处通入足量空气。最后称量 形管增重
形管增重 。将另一半固体高温灼烧,最后剩余固体氧化物为
。将另一半固体高温灼烧,最后剩余固体氧化物为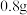 。
。____________ 。
②固体充分高温灼烧后,需要放在______ (填仪器名称)中冷却后才能称量。称量时______ (选填“是”“不是”)采用托盘天平称量。
(5)依据以上分析,实验Ⅲ中发生反应的方程式为____________ 。通过以上实验得出结论: 置换氢气与
置换氢气与 、温度、
、温度、 与溶液接触面积有关,在
与溶液接触面积有关,在 溶液中,生成的沉淀能破坏
溶液中,生成的沉淀能破坏 表面覆盖的
表面覆盖的 ,从而较快进行。
,从而较快进行。
编号 | 操作 | 现象 |
Ⅰ | 将镁条放入 | 迅速放出大量气体,试管壁发热 |
Ⅱ | 将镁条放入pH为 | 无明显现象 |
Ⅲ | 将镁条放入pH为 | 放出气体,溶液中有白色沉淀生成 |
(1)实验前除去镁表面氧化物的方法是
(2)实验Ⅰ的离子方程式为
(3)经实验分析,实验Ⅲ中产生的气体为
 和
和 混合气体。产生
混合气体。产生 气体的原因是
气体的原因是(4)该组同学们比较实验Ⅱ、Ⅲ后,分析认为:实验Ⅲ能快速反应的原因,与溶液中白色沉淀有关。为探究其成分,设计了如下实验。
取出镁条,将沉淀过滤、洗涤、低温烘干,得到纯净固体
 。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在
。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在 处通入足量空气。最后称量
处通入足量空气。最后称量 形管增重
形管增重 。将另一半固体高温灼烧,最后剩余固体氧化物为
。将另一半固体高温灼烧,最后剩余固体氧化物为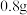 。
。
②固体充分高温灼烧后,需要放在
(5)依据以上分析,实验Ⅲ中发生反应的方程式为
 置换氢气与
置换氢气与 、温度、
、温度、 与溶液接触面积有关,在
与溶液接触面积有关,在 溶液中,生成的沉淀能破坏
溶液中,生成的沉淀能破坏 表面覆盖的
表面覆盖的 ,从而较快进行。
,从而较快进行。
您最近一年使用:0次
名校
4 . 铋酸钠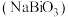 是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,
是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,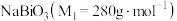 为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;
为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;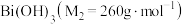 为白色固体,难溶于水。根据实验回答下列问题:
为白色固体,难溶于水。根据实验回答下列问题:_______ 。
(2)装置C中发生反应的离子方程式为_______ 。
(3)装置B的作用为_______ 。
(4)反应结束后,为从装置C中获得尽可能多的产品的操作是_______ 、过滤、洗涤、干燥。
(5) 在酸性介质中可用于
在酸性介质中可用于 的鉴定,已知
的鉴定,已知 被还原为
被还原为 ,其中氧化剂与还原剂的物质的量之比为
,其中氧化剂与还原剂的物质的量之比为_______ 。
(6)取上述 样品
样品 ,加入稀硫酸和
,加入稀硫酸和 溶液使其完全溶解,稀释至
溶液使其完全溶解,稀释至 ,取出
,取出 溶液,然后用新配制的
溶液,然后用新配制的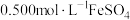 溶液进行滴定,滴定终点的颜色变化为
溶液进行滴定,滴定终点的颜色变化为_______ ,假设终点时消耗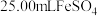 溶液。则该样品中
溶液。则该样品中 纯度为
纯度为_______ %(结果保留小数点后一位)。
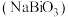 是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,
是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,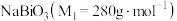 为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;
为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;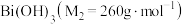 为白色固体,难溶于水。根据实验回答下列问题:
为白色固体,难溶于水。根据实验回答下列问题: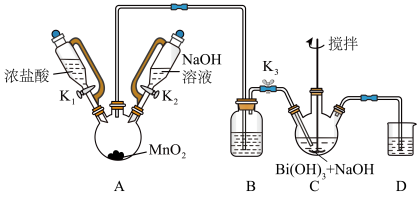
(2)装置C中发生反应的离子方程式为
(3)装置B的作用为
(4)反应结束后,为从装置C中获得尽可能多的产品的操作是
(5)
 在酸性介质中可用于
在酸性介质中可用于 的鉴定,已知
的鉴定,已知 被还原为
被还原为 ,其中氧化剂与还原剂的物质的量之比为
,其中氧化剂与还原剂的物质的量之比为(6)取上述
 样品
样品 ,加入稀硫酸和
,加入稀硫酸和 溶液使其完全溶解,稀释至
溶液使其完全溶解,稀释至 ,取出
,取出 溶液,然后用新配制的
溶液,然后用新配制的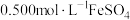 溶液进行滴定,滴定终点的颜色变化为
溶液进行滴定,滴定终点的颜色变化为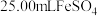 溶液。则该样品中
溶液。则该样品中 纯度为
纯度为
您最近一年使用:0次
名校
解题方法
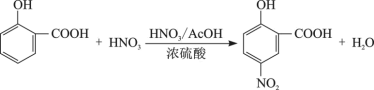
5 . 5-硝基水杨酸具有抑制炎症和治疗溃疡性结肠炎的作用,可由水杨酸通过硝化反应制备,其反应为:
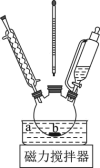
Ⅰ、产品合成:将水杨酸13.8g(0.1mol)和水(15mL)加入下图反应装置中,在搅拌下缓缓滴加68%硝酸(18mL)和浓硫酸(1.8mL)组成的混酸液。逐渐升温至70-80℃,并在此温度下保温回流2h。
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为__________(填标号)。
(2)在70-80℃反应时温度计水银球置于__________ (填“a”或“b”)处。
(3)硝化步骤中制取“混酸液”的具体操作是__________ 。
(4)合成过程中需要防暴沸却不需要额外添加沸石的原因是______________________________ 。
(5)“操作1”的名称是__________ 。
(6)5-硝基水杨酸的产率为__________ (保留三位有效数字)。
(7)硝化反应是硝酸在浓硫酸作用下,硝酸质子化后失水,产生硝酰正离子( ),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。
),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。
已知:羧基是吸电子基团,羟基是推电子基团。
则水杨酸中有助于发生硝化反应的基团是____________________ 。
名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度 | 溶解性 |
水杨酸 | 138 | 158-161 | 336.3 | 1.375 | 微溶于冷水,易溶于热水、乙醇、乙醚和丙酮 |
5-硝基水杨酸 | 183 | 229-233 | 399.1 | 1.6 | 不溶于冷水,微溶于热水,易溶于乙醇、乙醚 |
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为__________(填标号)。
| A.100mL | B.250mL | C.500mL | D.1000mL |
(3)硝化步骤中制取“混酸液”的具体操作是
(4)合成过程中需要防暴沸却不需要额外添加沸石的原因是
(5)“操作1”的名称是
(6)5-硝基水杨酸的产率为
(7)硝化反应是硝酸在浓硫酸作用下,硝酸质子化后失水,产生硝酰正离子(
 ),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。
),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。已知:羧基是吸电子基团,羟基是推电子基团。
则水杨酸中有助于发生硝化反应的基团是
您最近一年使用:0次
名校
6 . 锑白(Sb2O3,两性氧化物)可用作白色颜料和阻燃剂。一种制备Sb2O3的实验步骤如下:
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器A中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。
①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水,二者极性都较小。
回答下列问题:
(1)仪器a的名称为___________ ,装置B中的试剂X为___________ 。
(2)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式___________ 。
(3)A中通入氨气需要控制碱性不能太强,原因是___________ 。
(4)如果将乙二醇改为乙醇用上述同样方法制备Sb2O3,往往得到Sb2O3混晶,解释原因___________ 。
(5)取ag产品于锥形瓶中,用盐酸等试剂预处理后,用cmol/L碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为:Sb3++I2=Sb5++2I-。
①滴定终点颜色变化为___________ 。
②产品中Sb元素的质量分数是___________ %。
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器A中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。

①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水,二者极性都较小。
回答下列问题:
(1)仪器a的名称为
(2)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式
(3)A中通入氨气需要控制碱性不能太强,原因是
(4)如果将乙二醇改为乙醇用上述同样方法制备Sb2O3,往往得到Sb2O3混晶,解释原因
(5)取ag产品于锥形瓶中,用盐酸等试剂预处理后,用cmol/L碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为:Sb3++I2=Sb5++2I-。
①滴定终点颜色变化为
②产品中Sb元素的质量分数是
您最近一年使用:0次
名校
解题方法
7 . 检验甲醛用银-Ferrozine法灵敏度较高。测定原理为甲醛与银氨溶液反应生成 ,产生的
,产生的 与
与 定量反应生成
定量反应生成 与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如图装置,测定新装修居室内空气中甲醛的含量(夹持装置略去)。
与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如图装置,测定新装修居室内空气中甲醛的含量(夹持装置略去)。 ;毛细管内径不超过
;毛细管内径不超过 。
。
回答下列问题:
(1)A装置中反应的化学方程式为________ ,用饱和食盐水代替水制备 的原因是
的原因是_________ 。
(2)B中装有硝酸银溶液,仪器B的名称为_______ 。
(3)银氨溶液的制备。关闭 ,打开
,打开 ,打开
,打开______ ,使饱和食盐水慢慢滴入圆底烧瓶中,当观察到B中______ ,停止通入
(4)室内空气中甲醛含量的测定。
①用热水浴加热B,打开 ,将滑动隔板慢慢由最右端抽到最左端,吸入
,将滑动隔板慢慢由最右端抽到最左端,吸入 室内空气,关闭
室内空气,关闭 ;后续操作是
;后续操作是_______ ;重复上述操作共进行3次。毛细管的作用是___________ 。
②甲醛与银氨溶液反应,甲醛被氧化生成一种正盐,其化学方程式为__________ 。
③向上述B中充分反应后的溶液中加入稀硫酸调节溶液 ,再加入足量
,再加入足量 溶液,充分反应后立即加入菲洛嗪,
溶液,充分反应后立即加入菲洛嗪, 与菲洛嗪形成有色物质,在
与菲洛嗪形成有色物质,在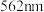 处测定吸光度,测得生成
处测定吸光度,测得生成 ,空气中甲醛的含量为
,空气中甲醛的含量为______ 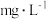 。
。
 ,产生的
,产生的 与
与 定量反应生成
定量反应生成 与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如图装置,测定新装修居室内空气中甲醛的含量(夹持装置略去)。
与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如图装置,测定新装修居室内空气中甲醛的含量(夹持装置略去)。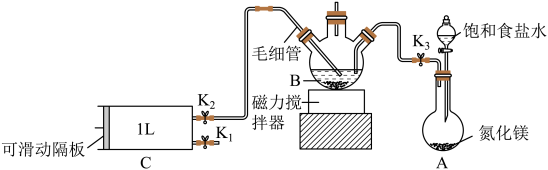
 ;毛细管内径不超过
;毛细管内径不超过 。
。回答下列问题:
(1)A装置中反应的化学方程式为
 的原因是
的原因是(2)B中装有硝酸银溶液,仪器B的名称为
(3)银氨溶液的制备。关闭
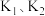 ,打开
,打开 ,打开
,打开
(4)室内空气中甲醛含量的测定。
①用热水浴加热B,打开
 ,将滑动隔板慢慢由最右端抽到最左端,吸入
,将滑动隔板慢慢由最右端抽到最左端,吸入 室内空气,关闭
室内空气,关闭 ;后续操作是
;后续操作是②甲醛与银氨溶液反应,甲醛被氧化生成一种正盐,其化学方程式为
③向上述B中充分反应后的溶液中加入稀硫酸调节溶液
 ,再加入足量
,再加入足量 溶液,充分反应后立即加入菲洛嗪,
溶液,充分反应后立即加入菲洛嗪, 与菲洛嗪形成有色物质,在
与菲洛嗪形成有色物质,在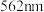 处测定吸光度,测得生成
处测定吸光度,测得生成 ,空气中甲醛的含量为
,空气中甲醛的含量为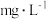 。
。
您最近一年使用:0次
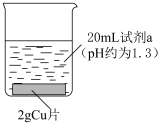
8 . 某研究性学习小组为探究含 的盐溶液与
的盐溶液与 的反应,设计并进行了如下实验。
的反应,设计并进行了如下实验。
已知:ⅰ. 、
、 是难溶于水的白色固体;
是难溶于水的白色固体;
ⅱ.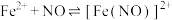 (棕色)。
(棕色)。
(1)Ⅰ、Ⅱ、Ⅲ溶液 均约为1.3,溶液显酸性且
均约为1.3,溶液显酸性且 相近的原因
相近的原因________ 。
(2)小组同学取 实验Ⅰ中反应2天后的溶液于试管中,加入2滴
实验Ⅰ中反应2天后的溶液于试管中,加入2滴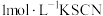 溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中
溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中 可能已反应完,
可能已反应完, 可能在该条件下被
可能在该条件下被 氧化。并通过实验证实了其猜想,其实验方案是:向
氧化。并通过实验证实了其猜想,其实验方案是:向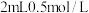
________ (填化学式)和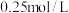
________ 的混合溶液中,加入2滴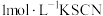 溶液,观察实验现象。该条件下
溶液,观察实验现象。该条件下 能被
能被 氧化的原因可能是
氧化的原因可能是 增强了
增强了 的
的________ 。
(3)实验Ⅱ中 片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体
片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体 的离子方程式为
的离子方程式为________ ,白色固体消失的离子方程式为________ ,由此对比实验Ⅰ和实验Ⅱ,推测 在实验Ⅱ中的作用是
在实验Ⅱ中的作用是________ 。产生大量红褐色沉淀的原因是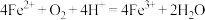 ,导致
,导致 、
、 增大,形成
增大,形成 沉淀。
沉淀。
(4)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了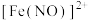 ,设计并实施了以下实验,验证了其猜想。
,设计并实施了以下实验,验证了其猜想。
综合以上实验, 盐溶液与
盐溶液与 反应的多样性与阴离子种类、生成物存在形式等有关。
反应的多样性与阴离子种类、生成物存在形式等有关。
 的盐溶液与
的盐溶液与 的反应,设计并进行了如下实验。
的反应,设计并进行了如下实验。实验装置 | 序号 | 试剂 | 实验现象 |
| Ⅰ | 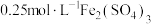 溶液 溶液 | 溶液逐渐变为蓝色。2天后, 片有较大量剩余,溶液仍为蓝色 片有较大量剩余,溶液仍为蓝色 |
Ⅱ | 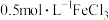 溶液 溶液 | 溶液逐渐变为蓝绿色,铜片表面覆盖有白色固体(经检验为 )。2天后,白色固体消失, )。2天后,白色固体消失, 片无剩余,溶液中产生大量红褐色沉淀 片无剩余,溶液中产生大量红褐色沉淀 | |
Ⅲ | 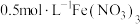 溶液 溶液 | 溶液逐渐变为绿色,实验过程中未见气泡产生。2天后, 片少量剩余,溶液中产生大量红褐色沉淀 片少量剩余,溶液中产生大量红褐色沉淀 |
 、
、 是难溶于水的白色固体;
是难溶于水的白色固体;ⅱ.
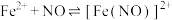 (棕色)。
(棕色)。(1)Ⅰ、Ⅱ、Ⅲ溶液
 均约为1.3,溶液显酸性且
均约为1.3,溶液显酸性且 相近的原因
相近的原因(2)小组同学取
 实验Ⅰ中反应2天后的溶液于试管中,加入2滴
实验Ⅰ中反应2天后的溶液于试管中,加入2滴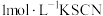 溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中
溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中 可能已反应完,
可能已反应完, 可能在该条件下被
可能在该条件下被 氧化。并通过实验证实了其猜想,其实验方案是:向
氧化。并通过实验证实了其猜想,其实验方案是:向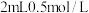
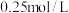
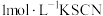 溶液,观察实验现象。该条件下
溶液,观察实验现象。该条件下 能被
能被 氧化的原因可能是
氧化的原因可能是 增强了
增强了 的
的(3)实验Ⅱ中
 片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体
片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体 的离子方程式为
的离子方程式为 在实验Ⅱ中的作用是
在实验Ⅱ中的作用是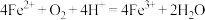 ,导致
,导致 、
、 增大,形成
增大,形成 沉淀。
沉淀。(4)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了
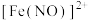 ,设计并实施了以下实验,验证了其猜想。
,设计并实施了以下实验,验证了其猜想。步骤 | 实验操作 | 实验现象 |
① | 向盛有 金属 金属 片的烧杯中加入 片的烧杯中加入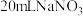 与 与 的混合溶液[ 的混合溶液[ 与约为1.3、 与约为1.3、 ] ] | 2天后溶液颜色无明显变化,铜片表面有细小气泡附着 |
② | 继续加入少量 | 溶液迅速变为浅棕色 |
 盐溶液与
盐溶液与 反应的多样性与阴离子种类、生成物存在形式等有关。
反应的多样性与阴离子种类、生成物存在形式等有关。
您最近一年使用:0次
解题方法
9 . 铜(Ⅱ)氨基酸配合物在医药、食品、农业等领域具有广泛的应用,甘氨酸( ,以HL代表甘氨酸)在约70℃的条件下可与氢氧化铜反应制备二甘氨酸合铜(Ⅱ)水合物,其反应的化学方程式为
,以HL代表甘氨酸)在约70℃的条件下可与氢氧化铜反应制备二甘氨酸合铜(Ⅱ)水合物,其反应的化学方程式为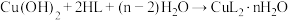 。
。
Ⅰ.氢氧化铜的制备
①向烧杯中加入适量 和20mL水。
和20mL水。
②完全溶解后,边滴加氨水边搅拌至最初产生的沉淀完全溶解。
③加入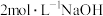 溶液至不再生成沉淀,过滤,用水洗涤。
溶液至不再生成沉淀,过滤,用水洗涤。
(1)步骤②沉淀溶解过程中反应的离子方程式为___________ 。
(2)步骤③中检验沉淀洗涤干净的操作及现象为___________ 。
Ⅱ.二甘氨酸合铜(Ⅱ)水合物的制备
④称取适量甘氨酸,溶于150mL水中。
⑤在65~70℃的条件下加热,边搅拌边加入新制的 ,至
,至 全部溶解。
全部溶解。
⑥热抽滤,向滤液加入10mL无水乙醇。
⑦抽滤,用乙醇溶液洗涤晶体,再用丙酮洗涤,抽干。
⑧将产品烘干。
(3)步骤④中使用的部分仪器如下。仪器a的名称是___________ 。加快甘氨酸溶解的操作为___________ 。___________ 。
(5)步骤⑦中用乙醇溶液洗涤晶体后再用丙酮洗涤的原因为___________ 。
Ⅲ.产品中铜含量的测定
称取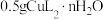 产品,加入水和稀硫酸溶解,配制成250mL溶液。取20.00mL该溶液,加入足量KI固体和50mL水,以淀粉为指示剂,立即用
产品,加入水和稀硫酸溶解,配制成250mL溶液。取20.00mL该溶液,加入足量KI固体和50mL水,以淀粉为指示剂,立即用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液1.60mL。
溶液1.60mL。
已知:在酸性介质中,配合物中的 被质子化,配合物被破坏;
被质子化,配合物被破坏;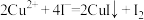 ,
, 。
。
(6)滴定终点溶液颜色的变化为___________ 。
(7)产品中铜元素的质量分数为___________ 。
 ,以HL代表甘氨酸)在约70℃的条件下可与氢氧化铜反应制备二甘氨酸合铜(Ⅱ)水合物,其反应的化学方程式为
,以HL代表甘氨酸)在约70℃的条件下可与氢氧化铜反应制备二甘氨酸合铜(Ⅱ)水合物,其反应的化学方程式为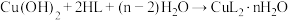 。
。Ⅰ.氢氧化铜的制备
①向烧杯中加入适量
 和20mL水。
和20mL水。②完全溶解后,边滴加氨水边搅拌至最初产生的沉淀完全溶解。
③加入
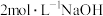 溶液至不再生成沉淀,过滤,用水洗涤。
溶液至不再生成沉淀,过滤,用水洗涤。(1)步骤②沉淀溶解过程中反应的离子方程式为
(2)步骤③中检验沉淀洗涤干净的操作及现象为
Ⅱ.二甘氨酸合铜(Ⅱ)水合物的制备
④称取适量甘氨酸,溶于150mL水中。
⑤在65~70℃的条件下加热,边搅拌边加入新制的
 ,至
,至 全部溶解。
全部溶解。⑥热抽滤,向滤液加入10mL无水乙醇。
⑦抽滤,用乙醇溶液洗涤晶体,再用丙酮洗涤,抽干。
⑧将产品烘干。
(3)步骤④中使用的部分仪器如下。仪器a的名称是
(5)步骤⑦中用乙醇溶液洗涤晶体后再用丙酮洗涤的原因为
Ⅲ.产品中铜含量的测定
称取
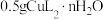 产品,加入水和稀硫酸溶解,配制成250mL溶液。取20.00mL该溶液,加入足量KI固体和50mL水,以淀粉为指示剂,立即用
产品,加入水和稀硫酸溶解,配制成250mL溶液。取20.00mL该溶液,加入足量KI固体和50mL水,以淀粉为指示剂,立即用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液1.60mL。
溶液1.60mL。已知:在酸性介质中,配合物中的
 被质子化,配合物被破坏;
被质子化,配合物被破坏;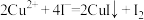 ,
, 。
。(6)滴定终点溶液颜色的变化为
(7)产品中铜元素的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 某小组探究 溶液和
溶液和 溶液的反应。
溶液的反应。
实验Ⅰ:向某浓度的 酸性溶液(过量)中加入
酸性溶液(过量)中加入 溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料: 在酸性溶液氧化
在酸性溶液氧化 ,反应为
,反应为
(1)针对t秒前溶液未变蓝,小组做出如下假设:
ⅰ.t秒前未生成 ,是由于反应的活化能
,是由于反应的活化能_______ (填“大”或“小”),反应速率慢导致的。
ⅱ.t秒前生成了 ,但由于存在
,但由于存在 ,
,____________ (用离子方程式表示), 被消耗。
被消耗。
(2)下述实验证实了假设ⅰ合理。
实验Ⅱ:向实验Ⅰ的蓝色溶液中加入___________ ,蓝色迅速消失,后再次变蓝。
(3)进一步研究 溶液和
溶液和 溶液反应的过程,装置如下。
溶液反应的过程,装置如下。
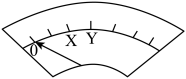
①K闭合后,判断b极区发生氧化反应的实验方案为:__________________ 。
②0~ 时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。由此判断
时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。由此判断 在a极放电的电极反应式是
在a极放电的电极反应式是_________________ 。
③结合化学方程式解释 ~
~ 时指针回到“0”处的原因:
时指针回到“0”处的原因:___________________________ 。
(4)综合实验Ⅰ、Ⅱ、Ⅲ,下列说法正确的是_________ 。
A.对比实验Ⅰ、Ⅱ,t秒后溶液变蓝,Ⅰ中 被完全氧化
被完全氧化
B.对比实验Ⅰ、Ⅲ,t秒前 未发生反应
未发生反应
C.实验Ⅲ中指针返回X处的原因,可能是 氧化
氧化
 溶液和
溶液和 溶液的反应。
溶液的反应。实验Ⅰ:向某浓度的
 酸性溶液(过量)中加入
酸性溶液(过量)中加入 溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。资料:
 在酸性溶液氧化
在酸性溶液氧化 ,反应为
,反应为
(1)针对t秒前溶液未变蓝,小组做出如下假设:
ⅰ.t秒前未生成
 ,是由于反应的活化能
,是由于反应的活化能ⅱ.t秒前生成了
 ,但由于存在
,但由于存在 ,
, 被消耗。
被消耗。(2)下述实验证实了假设ⅰ合理。
实验Ⅱ:向实验Ⅰ的蓝色溶液中加入
(3)进一步研究
 溶液和
溶液和 溶液反应的过程,装置如下。
溶液反应的过程,装置如下。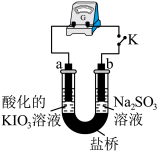
表盘 |
| ||
时间/min | 0~ |
|
|
偏转位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针归零 |
②0~
 时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。由此判断
时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。由此判断 在a极放电的电极反应式是
在a极放电的电极反应式是③结合化学方程式解释
 ~
~ 时指针回到“0”处的原因:
时指针回到“0”处的原因:(4)综合实验Ⅰ、Ⅱ、Ⅲ,下列说法正确的是
A.对比实验Ⅰ、Ⅱ,t秒后溶液变蓝,Ⅰ中
 被完全氧化
被完全氧化B.对比实验Ⅰ、Ⅲ,t秒前
 未发生反应
未发生反应C.实验Ⅲ中指针返回X处的原因,可能是
 氧化
氧化
您最近一年使用:0次

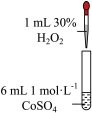

 稀硫酸中
稀硫酸中 的
的 溶液中
溶液中