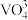真题
解题方法
1 . 铍用于宇航器件的构筑。一种从其铝硅酸盐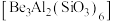 中提取铍的路径为:
中提取铍的路径为: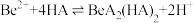
回答下列问题:
(1)基态 的轨道表示式为
的轨道表示式为_______ 。
(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是_______ 。
(3)“萃取分液”的目的是分离 和
和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是_______ 。
(4)写出反萃取生成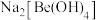 的化学方程式
的化学方程式_______ 。“滤液2”可以进入_______ 步骤再利用。
(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是_______ 。
(6) 与醋酸反应得到某含4个
与醋酸反应得到某含4个 的配合物,4个
的配合物,4个 位于以1个O原子为中心的四面体的4个顶点,且每个
位于以1个O原子为中心的四面体的4个顶点,且每个 的配位环境相同,
的配位环境相同, 与
与 间通过
间通过 相连,其化学式为
相连,其化学式为_______ 。
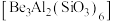 中提取铍的路径为:
中提取铍的路径为: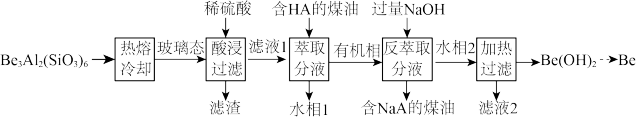
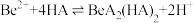
回答下列问题:
(1)基态
 的轨道表示式为
的轨道表示式为(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是
(3)“萃取分液”的目的是分离
 和
和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是(4)写出反萃取生成
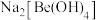 的化学方程式
的化学方程式(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是
(6)
 与醋酸反应得到某含4个
与醋酸反应得到某含4个 的配合物,4个
的配合物,4个 位于以1个O原子为中心的四面体的4个顶点,且每个
位于以1个O原子为中心的四面体的4个顶点,且每个 的配位环境相同,
的配位环境相同, 与
与 间通过
间通过 相连,其化学式为
相连,其化学式为
您最近一年使用:0次
名校
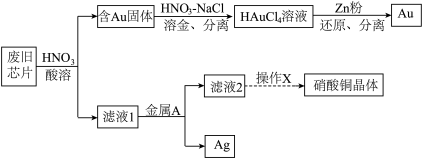
2 . 废旧芯片中常含有大量的单质Si和少量的Au、Ag、Cu等金属。某化学兴趣小组设计了如下图所示方法回收废旧芯片中的Au、Ag并制取硝酸铜晶体[Cu(NO3)2·6H2O]。 。
。
请回答下列问题:
(1)为加快酸溶速率,可采取的两种措施为:_______ 、_______ 。
(2)浓、稀HNO3均可作酸溶试剂,溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量多的反应的化学方程式_______ 。
(3)写出过量的锌粉还原HAuCl4溶液生成金的离子方程式_______ 。
(4)金属A的名称是_______ 。
(5)操作X包括了_______ 过滤、洗涤、晾干。
(6)上述过程产生的NO和NO2等氮氧化物会污染空气,可用如下方法处理:
①氨气催化吸收法:已知1mol氨气恰好能将含NO和NO2共0.9mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比_______ 。
②酸化的Ca(ClO)2溶液吸收法:NO能被氧化成NO 。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是_______ 。
 。
。请回答下列问题:
(1)为加快酸溶速率,可采取的两种措施为:
(2)浓、稀HNO3均可作酸溶试剂,溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量多的反应的化学方程式
(3)写出过量的锌粉还原HAuCl4溶液生成金的离子方程式
(4)金属A的名称是
(5)操作X包括了
(6)上述过程产生的NO和NO2等氮氧化物会污染空气,可用如下方法处理:
①氨气催化吸收法:已知1mol氨气恰好能将含NO和NO2共0.9mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比
②酸化的Ca(ClO)2溶液吸收法:NO能被氧化成NO
 。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是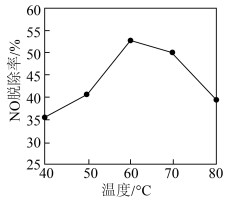
您最近一年使用:0次
名校
3 . 钛被称为“二十一世纪的金属”,绿矾是重要的化工原料,用钛铁矿[主要成分是钛酸亚铁( ),含少量
),含少量 、MgO、
、MgO、 等杂质]作原料生产金属钛和绿矾(
等杂质]作原料生产金属钛和绿矾( )等产品的一种工艺流程如下:
)等产品的一种工艺流程如下:___________ 。
(2)矿渣的主要成分是___________ ;试剂A为___________ (填化学式)。
(3)“操作Ⅱ”为___________ 、___________ 、过滤、洗涤、干燥。
(4)对所得到的绿矾晶体常用75%的乙醇溶液洗涤,用乙醇溶液洗涤绿矾的优点为___________ 。
(5)沸腾氯化中,氯气与矿料逆流而行,目的是___________ ,充分反应后,混合气体中CO与 的分压之比为1∶2,该温度下,
的分压之比为1∶2,该温度下, 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为___________ 。
(6)俄罗斯科学家于20世纪60年代提出了用金属氢化物还原法生产钛粉这一技术构想,并进行了试验研究。俄罗斯图拉化工冶金厂以 为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式
为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式___________ 。
 ),含少量
),含少量 、MgO、
、MgO、 等杂质]作原料生产金属钛和绿矾(
等杂质]作原料生产金属钛和绿矾( )等产品的一种工艺流程如下:
)等产品的一种工艺流程如下: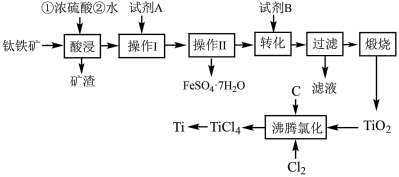
(2)矿渣的主要成分是
(3)“操作Ⅱ”为
(4)对所得到的绿矾晶体常用75%的乙醇溶液洗涤,用乙醇溶液洗涤绿矾的优点为
(5)沸腾氯化中,氯气与矿料逆流而行,目的是
 的分压之比为1∶2,该温度下,
的分压之比为1∶2,该温度下, 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为(6)俄罗斯科学家于20世纪60年代提出了用金属氢化物还原法生产钛粉这一技术构想,并进行了试验研究。俄罗斯图拉化工冶金厂以
 为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式
为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式
您最近一年使用:0次
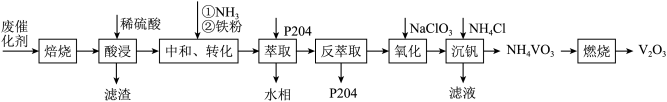
4 . 某石油炼化厂废弃的 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
: 、
、 。
。
②不同pH下,五价钒在溶液中的主要存在形式见下表:
③萃取剂P204对 、
、 具有高选择性。
具有高选择性。
④25℃时,


回答下列问题:
(1)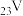 位于元素周期表的第
位于元素周期表的第__________ 周期、第__________ 族。
(2)“中和、转化”时,铁粉的作用除将 还原为
还原为 外,还有
外,还有__________ ;“氧化”时发生反应的离子方程式为______________________________ 。
(3)除萃取剂P204外,流程中可循环使用的物质还有____________________ 。
(4)“沉钒”时需加入过量 ,原因是
,原因是______________________________ ;25℃时,测得“氧化”后滤液中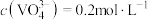 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中 至少为
至少为__________  。
。
(5)“萃取”后的水相经三道工序可回收 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整__________ 。(可供选用的试剂:铁粉、稀硫酸、 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
:
 、
、 。
。②不同pH下,五价钒在溶液中的主要存在形式见下表:
| 4-6 | 6-8 | 8-10 | 10-12 |
主要离子 |
|
|
|
|
 、
、 具有高选择性。
具有高选择性。④25℃时,

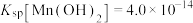


回答下列问题:
(1)
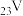 位于元素周期表的第
位于元素周期表的第(2)“中和、转化”时,铁粉的作用除将
 还原为
还原为 外,还有
外,还有(3)除萃取剂P204外,流程中可循环使用的物质还有
(4)“沉钒”时需加入过量
 ,原因是
,原因是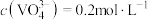 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中 至少为
至少为 。
。(5)“萃取”后的水相经三道工序可回收
 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。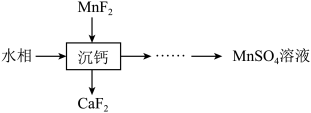
您最近一年使用:0次
名校
解题方法
5 . 材料是经济增长与社会发展的重要物质基础,请回答下列问题。
(1)硅是重要的半导体材料,广泛应用于电子产品领域,工业上以硅石 为原料制备冶金级高纯硅的工艺流程如图所示:
为原料制备冶金级高纯硅的工艺流程如图所示: 室温下为易挥发、易水解的无色液体。
室温下为易挥发、易水解的无色液体。
①写出上述过程中氧化过程的化学方程式:___________ ;
② 极易水解且生成某种可燃性气体,写出化学反应方程式:
极易水解且生成某种可燃性气体,写出化学反应方程式:___________ ;
③上述工艺生产中需要在无水、无氧的条件下进行的操作有:___________ 。
(2)某MOFs多孔材料能高选择性吸附 ,其孔径大小和形状恰好将
,其孔径大小和形状恰好将 “固定”。废气中的
“固定”。废气中的 被吸附后,经处理能全部转化为
被吸附后,经处理能全部转化为 。原理示意图如下。
。原理示意图如下。
①写出反应中转化为 的化学反应方程式
的化学反应方程式___________ ;
②每生成 时,氧化剂与还原剂的物质的量之比为
时,氧化剂与还原剂的物质的量之比为___________ 。
(3)甲醇是重要的化工原料之一,其制备和用途研究一直是化学工业热门研究方向。
工业上利用 和
和 合成甲醇,反应方程式为
合成甲醇,反应方程式为 ,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入
,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入 和
和 进行上述反应,测得
进行上述反应,测得 和
和 浓度随时间变化如图所示。
浓度随时间变化如图所示。 和
和 充分反应后,放出的能量
充分反应后,放出的能量___________ (填“>”“<”或“=”)89kJ;
②从0到10min,
___________ ;
③达到平衡时 的体积分数
的体积分数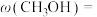
___________ 。
(1)硅是重要的半导体材料,广泛应用于电子产品领域,工业上以硅石
 为原料制备冶金级高纯硅的工艺流程如图所示:
为原料制备冶金级高纯硅的工艺流程如图所示: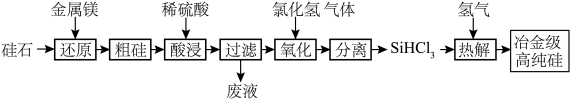
 室温下为易挥发、易水解的无色液体。
室温下为易挥发、易水解的无色液体。①写出上述过程中氧化过程的化学方程式:
②
 极易水解且生成某种可燃性气体,写出化学反应方程式:
极易水解且生成某种可燃性气体,写出化学反应方程式:③上述工艺生产中需要在无水、无氧的条件下进行的操作有:
(2)某MOFs多孔材料能高选择性吸附
 ,其孔径大小和形状恰好将
,其孔径大小和形状恰好将 “固定”。废气中的
“固定”。废气中的 被吸附后,经处理能全部转化为
被吸附后,经处理能全部转化为 。原理示意图如下。
。原理示意图如下。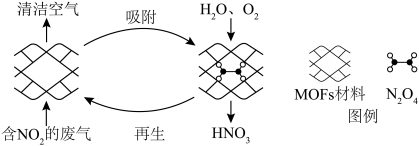

①写出反应中转化为
 的化学反应方程式
的化学反应方程式②每生成
 时,氧化剂与还原剂的物质的量之比为
时,氧化剂与还原剂的物质的量之比为(3)甲醇是重要的化工原料之一,其制备和用途研究一直是化学工业热门研究方向。
工业上利用
 和
和 合成甲醇,反应方程式为
合成甲醇,反应方程式为 ,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入
,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入 和
和 进行上述反应,测得
进行上述反应,测得 和
和 浓度随时间变化如图所示。
浓度随时间变化如图所示。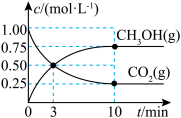
 和
和 充分反应后,放出的能量
充分反应后,放出的能量②从0到10min,

③达到平衡时
 的体积分数
的体积分数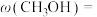
您最近一年使用:0次
名校
解题方法
6 . 碲(Te)常用于冶金工业,也是石油裂解的催化剂。工业上常以碲铜废料(主要成分是 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下: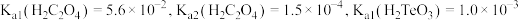 ,
,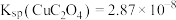 。
。
(1) 中碲元素的化合价为
中碲元素的化合价为_______ 。碲在元素周期表中的位置为_______ 。
(2)“氧化酸浸”得到 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)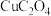 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为_______ 。(保留两位有效数字){已知:反应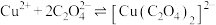 的平衡常数
的平衡常数 }
}
(4)“还原”在 50 ℃条件下进行: ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为_______ 。
(5)“还原”时, 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有_______ 。
(6)将一定质量的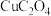 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为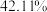 ,则剩余固体的化学式为
,则剩余固体的化学式为_______ 。
 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下:
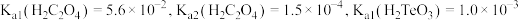 ,
,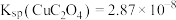 。
。(1)
 中碲元素的化合价为
中碲元素的化合价为(2)“氧化酸浸”得到
 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(3)
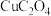 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为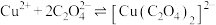 的平衡常数
的平衡常数 }
}(4)“还原”在 50 ℃条件下进行:
 ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为(5)“还原”时,
 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有(6)将一定质量的
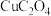 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为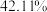 ,则剩余固体的化学式为
,则剩余固体的化学式为
您最近一年使用:0次
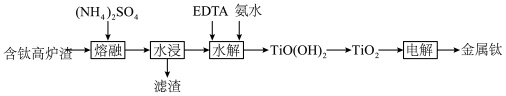
7 . 从“钛磁铁矿”冶炼金属铁后的“含钛高炉渣”中提取金属钛的工艺流程如下:
②“水浸”溶液的 。
。
请回答下列问题:
(1)“熔融”时,为了使反应物充分受热融化反应,可以采取的措施有___________ 。
(2)某实验小组模拟“熔融”过程的反应,将固体 与
与 按物质的量1:2混合反应生成
按物质的量1:2混合反应生成 反应过程的热重曲线如图所示。
反应过程的热重曲线如图所示。 的方程式为
的方程式为___________ 。
②“水浸”后滤渣主要有___________ 。
(3)整合剂EDTA(乙二胺四乙酸三钠, )能够与金属阳离子按1:1反应形成非常稳定的整合物(
)能够与金属阳离子按1:1反应形成非常稳定的整合物(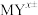 )。已知
)。已知 ,
,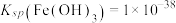
①“水解”步骤加入EDTA的目的是___________ 。
②常温下,某溶液中 和Fe3+浓度均为:
和Fe3+浓度均为: 的溶液中,用氨水调pH至4时溶液中的
的溶液中,用氨水调pH至4时溶液中的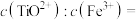
___________ 。
(4)一种 晶体结构如图(黑球表示
晶体结构如图(黑球表示 ,白球表示
,白球表示 ),其熔点为1850℃。
),其熔点为1850℃。 的配位数为
的配位数为___________ 。
②“电解”时,以覆盖氮化硼的石墨电极为阳极,电解 的共熔物得到金属钛,
的共熔物得到金属钛,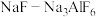 的作用是
的作用是___________ 。
| 组分 |  |  |  |  |  |  | 其他 |
| 质量分数% | 34 | 6~16 | 17~19 | 14~16 | 8.0~9.0 | 3.0~4.2 | 0.8 |
 。
。请回答下列问题:
(1)“熔融”时,为了使反应物充分受热融化反应,可以采取的措施有
(2)某实验小组模拟“熔融”过程的反应,将固体
 与
与 按物质的量1:2混合反应生成
按物质的量1:2混合反应生成 反应过程的热重曲线如图所示。
反应过程的热重曲线如图所示。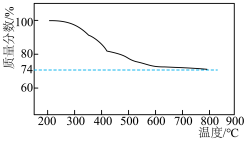
 的方程式为
的方程式为②“水浸”后滤渣主要有
(3)整合剂EDTA(乙二胺四乙酸三钠,
 )能够与金属阳离子按1:1反应形成非常稳定的整合物(
)能够与金属阳离子按1:1反应形成非常稳定的整合物(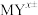 )。已知
)。已知 ,
,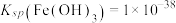
①“水解”步骤加入EDTA的目的是
②常温下,某溶液中
 和Fe3+浓度均为:
和Fe3+浓度均为: 的溶液中,用氨水调pH至4时溶液中的
的溶液中,用氨水调pH至4时溶液中的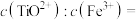
(4)一种
 晶体结构如图(黑球表示
晶体结构如图(黑球表示 ,白球表示
,白球表示 ),其熔点为1850℃。
),其熔点为1850℃。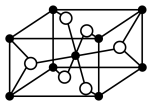
 的配位数为
的配位数为②“电解”时,以覆盖氮化硼的石墨电极为阳极,电解
 的共熔物得到金属钛,
的共熔物得到金属钛,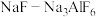 的作用是
的作用是
您最近一年使用:0次
8 . 磷锂铝石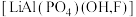 是一种含锂、铝的氟磷酸盐,常含
是一种含锂、铝的氟磷酸盐,常含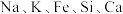 等元素,是含锂较高的工业矿物之一。以磷锂铝石为原料制备锂离子动力电池正极材料
等元素,是含锂较高的工业矿物之一。以磷锂铝石为原料制备锂离子动力电池正极材料 的工艺流程如图所示:
的工艺流程如图所示:
(1)滤渣1的成分为 和
和__________ (填化学式)。
(2)“氧化”的目的是____________________ (语言叙述),滤渣2的成分为__________ 。
(3) 的溶解度曲线如图所示。图中a、b对应温度下
的溶解度曲线如图所示。图中a、b对应温度下 的溶度积之比
的溶度积之比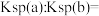
__________ ,“沉锂”时,控制温度为 ,饱和
,饱和 的浓度约为
的浓度约为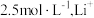
_________ (填“可能”或“不可能”)沉淀完全。[ 饱和溶液的密度近似为
饱和溶液的密度近似为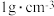 ,
,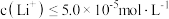 认为沉淀完全]。
认为沉淀完全]。 ,测得
,测得 沉淀率随温度升高而增加,其原因是
沉淀率随温度升高而增加,其原因是_________ (任写一条即可)。
(5)“沉锂”后分离得到 的操作是蒸发结晶、
的操作是蒸发结晶、________ 、洗涤、干燥。
(6)“合成”在高温下进行,写出该反应的化学方程式:__________ (葡萄糖→ )。
)。
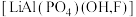 是一种含锂、铝的氟磷酸盐,常含
是一种含锂、铝的氟磷酸盐,常含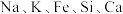 等元素,是含锂较高的工业矿物之一。以磷锂铝石为原料制备锂离子动力电池正极材料
等元素,是含锂较高的工业矿物之一。以磷锂铝石为原料制备锂离子动力电池正极材料 的工艺流程如图所示:
的工艺流程如图所示: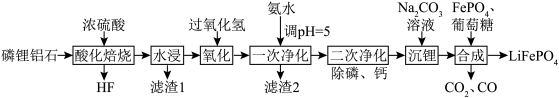
(1)滤渣1的成分为
 和
和(2)“氧化”的目的是
(3)
 的溶解度曲线如图所示。图中a、b对应温度下
的溶解度曲线如图所示。图中a、b对应温度下 的溶度积之比
的溶度积之比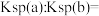
 ,饱和
,饱和 的浓度约为
的浓度约为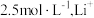
 饱和溶液的密度近似为
饱和溶液的密度近似为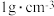 ,
,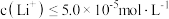 认为沉淀完全]。
认为沉淀完全]。
 ,测得
,测得 沉淀率随温度升高而增加,其原因是
沉淀率随温度升高而增加,其原因是(5)“沉锂”后分离得到
 的操作是蒸发结晶、
的操作是蒸发结晶、(6)“合成”在高温下进行,写出该反应的化学方程式:
 )。
)。
您最近一年使用:0次
9 . 锌是一种应用广泛的金属。以闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS杂质)为原料,制备金属锌的流程如图所示:
(1)“焙烧”过程产生大量的SO2,可用氨水吸收再氧化得到一种氮肥,该氮肥的主要成分为___________ 。
(2)①用稀硫酸完全溶浸后,过滤所得滤渣1的主要成分为___________ 。滤渣1、滤渣2、滤渣3均需洗涤,证明三种滤渣洗涤干净的共同方法是___________ 。
②常温下,有关金属离子沉淀的pH如下表所示(当离子浓度小于1.0×10-5mol/L时认为沉淀完全)。
“氧化除杂”中调pH的范围是___________ 。
(3)“还原除杂”中反应的离子方程式为___________ 。
(4)“还原除杂”后的滤液经操作___________ 、过滤,洗涤,干燥,可得ZnSO4·7H2O晶体。
(5)用惰性电极电解硫酸锌溶液,如阴极生成10molZn,理论上阳极产物的物质的量为___________ mol。电解后的电解液可返回___________ 工序继续使用。

(1)“焙烧”过程产生大量的SO2,可用氨水吸收再氧化得到一种氮肥,该氮肥的主要成分为
(2)①用稀硫酸完全溶浸后,过滤所得滤渣1的主要成分为
②常温下,有关金属离子沉淀的pH如下表所示(当离子浓度小于1.0×10-5mol/L时认为沉淀完全)。
| Fe3+ | Zn2+ | Cd2+ | |
| 开始沉淀pH | 2.3 | 6.2 | 7.4 |
| 沉淀完全pH | 3.3 | 8.7 | 9.4 |
(3)“还原除杂”中反应的离子方程式为
(4)“还原除杂”后的滤液经操作
(5)用惰性电极电解硫酸锌溶液,如阴极生成10molZn,理论上阳极产物的物质的量为
您最近一年使用:0次
名校
10 . 废旧电池镍钴锰酸锂三元正极材料的主要成分为 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。 (
( 或
或 )的萃取原理:
)的萃取原理: 。
。
回答下列问题:
(1)“高温氢化”时 不参与反应,固体产物为
不参与反应,固体产物为 、
、 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为________ ,实际生产中少量的 与空气接触会转化为
与空气接触会转化为________ ,所以为降低锂在固体残余物中的含量应用 “酸洗”。
“酸洗”。
(2)若“洗液”中 ,加入
,加入 固体后,为使沉淀
固体后,为使沉淀 中
中 元素含量不小于
元素含量不小于 元素总量的95%,则
元素总量的95%,则 “洗液”中至少需要加入
“洗液”中至少需要加入 的物质的量为
的物质的量为________  [忽略溶液体积变化,
[忽略溶液体积变化, ]。
]。
(3)“沉锰”过程中 对金属沉淀率的影响如图所示。
对金属沉淀率的影响如图所示。 的离子方程式为
的离子方程式为________________ 。
②该工艺条件下, 开始沉淀的
开始沉淀的 为2,
为2, 开始沉淀的
开始沉淀的 为3。“沉锰”过程中应选择的最佳
为3。“沉锰”过程中应选择的最佳 为
为________ , 时,有少量钴、镍析出,可能的原因是
时,有少量钴、镍析出,可能的原因是________ 。
(4)“反萃取”的目的是将有机层中 、
、 转移到水层,为使
转移到水层,为使 、
、 尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有
尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有________ 。
 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。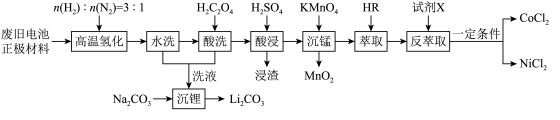
 (
( 或
或 )的萃取原理:
)的萃取原理: 。
。回答下列问题:
(1)“高温氢化”时
 不参与反应,固体产物为
不参与反应,固体产物为 、
、 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为 与空气接触会转化为
与空气接触会转化为 “酸洗”。
“酸洗”。(2)若“洗液”中
 ,加入
,加入 固体后,为使沉淀
固体后,为使沉淀 中
中 元素含量不小于
元素含量不小于 元素总量的95%,则
元素总量的95%,则 “洗液”中至少需要加入
“洗液”中至少需要加入 的物质的量为
的物质的量为 [忽略溶液体积变化,
[忽略溶液体积变化, ]。
]。(3)“沉锰”过程中
 对金属沉淀率的影响如图所示。
对金属沉淀率的影响如图所示。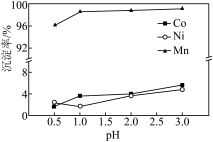
 的离子方程式为
的离子方程式为②该工艺条件下,
 开始沉淀的
开始沉淀的 为2,
为2, 开始沉淀的
开始沉淀的 为3。“沉锰”过程中应选择的最佳
为3。“沉锰”过程中应选择的最佳 为
为 时,有少量钴、镍析出,可能的原因是
时,有少量钴、镍析出,可能的原因是(4)“反萃取”的目的是将有机层中
 、
、 转移到水层,为使
转移到水层,为使 、
、 尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有
尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有
您最近一年使用:0次