1 . 杂环化合物数量巨大、种类丰富、性能多样、应用广泛。
(1)由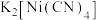 、
、 和吡嗪(
和吡嗪( 可用pyz表示)反应制得晶体,其化学式为
可用pyz表示)反应制得晶体,其化学式为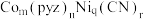 ,四方晶胞结构如图所示。基态Co原子的简化电子排布式为
,四方晶胞结构如图所示。基态Co原子的简化电子排布式为_______ ,C、N、O的第二电离能由大到小顺序为_______ ,晶体中 与
与 的配位数之比为
的配位数之比为_______ ,上述制得晶体的化学方程式为_______ 。 )分子中存在
)分子中存在 离域
离域 键,氮原子的杂化方式
键,氮原子的杂化方式_______ ;吡嗪的熔点_______ (填“大于”、“等于”、“小于”)哒嗪( );哒嗪在水中的溶解度大于苯的原因
);哒嗪在水中的溶解度大于苯的原因_______ 。
(3)休克尔规则可用于判断共轭结构的环状有机化合物是否有芳香性。若参与构成共轭 键电子的个数为
键电子的个数为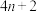 ,其中n为自然数,则此化合物就具有芳香性。下列物质中C、N、O均采用
,其中n为自然数,则此化合物就具有芳香性。下列物质中C、N、O均采用 杂化,其中具有芳香性的是
杂化,其中具有芳香性的是_______ 。
(1)由
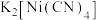 、
、 和吡嗪(
和吡嗪( 可用pyz表示)反应制得晶体,其化学式为
可用pyz表示)反应制得晶体,其化学式为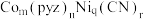 ,四方晶胞结构如图所示。基态Co原子的简化电子排布式为
,四方晶胞结构如图所示。基态Co原子的简化电子排布式为 与
与 的配位数之比为
的配位数之比为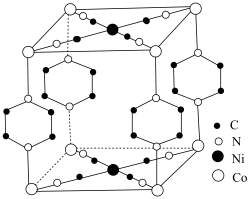
 )分子中存在
)分子中存在 离域
离域 键,氮原子的杂化方式
键,氮原子的杂化方式 );哒嗪在水中的溶解度大于苯的原因
);哒嗪在水中的溶解度大于苯的原因(3)休克尔规则可用于判断共轭结构的环状有机化合物是否有芳香性。若参与构成共轭
 键电子的个数为
键电子的个数为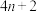 ,其中n为自然数,则此化合物就具有芳香性。下列物质中C、N、O均采用
,其中n为自然数,则此化合物就具有芳香性。下列物质中C、N、O均采用 杂化,其中具有芳香性的是
杂化,其中具有芳香性的是a.  b.
b.  c.
c.  d.
d.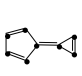
您最近一年使用:0次
名校
解题方法
2 . 配合物在生产、生活中应用广泛。例如, (铁氰化钾)用于检验
(铁氰化钾)用于检验 ,
, 用于检验
用于检验 。回答下列问题:
。回答下列问题:
(1)基态 的价层电子排布式为
的价层电子排布式为___________ ,向某未知溶液中滴加适量 溶液,若
溶液,若___________ (填实验现象),则说明溶液中含有 。
。
(2) 中配位原子是
中配位原子是___________ (填元素符号)。
(3)已知:络合平衡反应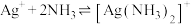 ,其平衡常数又称配离子稳定常数,
,其平衡常数又称配离子稳定常数,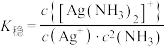 。常温下,
。常温下,
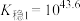 ;
;
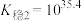 。
。
由此推知稳定性:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是___________ 。
(4)分裂能( )定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能(
)定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能( ):
):
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是___________ 。
 (铁氰化钾)用于检验
(铁氰化钾)用于检验 ,
, 用于检验
用于检验 。回答下列问题:
。回答下列问题:(1)基态
 的价层电子排布式为
的价层电子排布式为 溶液,若
溶液,若 。
。(2)
 中配位原子是
中配位原子是(3)已知:络合平衡反应
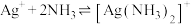 ,其平衡常数又称配离子稳定常数,
,其平衡常数又称配离子稳定常数,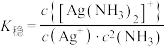 。常温下,
。常温下,
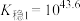 ;
;
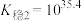 。
。由此推知稳定性:

 (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是(4)分裂能(
 )定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能(
)定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能( ):
):
 (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是
您最近一年使用:0次
解题方法
3 . 近年来,科学家们对高压下富氢化物高温超导体研究方兴未艾。科学家利用氨硼烷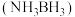 为氢源合成了多种具有高温超导性的富氢化物如
为氢源合成了多种具有高温超导性的富氢化物如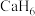 、
、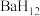 、
、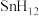 。回答下列问题:
。回答下列问题:
(1)氨硼烷中,元素的电负性:B_______ N(填“>”或“<”),上述6种元素中,位于元素周期表p区的是_______ 。
(2)基态Sn原子的价电子排布图为_______ , 的熔点(963℃)远高于
的熔点(963℃)远高于 (
(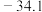 ℃),原因是
℃),原因是_______ 。
(3)乙硼烷与氨硼烷组成相似,但分子结构不同,其成键情况如图所示,每个B原子均以 杂化轨道成键,水平面上下是两个3中心2电子“氢桥键”。
杂化轨道成键,水平面上下是两个3中心2电子“氢桥键”。_______ (填标号)。
a.N-B键为配位键,可自由旋转
b.氢桥键为非极性键,不能自由旋转
c.乙硼烷分子中既有 键,又有
键,又有 键
键
d.氨硼烷为极性分子,熔点比乙硼烷高
②乙硼烷水解释放 ,生成
,生成 。
。 具有层状结构,与
具有层状结构,与 溶液反应生成
溶液反应生成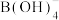 。
。 和
和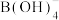 中B的轨道杂化类型分别为
中B的轨道杂化类型分别为_______ 和_______ 。
(4)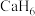 是第一个理论预测具有独特的“氢笼”结构的富氢化物。
是第一个理论预测具有独特的“氢笼”结构的富氢化物。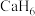 属于立方晶系,晶胞结构及原子投影位置如图所示:
属于立方晶系,晶胞结构及原子投影位置如图所示: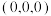 ;b处H为
;b处H为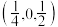 。则Ca的配位数为
。则Ca的配位数为_______ ,H原子之间最短距离为_______ pm(列出计算式),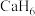 单位体积含氢质量的计算式为
单位体积含氢质量的计算式为_______  (阿伏加德罗常数的值为
(阿伏加德罗常数的值为 )。
)。
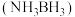 为氢源合成了多种具有高温超导性的富氢化物如
为氢源合成了多种具有高温超导性的富氢化物如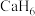 、
、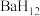 、
、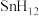 。回答下列问题:
。回答下列问题:(1)氨硼烷中,元素的电负性:B
(2)基态Sn原子的价电子排布图为
 的熔点(963℃)远高于
的熔点(963℃)远高于 (
(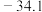 ℃),原因是
℃),原因是(3)乙硼烷与氨硼烷组成相似,但分子结构不同,其成键情况如图所示,每个B原子均以
 杂化轨道成键,水平面上下是两个3中心2电子“氢桥键”。
杂化轨道成键,水平面上下是两个3中心2电子“氢桥键”。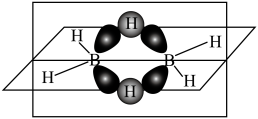
a.N-B键为配位键,可自由旋转
b.氢桥键为非极性键,不能自由旋转
c.乙硼烷分子中既有
 键,又有
键,又有 键
键 d.氨硼烷为极性分子,熔点比乙硼烷高
②乙硼烷水解释放
 ,生成
,生成 。
。 具有层状结构,与
具有层状结构,与 溶液反应生成
溶液反应生成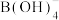 。
。 和
和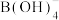 中B的轨道杂化类型分别为
中B的轨道杂化类型分别为(4)
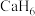 是第一个理论预测具有独特的“氢笼”结构的富氢化物。
是第一个理论预测具有独特的“氢笼”结构的富氢化物。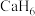 属于立方晶系,晶胞结构及原子投影位置如图所示:
属于立方晶系,晶胞结构及原子投影位置如图所示: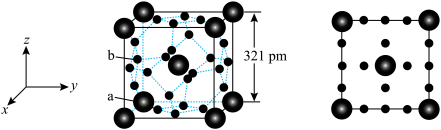
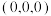 ;b处H为
;b处H为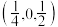 。则Ca的配位数为
。则Ca的配位数为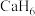 单位体积含氢质量的计算式为
单位体积含氢质量的计算式为 (阿伏加德罗常数的值为
(阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
4 . 金属及其化合物广泛应用于生产、生活等多个领域。回答下列问题:
(1)基态 原子的价层电子的电子排布图为
原子的价层电子的电子排布图为_______ , 中三种元素的第一电离能由大到小的顺序是
中三种元素的第一电离能由大到小的顺序是_______ (填元素符号)。 是强还原剂,
是强还原剂, 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为_______ 。
(2)独立的 分子中,
分子中, 键角为
键角为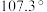 ,如图是
,如图是 离子的部分结构以及其中
离子的部分结构以及其中 键角。请解释
键角。请解释 离子中
离子中 键角变为
键角变为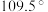 的原因是
的原因是_______ 。_______ (填序号)。
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水,原因可能是_______ 。
(4) 晶体中,
晶体中, 的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O围成的正四面体空隙和如3、6、7、8、9、12的
的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O围成的正四面体空隙和如3、6、7、8、9、12的 围成的正八面体空隙。
围成的正八面体空隙。 中有一半的
中有一半的 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半 和
和 填充在正八面体空隙中,则
填充在正八面体空隙中,则 晶体中有
晶体中有_______  的正八面体空隙填充阳离子。
的正八面体空隙填充阳离子。 晶胞的八分之一是图示结构单元,晶体密度为
晶胞的八分之一是图示结构单元,晶体密度为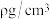 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞参数a=
,则该晶胞参数a=_______ pm。(写出表达式)
(1)基态
 原子的价层电子的电子排布图为
原子的价层电子的电子排布图为 中三种元素的第一电离能由大到小的顺序是
中三种元素的第一电离能由大到小的顺序是 是强还原剂,
是强还原剂, 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为(2)独立的
 分子中,
分子中, 键角为
键角为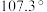 ,如图是
,如图是 离子的部分结构以及其中
离子的部分结构以及其中 键角。请解释
键角。请解释 离子中
离子中 键角变为
键角变为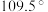 的原因是
的原因是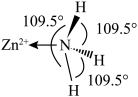

a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水,原因可能是
(4)
 晶体中,
晶体中, 的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O围成的正四面体空隙和如3、6、7、8、9、12的
的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O围成的正四面体空隙和如3、6、7、8、9、12的 围成的正八面体空隙。
围成的正八面体空隙。 中有一半的
中有一半的 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半 和
和 填充在正八面体空隙中,则
填充在正八面体空隙中,则 晶体中有
晶体中有 的正八面体空隙填充阳离子。
的正八面体空隙填充阳离子。 晶胞的八分之一是图示结构单元,晶体密度为
晶胞的八分之一是图示结构单元,晶体密度为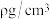 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞参数a=
,则该晶胞参数a=
您最近一年使用:0次
名校
解题方法
5 . 含N化合物种类繁多,应用广泛。请回答:
(1)已知 为平面结构,存在顺反异构,25℃时在水中溶解度分别为
为平面结构,存在顺反异构,25℃时在水中溶解度分别为 和
和 ,请画出水中溶解度为
,请画出水中溶解度为 的空间结构
的空间结构___________ 。
(2)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。 ,则立方氮化硼晶体密度为
,则立方氮化硼晶体密度为___________  (阿伏加德罗常数的值为
(阿伏加德罗常数的值为 ,结果要求化简)。
,结果要求化简)。
(3)向盛有硫酸铜溶液的试管中滴加氨水,生成蓝色难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。(已知将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质)
①下列对此现象的说法正确的是___________ 。
A.反应后溶液中不存在任何沉淀,所以反应前后 的浓度不变
的浓度不变
B.沉淀溶解后,生成深蓝色的配离子
C. 具有顺磁性,而
具有顺磁性,而 无顺磁性
无顺磁性
D.向反应后的溶液中加入乙醇,溶液没有发生变化,因为 不会与乙醇发生反应
不会与乙醇发生反应
② 其实为
其实为 的简略写法,该配离子的空间结构为狭长八面体,如图:
的简略写法,该配离子的空间结构为狭长八面体,如图:___________ 。
A.中心原子的杂化方式相同 B.分子a比分子b键角大
C.分子的热稳定性a弱于b D.配体结合中心离子的能力a弱于b
(4)高能电子流轰击 分子,通过质谱仪发现存在质荷比数值为30的离子峰,该峰对应的微粒化学式是
分子,通过质谱仪发现存在质荷比数值为30的离子峰,该峰对应的微粒化学式是___________ (已知各产物微粒均带1个单位正电荷)。
(1)已知
 为平面结构,存在顺反异构,25℃时在水中溶解度分别为
为平面结构,存在顺反异构,25℃时在水中溶解度分别为 和
和 ,请画出水中溶解度为
,请画出水中溶解度为 的空间结构
的空间结构(2)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。

 ,则立方氮化硼晶体密度为
,则立方氮化硼晶体密度为 (阿伏加德罗常数的值为
(阿伏加德罗常数的值为 ,结果要求化简)。
,结果要求化简)。(3)向盛有硫酸铜溶液的试管中滴加氨水,生成蓝色难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。(已知将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质)
①下列对此现象的说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后
 的浓度不变
的浓度不变B.沉淀溶解后,生成深蓝色的配离子

C.
 具有顺磁性,而
具有顺磁性,而 无顺磁性
无顺磁性D.向反应后的溶液中加入乙醇,溶液没有发生变化,因为
 不会与乙醇发生反应
不会与乙醇发生反应②
 其实为
其实为 的简略写法,该配离子的空间结构为狭长八面体,如图:
的简略写法,该配离子的空间结构为狭长八面体,如图:
A.中心原子的杂化方式相同 B.分子a比分子b键角大
C.分子的热稳定性a弱于b D.配体结合中心离子的能力a弱于b
(4)高能电子流轰击
 分子,通过质谱仪发现存在质荷比数值为30的离子峰,该峰对应的微粒化学式是
分子,通过质谱仪发现存在质荷比数值为30的离子峰,该峰对应的微粒化学式是
您最近一年使用:0次
解题方法
6 . 现代社会对电池的能量密度和安全性提出更高的要求,全固态锂离子电池比水系镍锌电池在此方面表现出更大的优势。最近浙江大学潘洪革教授团队将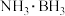 引入到
引入到 晶格中合成了复合氢化物,成功实现室温条件下
晶格中合成了复合氢化物,成功实现室温条件下 基固态电解质的超快锂离子传导性能,为室温实用型固体电解质奠定了基础。回答下列问题:
基固态电解质的超快锂离子传导性能,为室温实用型固体电解质奠定了基础。回答下列问题:
(1)基态 的电子排布式为
的电子排布式为_______ ;基态Ni原子有_______ 个未成对电子。
(2) 中阴离子的立体构型是
中阴离子的立体构型是_______ ; 中存在
中存在_______ (填选项字母)。
A.离子键 B.σ键 C.π键 D.氢键
(3)Al与B属于同族元素, 在
在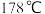 时发生升华,其固体属于
时发生升华,其固体属于_______ 晶体; 在蒸汽状态下以双聚分子存在,该双聚分子的结构式为
在蒸汽状态下以双聚分子存在,该双聚分子的结构式为_______ ,其中Al的配位数为_______ 。
(4)乙硼烷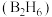 与乙二胺
与乙二胺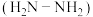 的相对分子质量相近,但乙硼烷的熔点
的相对分子质量相近,但乙硼烷的熔点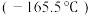 、沸点
、沸点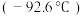 分别低于乙二胺的熔点
分别低于乙二胺的熔点 、沸点
、沸点 ,原因是
,原因是_______ 。
(5)多硼酸盐是由两个以上的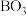 原子团组成的环状或链状结构,双核硼酸根离子、三核硼酸根离子链状结构如图所示:
原子团组成的环状或链状结构,双核硼酸根离子、三核硼酸根离子链状结构如图所示:_______ ;这类链状结构的硼酸根离子的化学式可用通式表示为_______ 。(n代表B原子数)。
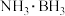 引入到
引入到 晶格中合成了复合氢化物,成功实现室温条件下
晶格中合成了复合氢化物,成功实现室温条件下 基固态电解质的超快锂离子传导性能,为室温实用型固体电解质奠定了基础。回答下列问题:
基固态电解质的超快锂离子传导性能,为室温实用型固体电解质奠定了基础。回答下列问题:(1)基态
 的电子排布式为
的电子排布式为(2)
 中阴离子的立体构型是
中阴离子的立体构型是 中存在
中存在A.离子键 B.σ键 C.π键 D.氢键
(3)Al与B属于同族元素,
 在
在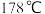 时发生升华,其固体属于
时发生升华,其固体属于 在蒸汽状态下以双聚分子存在,该双聚分子的结构式为
在蒸汽状态下以双聚分子存在,该双聚分子的结构式为(4)乙硼烷
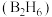 与乙二胺
与乙二胺 的相对分子质量相近,但乙硼烷的熔点
的相对分子质量相近,但乙硼烷的熔点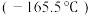 、沸点
、沸点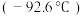 分别低于乙二胺的熔点
分别低于乙二胺的熔点 、沸点
、沸点 ,原因是
,原因是(5)多硼酸盐是由两个以上的
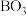 原子团组成的环状或链状结构,双核硼酸根离子、三核硼酸根离子链状结构如图所示:
原子团组成的环状或链状结构,双核硼酸根离子、三核硼酸根离子链状结构如图所示: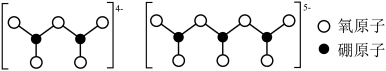
您最近一年使用:0次
名校
7 . 氮、磷化合物在科研和生产中有许多重要用途。回答下列问题:
(1)氨硼烷(NH3BH3)是极具潜力的固体储氢材料,分子中与N原子相连的H呈正电性(H +),与B原子相连的H呈负电性(H
+),与B原子相连的H呈负电性(H -)。B原子的杂化方式为
-)。B原子的杂化方式为_________ ,H、B、N的电负性由大到小的顺序为____ 。与氨硼烷互为等电子体的分子是_______ (写名称),其熔点比NH3BH3低,原因是__________ 。
(2)南开大学某课题组成功合成[FeP6]2-。结构如图,环状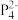 结构与苯相似,
结构与苯相似,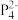 中的大π键可表示为
中的大π键可表示为___________ 。
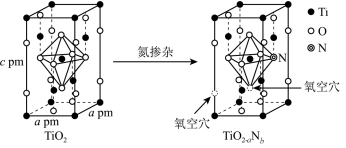
___ 种,TiO2晶胞的密度为_________ g/cm3,TiO2-aNb 晶体中a:b=_________ 。
(1)氨硼烷(NH3BH3)是极具潜力的固体储氢材料,分子中与N原子相连的H呈正电性(H
 +),与B原子相连的H呈负电性(H
+),与B原子相连的H呈负电性(H -)。B原子的杂化方式为
-)。B原子的杂化方式为(2)南开大学某课题组成功合成[FeP6]2-。结构如图,环状
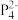 结构与苯相似,
结构与苯相似,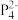 中的大π键可表示为
中的大π键可表示为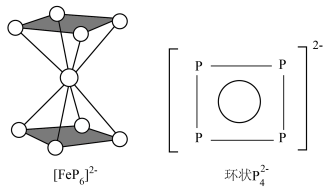
您最近一年使用:0次
名校
解题方法
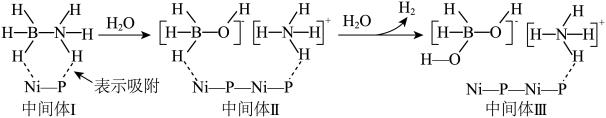
8 . 研究含氮、硼化合物具有重要意义。
(1)一种镍磷化合物催化氨硼烷水解制氢的可能机理如图所示。___________ 。
(2)N2O、N 和CO2为等电子体,写出N2O的结构式
和CO2为等电子体,写出N2O的结构式___________ 。
(3)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为___________ (以n表示硼原子的个数)。硼氢化钠是一种常用的还原剂,其晶胞结构如图2所示:若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到晶体的化学式为___________ 。 易溶于热水、在冷水中溶解度较小,可通过如下过程制得:称取10g钠硼解石[主要成分NaCaB5O9·8H2O],含少量
易溶于热水、在冷水中溶解度较小,可通过如下过程制得:称取10g钠硼解石[主要成分NaCaB5O9·8H2O],含少量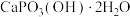 、NaCl和难溶于酸的物质],除去氯化钠后,在60℃下用浓硝酸溶解,趁热过滤,将滤渣用热水洗净后,合并滤液和洗涤液,降温结晶,过滤得
、NaCl和难溶于酸的物质],除去氯化钠后,在60℃下用浓硝酸溶解,趁热过滤,将滤渣用热水洗净后,合并滤液和洗涤液,降温结晶,过滤得 。写出
。写出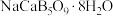 与硝酸反应生成
与硝酸反应生成 的化学方程式:
的化学方程式:___________ 。
(5) 的强碱溶液在
的强碱溶液在 改性的
改性的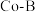 催化剂作用下与水反应生成
催化剂作用下与水反应生成 的部分反应机理如题图3所示。
的部分反应机理如题图3所示。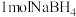 与
与 反应最多产生
反应最多产生 的物质的量为
的物质的量为___________ mol。
②若用 代替
代替 ,步骤2中生成气体的化学式为
,步骤2中生成气体的化学式为___________ 。
(1)一种镍磷化合物催化氨硼烷水解制氢的可能机理如图所示。
(2)N2O、N
 和CO2为等电子体,写出N2O的结构式
和CO2为等电子体,写出N2O的结构式(3)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为

 易溶于热水、在冷水中溶解度较小,可通过如下过程制得:称取10g钠硼解石[主要成分NaCaB5O9·8H2O],含少量
易溶于热水、在冷水中溶解度较小,可通过如下过程制得:称取10g钠硼解石[主要成分NaCaB5O9·8H2O],含少量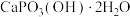 、NaCl和难溶于酸的物质],除去氯化钠后,在60℃下用浓硝酸溶解,趁热过滤,将滤渣用热水洗净后,合并滤液和洗涤液,降温结晶,过滤得
、NaCl和难溶于酸的物质],除去氯化钠后,在60℃下用浓硝酸溶解,趁热过滤,将滤渣用热水洗净后,合并滤液和洗涤液,降温结晶,过滤得 。写出
。写出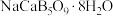 与硝酸反应生成
与硝酸反应生成 的化学方程式:
的化学方程式:(5)
 的强碱溶液在
的强碱溶液在 改性的
改性的 催化剂作用下与水反应生成
催化剂作用下与水反应生成 的部分反应机理如题图3所示。
的部分反应机理如题图3所示。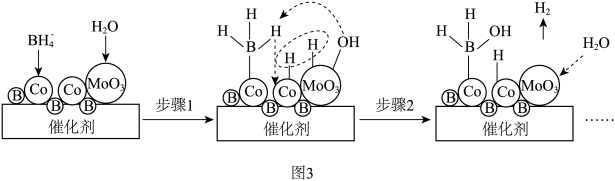
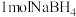 与
与 反应最多产生
反应最多产生 的物质的量为
的物质的量为②若用
 代替
代替 ,步骤2中生成气体的化学式为
,步骤2中生成气体的化学式为
您最近一年使用:0次
解题方法
9 . 元素周期表已成为化学家的得力工具,如在过渡元素中寻找优良的催化剂,在碱金属元素中开发高能电池。结合日常生活中的常见应用,请回答以下问题:
Ⅰ. 和
和 均可以催化降解甲醛、苯等有害物质,具有去除效率高,且无二次污染等优点,广泛应用于家居装潢等领域,其中一种催化机理如图所示。
均可以催化降解甲醛、苯等有害物质,具有去除效率高,且无二次污染等优点,广泛应用于家居装潢等领域,其中一种催化机理如图所示。___________ 。
(2) 和·CHO中碳原子的杂化形式分别为
和·CHO中碳原子的杂化形式分别为___________ 、___________ 。
(3)HCHO的空间构型为___________ 。
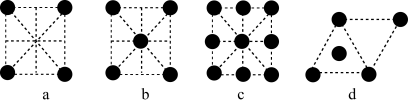
(4)金属钛和锰可导电、导热,有金属光泽和延展性,这些性质都可以用理论解释。已知金属锰有多种晶型,y型锰的面心立方晶胞俯视图符合下列___________ (填编号)。 、聚乙二醇、
、聚乙二醇、 、
、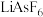 和LiCl等可作锂离子聚合物电池的材料。
和LiCl等可作锂离子聚合物电池的材料。
(5)Fe的基态原子的价电子排布式为___________ 。
(6)乙二醇( )的相对分子质量与丙醇(
)的相对分子质量与丙醇(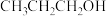 )相近,但沸点高出100℃,原因是
)相近,但沸点高出100℃,原因是___________ 。
(7)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。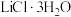 属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Li原子的分布图和原子分数坐标。
属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Li原子的分布图和原子分数坐标。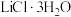 的摩尔质量为M
的摩尔质量为M ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
该晶胞中Cl原子的数目为___________ ,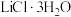 晶体的密度为
晶体的密度为___________  (列出计算表达式)。
(列出计算表达式)。
Ⅰ.
 和
和 均可以催化降解甲醛、苯等有害物质,具有去除效率高,且无二次污染等优点,广泛应用于家居装潢等领域,其中一种催化机理如图所示。
均可以催化降解甲醛、苯等有害物质,具有去除效率高,且无二次污染等优点,广泛应用于家居装潢等领域,其中一种催化机理如图所示。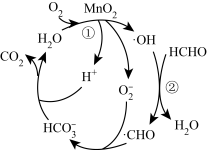
(2)
 和·CHO中碳原子的杂化形式分别为
和·CHO中碳原子的杂化形式分别为(3)HCHO的空间构型为
(4)金属钛和锰可导电、导热,有金属光泽和延展性,这些性质都可以用理论解释。已知金属锰有多种晶型,y型锰的面心立方晶胞俯视图符合下列
 、聚乙二醇、
、聚乙二醇、 、
、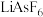 和LiCl等可作锂离子聚合物电池的材料。
和LiCl等可作锂离子聚合物电池的材料。(5)Fe的基态原子的价电子排布式为
(6)乙二醇(
 )的相对分子质量与丙醇(
)的相对分子质量与丙醇(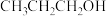 )相近,但沸点高出100℃,原因是
)相近,但沸点高出100℃,原因是(7)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。
 属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Li原子的分布图和原子分数坐标。
属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Li原子的分布图和原子分数坐标。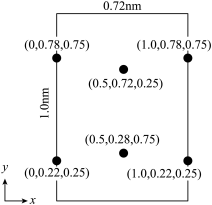
 的摩尔质量为M
的摩尔质量为M ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。该晶胞中Cl原子的数目为
 晶体的密度为
晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
解题方法
10 . 铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图:_________ 。
(2)载氧时,血红蛋白分子中 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是_________ (填字母)。
a. b.
b. c.CO
c.CO
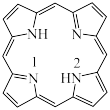
(3)一种最简单的卟啉环结构如图:_________ 。
②比较C和N的电负性大小,并从原子结构角度说明理由:_________ 。
③该卟啉分子在酸性环境中配位能力会减弱,原因是_________ 。
Ⅱ. 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
(4)该晶体的密度是_________  。
。
(5)距离F最近的Cs的个数为_________ 。
I.在血液中,以
 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图: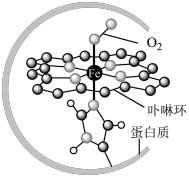
(2)载氧时,血红蛋白分子中
 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是a.
 b.
b. c.CO
c.CO (3)一种最简单的卟啉环结构如图:
②比较C和N的电负性大小,并从原子结构角度说明理由:
③该卟啉分子在酸性环境中配位能力会减弱,原因是
Ⅱ.
 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。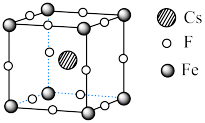
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。(4)该晶体的密度是
 。
。(5)距离F最近的Cs的个数为
您最近一年使用:0次



