名校
解题方法
1 . 锌在工业中有重要作用,也是人体必需的微量元素。请回答:
(1)基态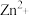 的价层电子排布式
的价层电子排布式_______ , 中阴离子空间结构为
中阴离子空间结构为_______ 。
(2)下列说法正确的是_______。
(3)已知: 和
和 的熔点数据如下表:
的熔点数据如下表:
 熔点明显高于
熔点明显高于 ,原因是
,原因是_______ 。
(4)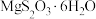 的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。 个数为
个数为_______ 。已知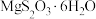 的摩尔质量是
的摩尔质量是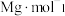 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为_______  。(
。(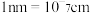 )
)
(1)基态
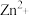 的价层电子排布式
的价层电子排布式 中阴离子空间结构为
中阴离子空间结构为(2)下列说法正确的是_______。
A.电负性: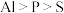 | B.离子半径: |
| C.Fe位于元素周期表的第四周期第Ⅷ族 | D.Cr在元素周期表中处于d区 |
(3)已知:
 和
和 的熔点数据如下表:
的熔点数据如下表:| 物质 | 熔点/℃ |
 | 800.7 |
 |  |
 熔点明显高于
熔点明显高于 ,原因是
,原因是(4)
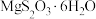 的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。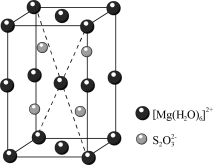
 个数为
个数为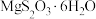 的摩尔质量是
的摩尔质量是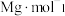 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为 。(
。(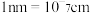 )
)
您最近一年使用:0次
解题方法
2 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。
(1)Fe基态核外电子排布式为___________ ;[Fe(H2O)6]2+中与Fe2+配位原子是___________ (填元素符号)。
(2)NH3分子中氮原子的杂化轨道类型为___________ ,分子空间构型为___________ ;NH3分子H—N—H键角比PH3分子中的H—P—H键角大,请解释其原因___________
(3)与NH 互为等电子体的一种分子为
互为等电子体的一种分子为___________ (填化学式)。
(4)柠檬酸的结构简式如图。1 mol 柠檬酸分子中碳原子与氧形成的σ键的数目为___________ mol,π键的数目为___________ mol。
(1)Fe基态核外电子排布式为
(2)NH3分子中氮原子的杂化轨道类型为
(3)与NH
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)柠檬酸的结构简式如图。1 mol 柠檬酸分子中碳原子与氧形成的σ键的数目为

您最近一年使用:0次
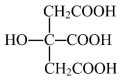
3 . 绿矾 可作补血剂,其结构如图所示:
可作补血剂,其结构如图所示:
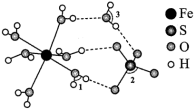
由成键一方单独提供孤电子对给予另外一方,这类“电子对给予—接受”化学键称为配位键。
(1)按照核外电子排布,可把元素周期表划分成五个区,铁元素位于元素周期表的_______ 区。
(2)基态S原子核外电子空间运动状态有___________ 种,电子占据最高能级的电子云轮廓图形状为___________ 。
(3) 中
中 由大到小的顺序是
由大到小的顺序是___________ 。
(4)二价铁易被氧化为三价铁,结合价层电子排布式解释原因:___________ 。
 可作补血剂,其结构如图所示:
可作补血剂,其结构如图所示:
由成键一方单独提供孤电子对给予另外一方,这类“电子对给予—接受”化学键称为配位键。
(1)按照核外电子排布,可把元素周期表划分成五个区,铁元素位于元素周期表的
(2)基态S原子核外电子空间运动状态有
(3)
 中
中 由大到小的顺序是
由大到小的顺序是(4)二价铁易被氧化为三价铁,结合价层电子排布式解释原因:
您最近一年使用:0次
名校
解题方法
4 .  具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用是科学研究的重要课题。
的合成及应用是科学研究的重要课题。
(1)以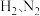 合成
合成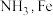 是常用的催化剂。
是常用的催化剂。
①基态 原子的电子排布式为
原子的电子排布式为___________ ,基态N原子轨道表示式___________ 。
②实际生产中采用铁的氧化物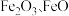 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
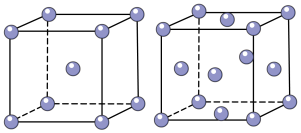
ⅰ.两种晶胞所含铁原子个数比为___________ 。
ⅱ.图1晶胞的棱长为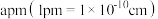 ,则其密度ρ=
,则其密度ρ=__________ g/cm3。
③我国科学家开发出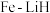 双中心催化剂,在合成
双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能 :
:
 ,从原子结构角度解释原因
,从原子结构角度解释原因___________ 。
(2)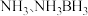 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
① 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为___________ 。
② 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是___________ 。其他含氮配合物,如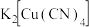 的配离子是
的配离子是___________ 、配合物 的配体是
的配体是___________ 。
(3)常温下 是橙黄色液体,其分子结构如图所示。
是橙黄色液体,其分子结构如图所示。
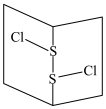
少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
 分子中含有
分子中含有___________ 键(填“极性”、“非极性”,下同),是___________ 分子, 与
与 分子结构相似,熔沸点S2Br2
分子结构相似,熔沸点S2Br2______ S2Cl2(填“>”或“<”)。
 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用是科学研究的重要课题。
的合成及应用是科学研究的重要课题。(1)以
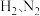 合成
合成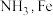 是常用的催化剂。
是常用的催化剂。①基态
 原子的电子排布式为
原子的电子排布式为②实际生产中采用铁的氧化物
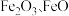 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
ⅰ.两种晶胞所含铁原子个数比为
ⅱ.图1晶胞的棱长为
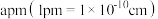 ,则其密度ρ=
,则其密度ρ=③我国科学家开发出
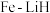 双中心催化剂,在合成
双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因(2)
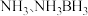 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。①
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为②
 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是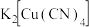 的配离子是
的配离子是 的配体是
的配体是(3)常温下
 是橙黄色液体,其分子结构如图所示。
是橙黄色液体,其分子结构如图所示。
少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
 分子中含有
分子中含有 与
与 分子结构相似,熔沸点S2Br2
分子结构相似,熔沸点S2Br2
您最近一年使用:0次
解题方法
5 . 钠、铁及他们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有 NaN3、Fe2O3、KClO4、NaHCO3等物 质。当汽车发生碰撞时,NaN3 迅速分解产生 N2和 Na, 同时放出大量的热,N2使气囊迅速膨胀,从而起到保护作用。
①KClO4可处理产生的 Na,其中氯元素的化合价是_______ 。
②NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式 为_______ 。
(2)电子工业常用 30%的 FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①FeCl3溶液与金属铜发生反应的离子方程式为_______ 。
②将 FeCl3饱和溶液滴入沸水中,并继续加热至液体呈红褐色,制得的分散系 为_______ (填“溶液” 、“胶体”或“浊液”) , 关于此分散系说法中,不正确的是_______ (填字母)
A.分散质粒子的直径在 1×10-9m ~ 1×10-7m B.是一种透明的纯净物
C.具有丁达尔效应 D.可以透过滤纸
(1)某汽车安全气囊的产气药剂主要含有 NaN3、Fe2O3、KClO4、NaHCO3等物 质。当汽车发生碰撞时,NaN3 迅速分解产生 N2和 Na, 同时放出大量的热,N2使气囊迅速膨胀,从而起到保护作用。
①KClO4可处理产生的 Na,其中氯元素的化合价是
②NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式 为
(2)电子工业常用 30%的 FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①FeCl3溶液与金属铜发生反应的离子方程式为
②将 FeCl3饱和溶液滴入沸水中,并继续加热至液体呈红褐色,制得的分散系 为
A.分散质粒子的直径在 1×10-9m ~ 1×10-7m B.是一种透明的纯净物
C.具有丁达尔效应 D.可以透过滤纸
您最近一年使用:0次
2023-03-13更新
|
425次组卷
|
2卷引用:新疆昌吉州行知学校2022-2023学年高一下学期第一次月考化学试题
解题方法
6 . 新型冠状病毒疫情已经流行长达三年之久,依然没有很好的解决办法,但是我们需要勤开窗通风,合理使用消毒液,医用酒精等措施来有效的预防病毒,现按要求回答下列问题:
(1)消毒液的组成元素中,基态O原子的电子排布式是_______ ,基态Cl原子未成对电子数为_______ 个
(2)C2H5OH分子中碳原子的杂化方式为_______ ,组成元素电负性大小顺序为_______ ,1mol乙醇分子中含有σ键数目为_______
(3)与氧元素相邻的N元素的第一电离能的大小顺序为_______ (填元素符号),H2O分子的空间构型为_______ ,中心原子的杂化方式为_______ ,熔沸点:H2O_______ H2S(填“>”或“<”)
(4)水中不存在的作用力_______
A.离子键 B.共价键 C.氢键
(1)消毒液的组成元素中,基态O原子的电子排布式是
(2)C2H5OH分子中碳原子的杂化方式为
(3)与氧元素相邻的N元素的第一电离能的大小顺序为
(4)水中不存在的作用力
A.离子键 B.共价键 C.氢键
您最近一年使用:0次
2022-12-02更新
|
757次组卷
|
2卷引用:宁夏银川市景博中学2022-2023学年高二上学期期中考试化学试题
7 . 根据下列有机物回答问题:
(1)甲、乙两种有机物的共同含氧官能团是_______ (填名称)。
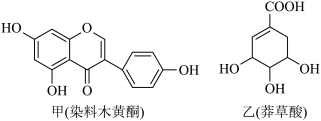
(2)区分甲、乙有机物的试剂是_______(填标号)。
(3)等物质的量的甲、乙与足量 在一定条件下反应,消耗
在一定条件下反应,消耗 的物质的量之比为
的物质的量之比为_______ 。
(4)一定条件下,甲、乙都能发生的反应有_______(填标号)。
(5)等物质的量的甲、乙与足量溴水反应,消耗 的物质的量之比为
的物质的量之比为_______ 。
(6)等物质的量的乙分别与钠、碳酸氢钠溶液完全反应,产生 的物质的量之比为
的物质的量之比为_______ 。
(1)甲、乙两种有机物的共同含氧官能团是

(2)区分甲、乙有机物的试剂是_______(填标号)。
A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D.酸性 溶液 溶液 |
 在一定条件下反应,消耗
在一定条件下反应,消耗 的物质的量之比为
的物质的量之比为(4)一定条件下,甲、乙都能发生的反应有_______(填标号)。
| A.水解反应 | B.酯化反应 | C.消去反应 | D.加成反应 |
 的物质的量之比为
的物质的量之比为(6)等物质的量的乙分别与钠、碳酸氢钠溶液完全反应,产生
 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2022-10-10更新
|
641次组卷
|
2卷引用:湖南省长沙市第一中学等名校联考联合体2022-2023学年高二上学期第一次联考化学试题
名校
解题方法
8 . 同族的氮、磷、砷元素的化合物在医药生产中有许多重要用途。请回答下列问题:
(1)砷的外围电子排布式是_______ ;砷与同主族相邻元素相比,第一电离能由大到小的顺序是_______ 。
(2)氮、磷、砷的气态氢化物中,最不稳定的是_______ (填化学式),从结构上看其主要原因是_______ 。
(3) 与
与 可形成
可形成 ,产物中氮原子的
,产物中氮原子的 杂化轨道与硼原子的
杂化轨道与硼原子的_______ 轨道重叠成键。
(4)将氨通入胆矾溶液中,得到深蓝色溶液,阳离子是由氨和水分子与铜离子形成的,呈轴向狭长的八面体结构(如图1)。深蓝色溶液中不存在的作用力有_______ (填字母序号)。 键 b.金属键 c.非极性键 d.极性键 e.配位键 f.范德华力 g.氢键
键 b.金属键 c.非极性键 d.极性键 e.配位键 f.范德华力 g.氢键
(5)不同聚集状态的 ,结构不同。
,结构不同。
①固态 是一种白色晶体,经X射线研究证明,是由一种正四面体形阳离子和一种正八面体形阴离子构成,晶胞如图2所示,正八面体形离子的化学式为
是一种白色晶体,经X射线研究证明,是由一种正四面体形阳离子和一种正八面体形阴离子构成,晶胞如图2所示,正八面体形离子的化学式为_______ ; 的结构如图3所示,是
的结构如图3所示,是_______ 分子(填“极性”或“非极性”),气态 分子中P的杂化类型可能是
分子中P的杂化类型可能是_______ (填字母序号)。 c.
c. d.
d. e.
e.
(1)砷的外围电子排布式是
(2)氮、磷、砷的气态氢化物中,最不稳定的是
(3)
 与
与 可形成
可形成 ,产物中氮原子的
,产物中氮原子的 杂化轨道与硼原子的
杂化轨道与硼原子的(4)将氨通入胆矾溶液中,得到深蓝色溶液,阳离子是由氨和水分子与铜离子形成的,呈轴向狭长的八面体结构(如图1)。深蓝色溶液中不存在的作用力有

 键 b.金属键 c.非极性键 d.极性键 e.配位键 f.范德华力 g.氢键
键 b.金属键 c.非极性键 d.极性键 e.配位键 f.范德华力 g.氢键(5)不同聚集状态的
 ,结构不同。
,结构不同。①固态
 是一种白色晶体,经X射线研究证明,是由一种正四面体形阳离子和一种正八面体形阴离子构成,晶胞如图2所示,正八面体形离子的化学式为
是一种白色晶体,经X射线研究证明,是由一种正四面体形阳离子和一种正八面体形阴离子构成,晶胞如图2所示,正八面体形离子的化学式为
 的结构如图3所示,是
的结构如图3所示,是 分子中P的杂化类型可能是
分子中P的杂化类型可能是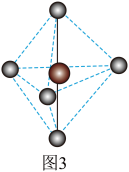
 c.
c. d.
d. e.
e.
您最近一年使用:0次
2022-09-15更新
|
492次组卷
|
3卷引用:福建泉州实验中学等四校2021-2022学年高二下学期期中考试化学试题
解题方法
9 . 钠的原子结构及存在
(1)钠的原子结构
钠原子易_________ 最外层的一个电子,形成具有稳定电子层结构的_________ 。

(2)钠的存在
钠元素在自然界中以________ 态存在,如_______ 等。
(1)钠的原子结构
钠原子易

(2)钠的存在
钠元素在自然界中以
您最近一年使用:0次
名校
10 . Ti、Na、Mg、C、N、O、Fe等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是___________ ,能量最低的是___________ (填序号)。
a. b.
b.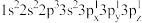
c.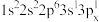 d.
d.
(3)Ti原子位于元素周期表中的___________ 区,最高能层电子的电子云轮廓形状为___________ ,其价电子排布式为___________ 。与Ti同周期的过渡元素中,未成对电子数最多的的基态原子的外围电子的轨道表示式___________ 。
(4)Fe3+与Fe2+的离子半径大小关系为Fe3+___________ Fe2+(填“大于”或“小于”)
(5)下列各组多电子原子的能级能量比较不正确的是___________
①2p=3p ②4s>2s ③4p>4f ④4d>3d
(1)钠在火焰上灼烧的黄光是一种
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是
a.
 b.
b.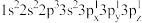
c.
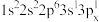 d.
d.
(3)Ti原子位于元素周期表中的
(4)Fe3+与Fe2+的离子半径大小关系为Fe3+
(5)下列各组多电子原子的能级能量比较不正确的是___________
①2p=3p ②4s>2s ③4p>4f ④4d>3d
| A.①④ | B.①③ | C.③④ | D.②③ |
您最近一年使用:0次
2022-02-18更新
|
1360次组卷
|
7卷引用:河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题



