Ti、Na、Mg、C、N、O、Fe等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是___________ ,能量最低的是___________ (填序号)。
a. b.
b.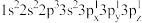
c.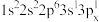 d.
d.
(3)Ti原子位于元素周期表中的___________ 区,最高能层电子的电子云轮廓形状为___________ ,其价电子排布式为___________ 。与Ti同周期的过渡元素中,未成对电子数最多的的基态原子的外围电子的轨道表示式___________ 。
(4)Fe3+与Fe2+的离子半径大小关系为Fe3+___________ Fe2+(填“大于”或“小于”)
(5)下列各组多电子原子的能级能量比较不正确的是___________
①2p=3p ②4s>2s ③4p>4f ④4d>3d
(1)钠在火焰上灼烧的黄光是一种
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是
a.
 b.
b.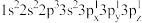
c.
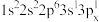 d.
d.
(3)Ti原子位于元素周期表中的
(4)Fe3+与Fe2+的离子半径大小关系为Fe3+
(5)下列各组多电子原子的能级能量比较不正确的是___________
①2p=3p ②4s>2s ③4p>4f ④4d>3d
| A.①④ | B.①③ | C.③④ | D.②③ |
更新时间:2022-02-18 16:41:02
|
相似题推荐
解答题-无机推断题
|
容易
(0.94)
名校
解题方法
【推荐1】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
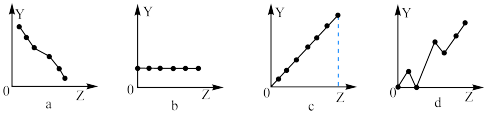
(1)把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的最外层电子数_______ 。
②第三周期元素的最高化合价_______ 。
③ 、
、 、
、 、
、 的离子半径
的离子半径_______ 。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3; 、
、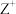 、
、 的半径逐渐减小;化合物XN常温下为气体。据此回答:
的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为_______ ,X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式_______ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,组成元素的原子数目之比为1:1:1,A的固体具有吸湿性,B是“8.4”消毒液的有效成分,A与氢氧化铝反应的离子方程式_______ ,B与浓盐酸反应可制得N的单质,离子方程式为_______ 。
③工业上制取单质M的化学方程式为_______ 。

(1)把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的最外层电子数
②第三周期元素的最高化合价
③
 、
、 、
、 、
、 的离子半径
的离子半径(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;
 、
、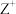 、
、 的半径逐渐减小;化合物XN常温下为气体。据此回答:
的半径逐渐减小;化合物XN常温下为气体。据此回答:①N的最高价氧化物对应的水化物的化学式为
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,组成元素的原子数目之比为1:1:1,A的固体具有吸湿性,B是“8.4”消毒液的有效成分,A与氢氧化铝反应的离子方程式
③工业上制取单质M的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
容易
(0.94)
【推荐2】短周期元素A、B、C,D、E的原子序数依次增大,它们的相关信息如表所示:
(1)简单气态氢化物:沸点A_______ B(填“>”或“<”,下同),稳定性A_______ B。
(2)B、C、D的简单离子半径由小到大的顺序为_______ (填化学符号)。B、C按原个数比1∶1组成的化合物的电子式为_______ 。
(3)E的最高价氧化物的水化物的化学式为_______ 。写出一个能证明元素E原子比硫原子得电子能力强的离子方程式_______ 。
(4)向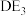 的水溶液中滴加C的最高价氧化物对应水化物的水溶液至过量,依据实验现象可以说明失电子能力C>D,其理由是
的水溶液中滴加C的最高价氧化物对应水化物的水溶液至过量,依据实验现象可以说明失电子能力C>D,其理由是_______ 。
| 序号 | 相关信息 |
| ① | A的最高正价与最低负价的绝对值相差2 |
| ② | B的一种核素的质量数为18,中子数为10 |
| ③ | 所有短周期主族元素原子中,C的原子半径最大 |
| ④ | A、C、D的最高价氧化物对应的水化物两两之间均可反应 |
| ⑤ | E的单质与甲烷在光照条件下可以发生取代反应 |
(2)B、C、D的简单离子半径由小到大的顺序为
(3)E的最高价氧化物的水化物的化学式为
(4)向
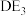 的水溶液中滴加C的最高价氧化物对应水化物的水溶液至过量,依据实验现象可以说明失电子能力C>D,其理由是
的水溶液中滴加C的最高价氧化物对应水化物的水溶液至过量,依据实验现象可以说明失电子能力C>D,其理由是
您最近一年使用:0次
解答题-无机推断题
|
容易
(0.94)
名校
【推荐3】“元素周期表是浓缩的化学世界”。下图是元素周期表的一部分,请回答下列问题:
(1)请写出X的元素符号_______ 。
(2)请写出Y的最高价氧化物对应的水化物_______ (填化学式)。
(3)请判断原子半径大小:W_______ Z。(填“>”、“=”或“<”)
(4)请判断元素非金属性的强弱:L_______ X。(填“>”、“=”或“<”)
(5)下列说法正确的是_______。
| X | |||||||||||||||||
| Y | Z | L | W | ||||||||||||||
甲 | |||||||||||||||||
(2)请写出Y的最高价氧化物对应的水化物
(3)请判断原子半径大小:W
(4)请判断元素非金属性的强弱:L
(5)下列说法正确的是_______。
| A.可在区域“甲”中寻找催化剂 |
| B.Z在地壳中的含量排在第二位 |
| C.气态氢化物的稳定性:W<Z |
| D.工业上电解Y和W化合物的水溶液制备Y |
您最近一年使用:0次
解答题-无机推断题
|
容易
(0.94)
名校
解题方法
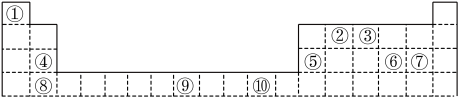
【推荐1】如图为长式周期表的一部分,其中的编号代表对应的元素。
(1)①和②形成的一种5核10电子分子,其空间结构为_______ ,属于_______ 分子(填“极性”或“非极性”)。
(2)元素③所在的周期中, 最大的是
最大的是_______ (填元素符号),元素⑥和⑦的最高价氧化物对应水化物中酸性较强的是:_______ (填化学式)。
(3)根据元素周期表分区,元素⑩位于_______ 区,其二价离子电子排布式为_______ 。
(4)元素③和⑤形成的化合物,硬度很大,熔沸点高。这种化合物属于的晶体类型为_______ 。该化合物与 溶液反应的离子方程式
溶液反应的离子方程式_______ 。
(1)①和②形成的一种5核10电子分子,其空间结构为
(2)元素③所在的周期中,
 最大的是
最大的是(3)根据元素周期表分区,元素⑩位于
(4)元素③和⑤形成的化合物,硬度很大,熔沸点高。这种化合物属于的晶体类型为
 溶液反应的离子方程式
溶液反应的离子方程式
您最近一年使用:0次
解答题-结构与性质
|
容易
(0.94)
名校
解题方法
【推荐2】同族的氮、磷、砷元素的化合物在医药生产中有许多重要用途。请回答下列问题:
(1)砷的外围电子排布式是_______ ;砷与同主族相邻元素相比,第一电离能由大到小的顺序是_______ 。
(2)氮、磷、砷的气态氢化物中,最不稳定的是_______ (填化学式),从结构上看其主要原因是_______ 。
(3) 与
与 可形成
可形成 ,产物中氮原子的
,产物中氮原子的 杂化轨道与硼原子的
杂化轨道与硼原子的_______ 轨道重叠成键。
(4)将氨通入胆矾溶液中,得到深蓝色溶液,阳离子是由氨和水分子与铜离子形成的,呈轴向狭长的八面体结构(如图1)。深蓝色溶液中不存在的作用力有_______ (填字母序号)。 键 b.金属键 c.非极性键 d.极性键 e.配位键 f.范德华力 g.氢键
键 b.金属键 c.非极性键 d.极性键 e.配位键 f.范德华力 g.氢键
(5)不同聚集状态的 ,结构不同。
,结构不同。
①固态 是一种白色晶体,经X射线研究证明,是由一种正四面体形阳离子和一种正八面体形阴离子构成,晶胞如图2所示,正八面体形离子的化学式为
是一种白色晶体,经X射线研究证明,是由一种正四面体形阳离子和一种正八面体形阴离子构成,晶胞如图2所示,正八面体形离子的化学式为_______ ; 的结构如图3所示,是
的结构如图3所示,是_______ 分子(填“极性”或“非极性”),气态 分子中P的杂化类型可能是
分子中P的杂化类型可能是_______ (填字母序号)。 c.
c. d.
d. e.
e.
(1)砷的外围电子排布式是
(2)氮、磷、砷的气态氢化物中,最不稳定的是
(3)
 与
与 可形成
可形成 ,产物中氮原子的
,产物中氮原子的 杂化轨道与硼原子的
杂化轨道与硼原子的(4)将氨通入胆矾溶液中,得到深蓝色溶液,阳离子是由氨和水分子与铜离子形成的,呈轴向狭长的八面体结构(如图1)。深蓝色溶液中不存在的作用力有

 键 b.金属键 c.非极性键 d.极性键 e.配位键 f.范德华力 g.氢键
键 b.金属键 c.非极性键 d.极性键 e.配位键 f.范德华力 g.氢键(5)不同聚集状态的
 ,结构不同。
,结构不同。①固态
 是一种白色晶体,经X射线研究证明,是由一种正四面体形阳离子和一种正八面体形阴离子构成,晶胞如图2所示,正八面体形离子的化学式为
是一种白色晶体,经X射线研究证明,是由一种正四面体形阳离子和一种正八面体形阴离子构成,晶胞如图2所示,正八面体形离子的化学式为
 的结构如图3所示,是
的结构如图3所示,是 分子中P的杂化类型可能是
分子中P的杂化类型可能是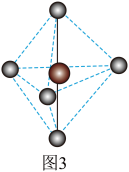
 c.
c. d.
d. e.
e.
您最近一年使用:0次
解答题-结构与性质
|
容易
(0.94)
名校
解题方法
【推荐3】 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用是科学研究的重要课题。
的合成及应用是科学研究的重要课题。
(1)以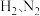 合成
合成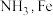 是常用的催化剂。
是常用的催化剂。
①基态 原子的电子排布式为
原子的电子排布式为___________ ,基态N原子轨道表示式___________ 。
②实际生产中采用铁的氧化物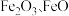 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
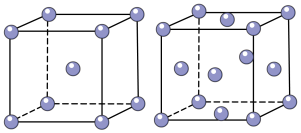
ⅰ.两种晶胞所含铁原子个数比为___________ 。
ⅱ.图1晶胞的棱长为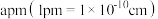 ,则其密度ρ=
,则其密度ρ=__________ g/cm3。
③我国科学家开发出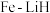 双中心催化剂,在合成
双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能 :
:
 ,从原子结构角度解释原因
,从原子结构角度解释原因___________ 。
(2)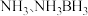 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
① 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为___________ 。
② 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是___________ 。其他含氮配合物,如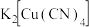 的配离子是
的配离子是___________ 、配合物 的配体是
的配体是___________ 。
(3)常温下 是橙黄色液体,其分子结构如图所示。
是橙黄色液体,其分子结构如图所示。
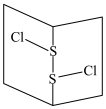
少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
 分子中含有
分子中含有___________ 键(填“极性”、“非极性”,下同),是___________ 分子, 与
与 分子结构相似,熔沸点S2Br2
分子结构相似,熔沸点S2Br2______ S2Cl2(填“>”或“<”)。
 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用是科学研究的重要课题。
的合成及应用是科学研究的重要课题。(1)以
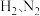 合成
合成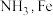 是常用的催化剂。
是常用的催化剂。①基态
 原子的电子排布式为
原子的电子排布式为②实际生产中采用铁的氧化物
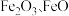 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
ⅰ.两种晶胞所含铁原子个数比为
ⅱ.图1晶胞的棱长为
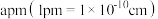 ,则其密度ρ=
,则其密度ρ=③我国科学家开发出
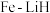 双中心催化剂,在合成
双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因(2)
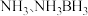 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。①
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为②
 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是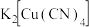 的配离子是
的配离子是 的配体是
的配体是(3)常温下
 是橙黄色液体,其分子结构如图所示。
是橙黄色液体,其分子结构如图所示。
少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
 分子中含有
分子中含有 与
与 分子结构相似,熔沸点S2Br2
分子结构相似,熔沸点S2Br2
您最近一年使用:0次
解答题-结构与性质
|
容易
(0.94)
【推荐1】下表是某些短周期元素的电负性(x)值:
(1)试推测,元素周期表中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为__ 。
(2)已知:Cl—Br+H H—Cl+HO—Br。
H—Cl+HO—Br。
①若NCl3最初水解产物是NH3和HClO,则x(Cl)的最小范围是__ (填表中数值);
②PCl3水解的化学反应方程式是__ 。
(3)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(2)①进行分析,BeCl2属于__ (填“离子化合物”或“共价化合物”),请设计实验证明__ 。
| 元素符号 | Li | Be | N | O | F | Na | Mg | Al | P | S |
| x值 | 1.0 | 1.5 | 3.0 | 3.5 | 4.0 | 0.9 | 1.2 | 1.5 | 2.1 | 2.5 |
(1)试推测,元素周期表中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为
(2)已知:Cl—Br+H
 H—Cl+HO—Br。
H—Cl+HO—Br。①若NCl3最初水解产物是NH3和HClO,则x(Cl)的最小范围是
②PCl3水解的化学反应方程式是
(3)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(2)①进行分析,BeCl2属于
您最近一年使用:0次
解答题-结构与性质
|
容易
(0.94)
解题方法
【推荐2】新型冠状病毒疫情已经流行长达三年之久,依然没有很好的解决办法,但是我们需要勤开窗通风,合理使用消毒液,医用酒精等措施来有效的预防病毒,现按要求回答下列问题:
(1)消毒液的组成元素中,基态O原子的电子排布式是_______ ,基态Cl原子未成对电子数为_______ 个
(2)C2H5OH分子中碳原子的杂化方式为_______ ,组成元素电负性大小顺序为_______ ,1mol乙醇分子中含有σ键数目为_______
(3)与氧元素相邻的N元素的第一电离能的大小顺序为_______ (填元素符号),H2O分子的空间构型为_______ ,中心原子的杂化方式为_______ ,熔沸点:H2O_______ H2S(填“>”或“<”)
(4)水中不存在的作用力_______
A.离子键 B.共价键 C.氢键
(1)消毒液的组成元素中,基态O原子的电子排布式是
(2)C2H5OH分子中碳原子的杂化方式为
(3)与氧元素相邻的N元素的第一电离能的大小顺序为
(4)水中不存在的作用力
A.离子键 B.共价键 C.氢键
您最近一年使用:0次




