1 .  (四羰合镍,沸点43℃)可用于制备高纯镍,也是有机化合物羰基化反应的催化剂。回答下列问题:
(四羰合镍,沸点43℃)可用于制备高纯镍,也是有机化合物羰基化反应的催化剂。回答下列问题:
(1)Ni基态原子价电子的轨道表示式为_______ 。镍的晶胞结构类型与铜的相同,晶胞体积为 ,镍原子半径为
,镍原子半径为_______ 。
(2) 结构如图甲所示,其中含有σ键的数目为
结构如图甲所示,其中含有σ键的数目为_______ , 晶体的类型为
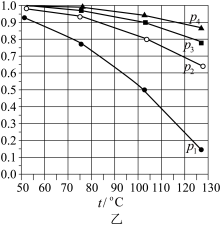
晶体的类型为_______ 。 体积分数x与温度的关系如图乙所示。反应
体积分数x与温度的关系如图乙所示。反应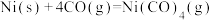 的ΔH
的ΔH_______ 0(填“大于”或“小于”)。从热力学角度考虑,_______ 有利于 的生成(写出两点)。
的生成(写出两点)。 、100℃时CO的平衡转化率α=
、100℃时CO的平衡转化率α=_______ ,该温度下平衡常数
_______  。
。 ,20℃时反应物浓度随时间的变化关系为
,20℃时反应物浓度随时间的变化关系为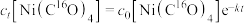 (k为反应速率常数),则
(k为反应速率常数),则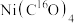 反应一半所需时间
反应一半所需时间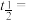
_______ (用k表示)。
 (四羰合镍,沸点43℃)可用于制备高纯镍,也是有机化合物羰基化反应的催化剂。回答下列问题:
(四羰合镍,沸点43℃)可用于制备高纯镍,也是有机化合物羰基化反应的催化剂。回答下列问题:(1)Ni基态原子价电子的轨道表示式为
 ,镍原子半径为
,镍原子半径为(2)
 结构如图甲所示,其中含有σ键的数目为
结构如图甲所示,其中含有σ键的数目为 晶体的类型为
晶体的类型为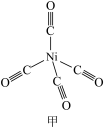
 体积分数x与温度的关系如图乙所示。反应
体积分数x与温度的关系如图乙所示。反应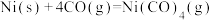 的ΔH
的ΔH 的生成(写出两点)。
的生成(写出两点)。 、100℃时CO的平衡转化率α=
、100℃时CO的平衡转化率α=
 。
。
 ,20℃时反应物浓度随时间的变化关系为
,20℃时反应物浓度随时间的变化关系为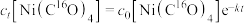 (k为反应速率常数),则
(k为反应速率常数),则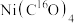 反应一半所需时间
反应一半所需时间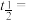
您最近一年使用:0次
真题
解题方法
2 . ⅣA族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:
(1)该族元素基态原子核外未成对电子数为_____ ,在与其他元素形成化合物时,呈现的最高化合价为_____ 。
(2) 俗称电石,该化合物中不存在的化学键类型为
俗称电石,该化合物中不存在的化学键类型为_____ (填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷 ,其中电负性最大的元素是
,其中电负性最大的元素是_____ ,硅原子的杂化轨道类型为_____ 。
(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:_____ 。
(5)结晶型 可作为放射性探测器元件材料,其立方晶胞如图所示。其中
可作为放射性探测器元件材料,其立方晶胞如图所示。其中 的配位数为
的配位数为_____ 。设 为阿伏加德罗常数的值,则该晶体密度为
为阿伏加德罗常数的值,则该晶体密度为_____  (列出计算式)。
(列出计算式)。
(1)该族元素基态原子核外未成对电子数为
(2)
 俗称电石,该化合物中不存在的化学键类型为
俗称电石,该化合物中不存在的化学键类型为a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷
 ,其中电负性最大的元素是
,其中电负性最大的元素是(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:
| 物质 | 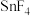 |  |  | 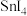 |
熔点/ | 442 | 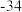 | 29 | 143 |
(5)结晶型
 可作为放射性探测器元件材料,其立方晶胞如图所示。其中
可作为放射性探测器元件材料,其立方晶胞如图所示。其中 的配位数为
的配位数为 为阿伏加德罗常数的值,则该晶体密度为
为阿伏加德罗常数的值,则该晶体密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
23-24高二下·全国·期末
解题方法
3 . 钛(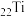 )及其合金大量用于航空工业,被誉为“空间金属”。一种制备金属钛的流程如下:
)及其合金大量用于航空工业,被誉为“空间金属”。一种制备金属钛的流程如下: 原子的价电子轨道表示式为
原子的价电子轨道表示式为___________ 。
(2)纳米 可作为以下反应的催化剂:
可作为以下反应的催化剂: 的原子有
的原子有___________ (填元素符号,下同),其中第一电离能最大的是___________ 。
②某有机物与化合物甲互为同分异构体,能与 溶液反应,且与银氨溶液共热会产生银镜,其结构简式为
溶液反应,且与银氨溶液共热会产生银镜,其结构简式为___________ (写一种)。
(3)钙钛矿晶体立方晶胞结构如下图所示。
① 位于立方晶胞的顶角,被
位于立方晶胞的顶角,被___________ 个O包围成配位八面体。
②若A的分数坐标为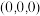 ,则B的分数坐标为
,则B的分数坐标为___________ 。
③钙钛矿晶体的密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则钙钛矿晶胞的边长为
,则钙钛矿晶胞的边长为___________  。
。
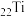 )及其合金大量用于航空工业,被誉为“空间金属”。一种制备金属钛的流程如下:
)及其合金大量用于航空工业,被誉为“空间金属”。一种制备金属钛的流程如下:
 原子的价电子轨道表示式为
原子的价电子轨道表示式为(2)纳米
 可作为以下反应的催化剂:
可作为以下反应的催化剂:
 的原子有
的原子有②某有机物与化合物甲互为同分异构体,能与
 溶液反应,且与银氨溶液共热会产生银镜,其结构简式为
溶液反应,且与银氨溶液共热会产生银镜,其结构简式为(3)钙钛矿晶体立方晶胞结构如下图所示。

①
 位于立方晶胞的顶角,被
位于立方晶胞的顶角,被②若A的分数坐标为
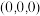 ,则B的分数坐标为
,则B的分数坐标为③钙钛矿晶体的密度为
 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则钙钛矿晶胞的边长为
,则钙钛矿晶胞的边长为 。
。
您最近一年使用:0次
4 . B、C、O、S、K、Ca的化合物在工业生产中有着广泛应用。回答下列问题:
(1)基态C原子价层电子中两种自旋状态的电子数之比为_____ 。
(2)硫代硫酸根(S2O )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
①S原子和O原子的第一电能能较大的是_____ 。
②S2O 的空间结构是
的空间结构是_____ 。
(3)如图是硫的四种含氧酸根的结构: 的是
的是_____ (填标号),理由是_____ 。
(4)B与Si性质相似,均是亲氧元素,在自然界中都是以含氧化合物形式存在,没有游离态单质,从键能的角度分析原因是_____ 。
(5)环氮硼烷(B3N3H6)具有平面六边形结构,B原子的杂化方式为_____ ,写出环氮硼烷的一种等电子体分子的分子式为_____ 。
(6)科学家合成了一种高温超导材料,高温超导材料的晶胞结构如图所示,该立方晶胞参数为apm,阿伏加德罗常数的值为NA.晶体中与K+最近且距离相等的Ca2+数目为_____ ,该晶体的密度为_____ g/cm3。
(1)基态C原子价层电子中两种自旋状态的电子数之比为
(2)硫代硫酸根(S2O
 )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。①S原子和O原子的第一电能能较大的是
②S2O
 的空间结构是
的空间结构是(3)如图是硫的四种含氧酸根的结构:
A. B.
B. C.
C. D.
D.
 的是
的是(4)B与Si性质相似,均是亲氧元素,在自然界中都是以含氧化合物形式存在,没有游离态单质,从键能的角度分析原因是
(5)环氮硼烷(B3N3H6)具有平面六边形结构,B原子的杂化方式为
(6)科学家合成了一种高温超导材料,高温超导材料的晶胞结构如图所示,该立方晶胞参数为apm,阿伏加德罗常数的值为NA.晶体中与K+最近且距离相等的Ca2+数目为

您最近一年使用:0次
解题方法
5 . 过渡金属及其化合物在生产、生活中有重要的应用。回答下列问题:
I.元素周期表中的两种元素,其中X2+的3d轨道中有10个电子;Y单质在金属活动性顺序中排在最末位。
(1)写出X的基态原子的价电子排布式:_______ 。
(2)CN-常作为配位化合物中的配体。在CN-中,C原子采取_______ 杂化,C与N形成的化学键中含有的σ键与π键的数目之比为_______ 。
(3)X、Y均能与CN⁻形成配离子,已知X2+与CN⁻形成配离子时,配位数为4;Y+与CN-形成配离子时,配位数为2。工业上常用Y+和CN-形成的配离子与X单质反应,生成X2+与CN-形成的配离子和Y单质来提取Y,写出上述反应的离子方程式:_______ 。
Ⅱ.超分子在生命科学和物理学等领域中具有重要意义。由Mo将2个(C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。______ 个。
(5)该超分子中配体p-甲酸丁酯吡啶提供孤电子对的原子是_______ (填元素符号)。
(6)C60晶体中,分子的堆积方式为_______ ;“杯酚”可以识别C60,“杯酚”与C60之间作用力的名称为_______ 。
I.元素周期表中的两种元素,其中X2+的3d轨道中有10个电子;Y单质在金属活动性顺序中排在最末位。
(1)写出X的基态原子的价电子排布式:
(2)CN-常作为配位化合物中的配体。在CN-中,C原子采取
(3)X、Y均能与CN⁻形成配离子,已知X2+与CN⁻形成配离子时,配位数为4;Y+与CN-形成配离子时,配位数为2。工业上常用Y+和CN-形成的配离子与X单质反应,生成X2+与CN-形成的配离子和Y单质来提取Y,写出上述反应的离子方程式:
Ⅱ.超分子在生命科学和物理学等领域中具有重要意义。由Mo将2个(C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。

(5)该超分子中配体p-甲酸丁酯吡啶提供孤电子对的原子是
(6)C60晶体中,分子的堆积方式为
您最近一年使用:0次
6 . 铁(26Fe)、镍(28Ni)的单质及其化合物在医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Fe原子核外电子排布式为___________ ,Ni位于元素周期表的___________ 区。
(2)乳酸亚铁口服液是缺铁人群补铁保健品,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度分析,Fe2+易被氧化成Fe3+的原因是___________ 。
(3)FeCl3常用作净水剂、刻蚀剂等。
①FeCl3的熔点(306℃)显著低于FeF3的熔点(1000℃)的原因是___________ 。
②FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+,结构如下图,分析其能够形成双核阳离子的原因:___________ 。___________ 。
(1)基态Fe原子核外电子排布式为
(2)乳酸亚铁口服液是缺铁人群补铁保健品,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度分析,Fe2+易被氧化成Fe3+的原因是
(3)FeCl3常用作净水剂、刻蚀剂等。
①FeCl3的熔点(306℃)显著低于FeF3的熔点(1000℃)的原因是
②FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+,结构如下图,分析其能够形成双核阳离子的原因:


您最近一年使用:0次
7 . Ⅰ.氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。
(2)氟氧化物O2F2、OF2的结构已经确定。
①依据数据推测O—O键的稳定性:O2F2___________ H2O2(填“>”或“<”)。
②OF2中F-O-F的键角小于H2O中H-O-H的键角,解释原因:___________ 。
(3)HF是一种有特殊性质的氢化物。
①已知:氢键(X—H···Y)中三原子在一条直线上时,作用力最强。测定结果表明,(HF)n固体中HF分子排列成锯齿形。画出含2个HF的重复单元结构:___________ 。
②HF中加入BF3可以解离出H2F+和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
Ⅱ.金属冶炼过程中一种用有机化合物从水溶液中提取 的流程如下:
的流程如下: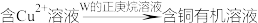
(4)有机化合物W的结构简式为:___________ 种,N、O杂化轨道类型分别为___________ 、___________ 。
(5)W可与 形成化合物Q,其结构如下所示:
形成化合物Q,其结构如下所示: 的价电子排布式为
的价电子排布式为___________ 。
②氢键对Q在水中溶解性的影响是___________ (填“增大”或“减小”)。
(1)基态F原子的核外电子排布式为
(2)氟氧化物O2F2、OF2的结构已经确定。
| O2F2 | H2O2 | |
| O—O键长/pm | 121 | 148 |
②OF2中F-O-F的键角小于H2O中H-O-H的键角,解释原因:
(3)HF是一种有特殊性质的氢化物。
①已知:氢键(X—H···Y)中三原子在一条直线上时,作用力最强。测定结果表明,(HF)n固体中HF分子排列成锯齿形。画出含2个HF的重复单元结构:
②HF中加入BF3可以解离出H2F+和具有正四面体形结构的阴离子,写出该过程的离子方程式:
Ⅱ.金属冶炼过程中一种用有机化合物从水溶液中提取
 的流程如下:
的流程如下: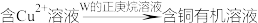
(4)有机化合物W的结构简式为:
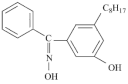
(5)W可与
 形成化合物Q,其结构如下所示:
形成化合物Q,其结构如下所示: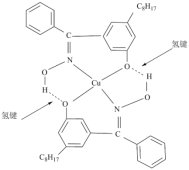
 的价电子排布式为
的价电子排布式为②氢键对Q在水中溶解性的影响是
您最近一年使用:0次
2024-04-30更新
|
111次组卷
|
2卷引用:北京市北京师范大学燕化附属中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
8 . 已知 A、B、C、D、E 是原子序数依次增大前四周期元素,其元素性质或原子结构如表:
(1)A的最高价氧化物是___________ 分子。(填“极性”或“非极性”)该分子的杂化类型是___________
(2)B与其同周期相邻元素第一电离能由大到小的顺序为___________ (填元素符号)。B2O分子的空间构型是___________
(3)C气态氢化物稳定性是同族元素氢化物中最高的,其原因是___________ 。
(4)D 属于___________ 区的元素,该元素原子核外电子占据的最高能层符号是___________ 其基态原子的价层电子轨道表示式为___________ 。
(5)E 的基态原子的电子排布式为___________ 。E-e-=E+的过程中,失去的电子是基态E 中___________ 轨道上的电子。
| A | 原子核外电子分占 3 个不同能级, 且每个能级上排布的电子数相同 |
| B | 原子最高能级的不同轨道都有电子, 且自旋方向相同 |
| C | 在周期表所有元素中电负性最大 |
| D | 位于周期表中第 4 纵列 |
| E | 基态原子 M 层全充满, N 层只有一个电子 |
(2)B与其同周期相邻元素第一电离能由大到小的顺序为
(3)C气态氢化物稳定性是同族元素氢化物中最高的,其原因是
(4)D 属于
(5)E 的基态原子的电子排布式为
您最近一年使用:0次
2024-04-27更新
|
69次组卷
|
2卷引用:福建省福州第二中学2023-2024学年高二下学期4月期中考试化学试题
解题方法
9 . 硼单质及其化合物有重要的应用。阅读下列材料,回答问题:
硼晶体熔点为2076℃。乙硼烷(B2H6)具有还原性,易水解生成 (一元弱酸);乙硼烷可与
(一元弱酸);乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷( ,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成
,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成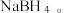
(1)下列说法正确的是_______(填字母)。
(2)根据对角线规则,B的一些化学性质与元素_______ 的相似;B 的空间结构是
的空间结构是_______ 。
(3)硼酸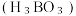 是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。
是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。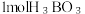 晶体中含有
晶体中含有_______ mol氢键;加热时,硼酸在水中溶解度增大,从结构角度分析,可能的原因为_______ 。
② 与NaOH溶液反应可以制备硼砂
与NaOH溶液反应可以制备硼砂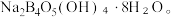 常温下,
常温下, 可以水解生成等物质的量浓度的
可以水解生成等物质的量浓度的 和
和 该水解反应的离子方程式为
该水解反应的离子方程式为_______ 。
(4)氮化硼(BN)晶体有多种相结构。一种立方BN晶体与金刚石结构相似,其晶胞结构如图: 则晶胞中含有BN的个数为
则晶胞中含有BN的个数为_______ (列出计算式,阿伏加德罗常数的数值为
硼晶体熔点为2076℃。乙硼烷(B2H6)具有还原性,易水解生成
 (一元弱酸);乙硼烷可与
(一元弱酸);乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷( ,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成
,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成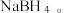
(1)下列说法正确的是_______(填字母)。
| A.元素的电负性大小顺序是O>N>B>H |
B.乙硼烷水解方程式为 |
| C.氨硼烷分子中N提供孤电子对,B提供空轨道形成配位键 |
D.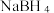 晶体中存在的相互作用有离子键、共价键、氢键 晶体中存在的相互作用有离子键、共价键、氢键 |
 的空间结构是
的空间结构是(3)硼酸
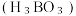 是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。
是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。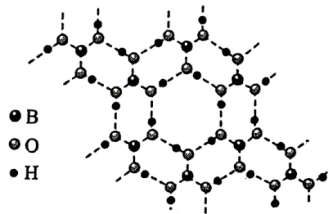
 晶体中含有
晶体中含有②
 与NaOH溶液反应可以制备硼砂
与NaOH溶液反应可以制备硼砂 常温下,
常温下, 可以水解生成等物质的量浓度的
可以水解生成等物质的量浓度的 和
和 该水解反应的离子方程式为
该水解反应的离子方程式为(4)氮化硼(BN)晶体有多种相结构。一种立方BN晶体与金刚石结构相似,其晶胞结构如图:
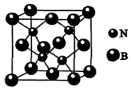
 则晶胞中含有BN的个数为
则晶胞中含有BN的个数为
您最近一年使用:0次
解题方法
10 . 氮、磷、砷等元素的单质及化合物在生产、生活中应用广泛。回答下列问题:
(1)基态砷原子的价层电子的轨道表示式为__________________ 。
(2)基态氮原子核外电子占据的最高能级的原子轨道的形状为_____________ ;氮、磷、砷的简单氢化物 、
、 、
、 的空间结构均为
的空间结构均为__________ 形,键角由大到小的顺序为_________________ (填化学式),分析原因:____________________________ 。
(3) 与N—甲基咪唑(
与N—甲基咪唑( )反应可以得到
)反应可以得到 ,其结构如图所示。
,其结构如图所示。 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则N—甲基咪唑分子中的大
键的电子数,则N—甲基咪唑分子中的大 键可表示为
键可表示为___________ 。
(4)研究发现固态 和
和 均为离子晶体,但结构分别为
均为离子晶体,但结构分别为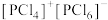 和
和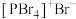 ,分析固态
,分析固态 和
和 结构存在差异的原因:
结构存在差异的原因:___________ 。
下列关于 、
、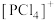 和[
和[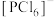 的结构的推断错误的是
的结构的推断错误的是___________ (填标号)。
A.气态 分子中P原子为
分子中P原子为 杂化
杂化
B.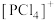 的空间结构为正四面体形
的空间结构为正四面体形
C.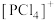 和
和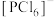 中P原子的杂化类型相同
中P原子的杂化类型相同
(1)基态砷原子的价层电子的轨道表示式为
(2)基态氮原子核外电子占据的最高能级的原子轨道的形状为
 、
、 、
、 的空间结构均为
的空间结构均为(3)
 与N—甲基咪唑(
与N—甲基咪唑( )反应可以得到
)反应可以得到 ,其结构如图所示。
,其结构如图所示。
 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则N—甲基咪唑分子中的大
键的电子数,则N—甲基咪唑分子中的大 键可表示为
键可表示为(4)研究发现固态
 和
和 均为离子晶体,但结构分别为
均为离子晶体,但结构分别为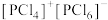 和
和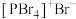 ,分析固态
,分析固态 和
和 结构存在差异的原因:
结构存在差异的原因:下列关于
 、
、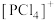 和[
和[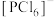 的结构的推断错误的是
的结构的推断错误的是A.气态
 分子中P原子为
分子中P原子为 杂化
杂化B.
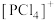 的空间结构为正四面体形
的空间结构为正四面体形C.
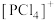 和
和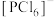 中P原子的杂化类型相同
中P原子的杂化类型相同
您最近一年使用:0次



