名校
解题方法
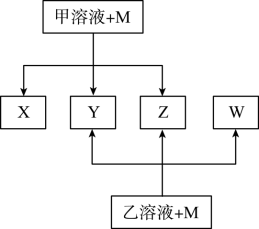
1 . 常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。
②甲、乙是两种酸
③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。
请完成下列空白:
(1)M的化学式为___________
(2)甲的浓溶液需盛放在棕色试剂瓶中,其原因是___________ (用化学方程式表示)。
(3)在X与H2O的反应中,被氧化的X与被还原的X的物质的量之比是___________ 。
(4)欲除去Y中混有的W,下列试剂可供选用的是___________。
(5)写出M与乙的浓溶液在加热条件下反应的化学方程式:___________ 。
(6)工业上运输甲、乙两种浓溶液可选用___________ (金属名称)制运输罐,所选用的金属能做运输罐的理由是___________ 。
②甲、乙是两种酸
③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。
请完成下列空白:
(1)M的化学式为
(2)甲的浓溶液需盛放在棕色试剂瓶中,其原因是
(3)在X与H2O的反应中,被氧化的X与被还原的X的物质的量之比是
(4)欲除去Y中混有的W,下列试剂可供选用的是___________。
| A.品红溶液 | B.酸性高锰酸钾溶液 | C.氢氧化钠溶液 | D.饱和 溶液 溶液 |
(6)工业上运输甲、乙两种浓溶液可选用
您最近一年使用:0次
名校
解题方法
2 . 某些无机物的转化关系(部分反应物和生成物未列出)如图。已知化合物A为常见液体,气体E能使湿润的红色石蕊试纸变蓝。_____________ (填标号)。
a. b.
b.
(2)B、D在常温下难以发生反应,其主要原因为____________ 。
(3)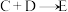 对人类的意义为
对人类的意义为_________________ (任写一点即可)。
(4)少量的E与氯气反应有白雾出现,写出该反应的化学方程式:______________ ;试推测过量的E与氯气反应的现象:_____________ 。
(5)用 溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:
溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:_________________ ,该反应中氧化产物与还原产物的物质的量之比为______________ 。
(6)常温常压下(气体摩尔体积为 ),将
),将 盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为
盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为______________  ,试管中所得溶液的物质的量浓度为
,试管中所得溶液的物质的量浓度为_____________  (用含
(用含 的代数式表示,假设溶质不向试管外扩散)。
的代数式表示,假设溶质不向试管外扩散)。
a.
 b.
b.
(2)B、D在常温下难以发生反应,其主要原因为
(3)
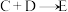 对人类的意义为
对人类的意义为(4)少量的E与氯气反应有白雾出现,写出该反应的化学方程式:
(5)用
 溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:
溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:(6)常温常压下(气体摩尔体积为
 ),将
),将 盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为
盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为 ,试管中所得溶液的物质的量浓度为
,试管中所得溶液的物质的量浓度为 (用含
(用含 的代数式表示,假设溶质不向试管外扩散)。
的代数式表示,假设溶质不向试管外扩散)。
您最近一年使用:0次
2024-05-03更新
|
70次组卷
|
3卷引用:河南省南阳市社旗县第一高级中学2023-2024学年高一下学期4月期中考试化学试题
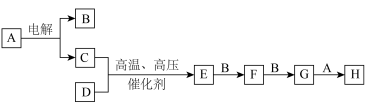
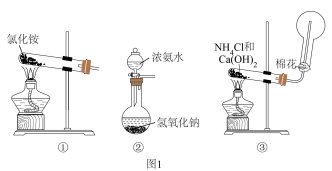
3 . 氮是自然界各种生物体生命活动不可缺少的重要元素,下列物质均含氮元素,回答下列问题:
(1)写出反应①的化学方程式___________ ;
(2)B在催化剂作用下生成C是工业制硝酸的基础,写出反应②的化学方程式___________ ;
(3)工业上用水吸收气体D生产硝酸,写出反应⑤的化学方程式___________ ,若生成标况下的C气体33.6L,转移电子数目为___________ .
(4)从下图1的装置中选择一个可制备B气体的方法___________ ,并写出对应的化学方程式___________ . ___________ ,硝酸的浓度是___________ 。

(1)写出反应①的化学方程式
(2)B在催化剂作用下生成C是工业制硝酸的基础,写出反应②的化学方程式
(3)工业上用水吸收气体D生产硝酸,写出反应⑤的化学方程式
(4)从下图1的装置中选择一个可制备B气体的方法
您最近一年使用:0次
2024-04-30更新
|
128次组卷
|
2卷引用:四川省成都市安宁河联盟2023-2024学年高一下学期期中联考化学试题
名校
4 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号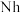 、115号
、115号 、117号
、117号 、118号
、118号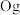 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
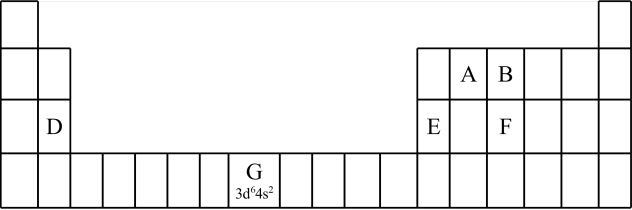
②2017年5月9日我国发布了113号
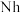 、115号
、115号 、117号
、117号 、118号
、118号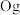 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
2024-04-26更新
|
60次组卷
|
2卷引用:名校期中好题汇编-分子结构与性质(非选择题)
5 . W、X、Y、Z、M、Q是原子序数依次增大的前四周期元素,其元素性质或原子结构如表所示。
(1)W、Z、Q的元素符号分别为_______ 、_______ 、_______ 。
(2)X的基态原子有_______ 种空间运动状态不同的电子,其中能量最高的电子所占据的原子轨道呈_______ 形。
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有_______ 种。[XW4]+的电子式为_______ 。
(4)M位于元素周期表的_______ 区,M3+简化的电子排布式为_______ 。
(5)Q在元素周期表中的位置为_______ ,其价层电子轨道表达式为_______ 。
(6)基态某原子的价层电子排布式为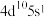 ,推断该元素位于
,推断该元素位于_______ 区。
(7)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成 。
。 与
与 的离子半径大小关系为
的离子半径大小关系为
_______ (填“大于”、“小于”或“等于”) ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是_______ 。
(8)下列各组多电子原子的能级能量比较不正确的是_______ (填序号)。
① ②
② ③
③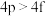 ④
④
| 元素 | 元素性质或原子结构 | ||||||||||||||||||
| W | 电子只有一种自旋取向 | ||||||||||||||||||
| X | 最外层电子排布式为nsnnpn+1 | ||||||||||||||||||
| Y | 非金属元素,且s能级上的电子总数与p能级上的电子总数相等 | ||||||||||||||||||
| Z |
| ||||||||||||||||||
| M | 前四周期元素中原子核外未成对电子数最多 | ||||||||||||||||||
| Q | 基态原子M能层全充满,N层没有成对电子 | ||||||||||||||||||
(2)X的基态原子有
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有
(4)M位于元素周期表的
(5)Q在元素周期表中的位置为
(6)基态某原子的价层电子排布式为
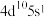 ,推断该元素位于
,推断该元素位于(7)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成
 。
。 与
与 的离子半径大小关系为
的离子半径大小关系为
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是(8)下列各组多电子原子的能级能量比较不正确的是
①
 ②
② ③
③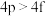 ④
④
您最近一年使用:0次
2024-04-09更新
|
98次组卷
|
2卷引用:江西省南昌市第十九中学2023-2024学年高二上学期期末考试化学试卷
名校
解题方法
6 . 已知五种前四周期的元素X、Y、Z、Q、T。其中,基态X原子的M层上有6种运动状态不同的电子;基态Y原子的简化电子排布式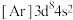 ,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:
,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:
(1)试推断这五种元素的符号:X:_____ ,Y:_____ ,Z:_____ ,Q:_____ ,T:_____ 。
(2)Y在元素周期表中的位置为_____________ 。
(3)基态Z原子的轨道表示式为_____________ 。
(4)对于T原子的p轨道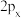 、
、 、
、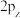 间的差异,下列说法错误的是
间的差异,下列说法错误的是____ (填字母)。
a.电子云形状相同 b.原子轨道的对称类型不同
c.电子的能量不同 d.电子云空间伸展方向不同
(5)Z元素的最高价氧化物对应水化物的电离方程式为______________ 。
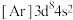 ,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:
,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:(1)试推断这五种元素的符号:X:
(2)Y在元素周期表中的位置为
(3)基态Z原子的轨道表示式为
(4)对于T原子的p轨道
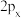 、
、 、
、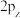 间的差异,下列说法错误的是
间的差异,下列说法错误的是a.电子云形状相同 b.原子轨道的对称类型不同
c.电子的能量不同 d.电子云空间伸展方向不同
(5)Z元素的最高价氧化物对应水化物的电离方程式为
您最近一年使用:0次
2024-04-09更新
|
59次组卷
|
2卷引用:名校期末好题汇编-原子结构与性质(非选择题)
解题方法
7 . A~H都是初中化学中常见的物质,已知其中A、D、G为单质,其余均为化合物;A、B为黑色固体,D、F为红色固体,H的溶液呈蓝色;它们的转化关系如图所示。请回答:

(1)物质B和E的化学式分别为:___________ 、___________ 。
(2)写化学方程式:
反应①:___________ ;
反应③:___________ 。
(3)写一个能实现反应④的化学方程式:___________ 。

(1)物质B和E的化学式分别为:
(2)写化学方程式:
反应①:
反应③:
(3)写一个能实现反应④的化学方程式:
您最近一年使用:0次
8 . 下图中的A~I表示几种初中化学常见的物质,其中A、D、I是氧化物,I中两种元素质量之比为3∶4;B元素在地壳中的含量位居第三;C由三种元素组成;G为紫红色。图中“——”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。

(1)写出G的化学式:
(2)反应①、②和③的基本反应类型相同,该基本反应类型
(3)写出B→A反应的化学方程式:
(4)写出H与D₁反应的化学方程式:
您最近一年使用:0次
名校
解题方法
9 . 前四周期元素  的原子序数依次增大,
的原子序数依次增大, 元素原子
元素原子  电子数等于
电子数等于  电子数的四倍,
电子数的四倍, 元素原子核外的
元素原子核外的  层有3个未成对电子,
层有3个未成对电子, 单质暗处遇
单质暗处遇  发生爆炸,
发生爆炸,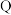 元素单质常温、常压下是气体,
元素单质常温、常压下是气体, 原子的
原子的  层上有1个未成对的
层上有1个未成对的  电子,
电子, 元素价电子层各能级处于半充满状态,
元素价电子层各能级处于半充满状态, 元素的正三价离子的
元素的正三价离子的  轨道为半充满。回答下列问题:
轨道为半充满。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ ,基态  原子中,两种自旋状态的电子数之比
原子中,两种自旋状态的电子数之比___________ 。
(2)基态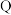 原子有
原子有___________ 种空间运动状态不同的电子,基态  原子的电子占据最高能级的电子云轮廓图为
原子的电子占据最高能级的电子云轮廓图为___________ 形。
(3) 原子半径由大到小的顺序是
原子半径由大到小的顺序是___________ (填元素符号)。
(4)同周期中第一电离能介于 元素与
元素与  元素之间的有
元素之间的有___________ (填元素符号)。
(5) 元素原子的第三电离能比
元素原子的第三电离能比 的第三电离能小的原因是
的第三电离能小的原因是___________ 。
 的原子序数依次增大,
的原子序数依次增大, 元素原子
元素原子  电子数等于
电子数等于  电子数的四倍,
电子数的四倍, 元素原子核外的
元素原子核外的  层有3个未成对电子,
层有3个未成对电子, 单质暗处遇
单质暗处遇  发生爆炸,
发生爆炸,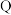 元素单质常温、常压下是气体,
元素单质常温、常压下是气体, 原子的
原子的  层上有1个未成对的
层上有1个未成对的  电子,
电子, 元素价电子层各能级处于半充满状态,
元素价电子层各能级处于半充满状态, 元素的正三价离子的
元素的正三价离子的  轨道为半充满。回答下列问题:
轨道为半充满。回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为 原子中,两种自旋状态的电子数之比
原子中,两种自旋状态的电子数之比(2)基态
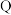 原子有
原子有 原子的电子占据最高能级的电子云轮廓图为
原子的电子占据最高能级的电子云轮廓图为(3)
 原子半径由大到小的顺序是
原子半径由大到小的顺序是(4)同周期中第一电离能介于
 元素与
元素与  元素之间的有
元素之间的有(5)
 元素原子的第三电离能比
元素原子的第三电离能比 的第三电离能小的原因是
的第三电离能小的原因是
您最近一年使用:0次
2024-02-24更新
|
149次组卷
|
2卷引用:名校期末好题汇编-原子结构与性质(非选择题)
10 . W、X、Y为同一周期的四种主族元素,原子序数依次增大。基态Y原子的价电子排布为3s23p4,X的电离能数据如下表所示。
(1)Y在元素周期表中的位置是___________ 。
(2)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
资料:ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为 ,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一,水化物的M—O—H结构中,成键原子电负性差异越大,所形成的化学键越容易断。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响M—O—H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈___________ (填“酸”或“碱”)性,依据是___________ 。
②W和X的最高价氧化物对应的水化物中,碱性较强的是___________ (写化学式),结合资料说明理由:___________ 。
| 电离能 |  |  |  |  | … |
 | 738 | 1451 | 7733 | 10540 | … |
(2)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
资料:ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为
 ,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一,水化物的M—O—H结构中,成键原子电负性差异越大,所形成的化学键越容易断。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响M—O—H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈
②W和X的最高价氧化物对应的水化物中,碱性较强的是
您最近一年使用:0次
2024-02-22更新
|
99次组卷
|
2卷引用:北京市汇文中学2023-2024学年高二上学期期末化学试题



