名校
1 . 铋酸钠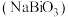 是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,
是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,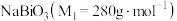 为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;
为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;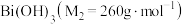 为白色固体,难溶于水。根据实验回答下列问题:
为白色固体,难溶于水。根据实验回答下列问题:_______ 。
(2)装置C中发生反应的离子方程式为_______ 。
(3)装置B的作用为_______ 。
(4)反应结束后,为从装置C中获得尽可能多的产品的操作是_______ 、过滤、洗涤、干燥。
(5) 在酸性介质中可用于
在酸性介质中可用于 的鉴定,已知
的鉴定,已知 被还原为
被还原为 ,其中氧化剂与还原剂的物质的量之比为
,其中氧化剂与还原剂的物质的量之比为_______ 。
(6)取上述 样品
样品 ,加入稀硫酸和
,加入稀硫酸和 溶液使其完全溶解,稀释至
溶液使其完全溶解,稀释至 ,取出
,取出 溶液,然后用新配制的
溶液,然后用新配制的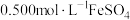 溶液进行滴定,滴定终点的颜色变化为
溶液进行滴定,滴定终点的颜色变化为_______ ,假设终点时消耗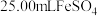 溶液。则该样品中
溶液。则该样品中 纯度为
纯度为_______ %(结果保留小数点后一位)。
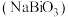 是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,
是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,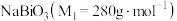 为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;
为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;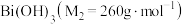 为白色固体,难溶于水。根据实验回答下列问题:
为白色固体,难溶于水。根据实验回答下列问题: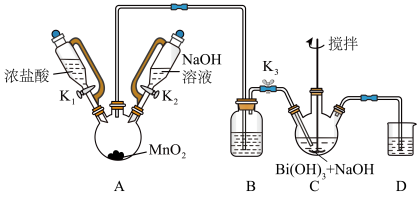
(2)装置C中发生反应的离子方程式为
(3)装置B的作用为
(4)反应结束后,为从装置C中获得尽可能多的产品的操作是
(5)
 在酸性介质中可用于
在酸性介质中可用于 的鉴定,已知
的鉴定,已知 被还原为
被还原为 ,其中氧化剂与还原剂的物质的量之比为
,其中氧化剂与还原剂的物质的量之比为(6)取上述
 样品
样品 ,加入稀硫酸和
,加入稀硫酸和 溶液使其完全溶解,稀释至
溶液使其完全溶解,稀释至 ,取出
,取出 溶液,然后用新配制的
溶液,然后用新配制的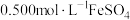 溶液进行滴定,滴定终点的颜色变化为
溶液进行滴定,滴定终点的颜色变化为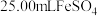 溶液。则该样品中
溶液。则该样品中 纯度为
纯度为
您最近一年使用:0次
名校
解题方法
2 . 碲(Te)常用于冶金工业,也是石油裂解的催化剂。工业上常以碲铜废料(主要成分是 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下: ,
,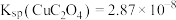 。
。
(1) 中碲元素的化合价为
中碲元素的化合价为_______ 。碲在元素周期表中的位置为_______ 。
(2)“氧化酸浸”得到 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)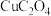 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为_______ 。(保留两位有效数字){已知:反应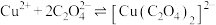 的平衡常数
的平衡常数 }
}
(4)“还原”在 50 ℃条件下进行: ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为_______ 。
(5)“还原”时, 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有_______ 。
(6)将一定质量的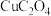 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为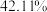 ,则剩余固体的化学式为
,则剩余固体的化学式为_______ 。
 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下:
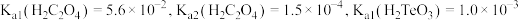 ,
,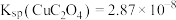 。
。(1)
 中碲元素的化合价为
中碲元素的化合价为(2)“氧化酸浸”得到
 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(3)
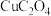 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为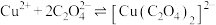 的平衡常数
的平衡常数 }
}(4)“还原”在 50 ℃条件下进行:
 ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为(5)“还原”时,
 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有(6)将一定质量的
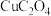 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为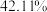 ,则剩余固体的化学式为
,则剩余固体的化学式为
您最近一年使用:0次
名校
3 . 尿素是一种重要化工生产原料。工业上以液氨和二氧化碳为原料,在高温高压条件下直接合成尿素,主要反应如下:
①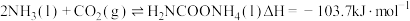
②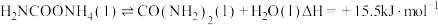
回答下列问题:
(1)
_______  。
。
(2)在 和
和 时
时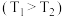 ,向恒容容器中投入等物质的量的两种反应物,发生反应:
,向恒容容器中投入等物质的量的两种反应物,发生反应: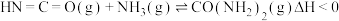 。
。
平衡时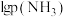 与
与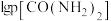 的关系如图所示,
的关系如图所示,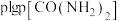 为物质的分压(单位为
为物质的分压(单位为 ),若
),若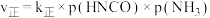 ,
,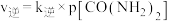 。
。 时,
时,
_______ 。 时此反应的标准平衡常数
时此反应的标准平衡常数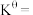
_______ 。{已知:分压 总压
总压 该组分物质的量分数,对于反应:
该组分物质的量分数,对于反应: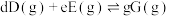 ,其中
,其中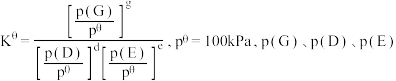 为各组分的平衡分压}
为各组分的平衡分压}_______ 。
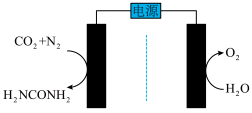
(4)电化学合成尿素为实现碳、氮中和与减轻环境污染提供了一种很有前景的解决方案。某碱性电化学合成系统如图所示,该系统中,合成尿素的一极与电源_______ 相连,其反应方程式为_______ 。
①
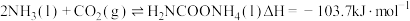
②
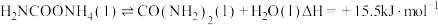
回答下列问题:
(1)

 。
。(2)在
 和
和 时
时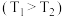 ,向恒容容器中投入等物质的量的两种反应物,发生反应:
,向恒容容器中投入等物质的量的两种反应物,发生反应: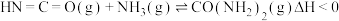 。
。平衡时
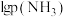 与
与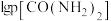 的关系如图所示,
的关系如图所示,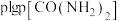 为物质的分压(单位为
为物质的分压(单位为 ),若
),若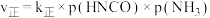 ,
,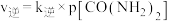 。
。 时,
时,
 时此反应的标准平衡常数
时此反应的标准平衡常数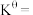
 总压
总压 该组分物质的量分数,对于反应:
该组分物质的量分数,对于反应: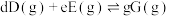 ,其中
,其中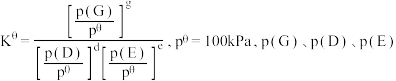 为各组分的平衡分压}
为各组分的平衡分压}
(4)电化学合成尿素为实现碳、氮中和与减轻环境污染提供了一种很有前景的解决方案。某碱性电化学合成系统如图所示,该系统中,合成尿素的一极与电源
您最近一年使用:0次
4 . 现有金属单质 和气体甲、乙、丙以及物质
和气体甲、乙、丙以及物质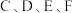 ,它们之间能发生如下反应.(图中有些反应的产物和反应条件没有标出)
,它们之间能发生如下反应.(图中有些反应的产物和反应条件没有标出)
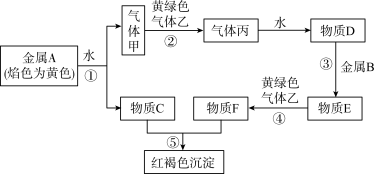
请回答下列问题:
(1)丙的化学式为
(2)A的一种氧化物为淡黄色固体,该物质的化学式为
(3)写出气体乙与石灰乳制漂白粉的化学方程式:
(4)气体甲与气体乙反应时,则可以观察到的现象是:
(5)若将F饱和溶液分别滴入下列物质中加热,能形成胶体的是___________;
| A.冷水 | B.沸水 | C. 浓溶液 浓溶液 | D. 浓溶液 浓溶液 |
(6)实验室制取气体乙的化学方程式为
若要制得标况下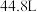 气体乙,则被氧化的丙的物质的量为
气体乙,则被氧化的丙的物质的量为
您最近一年使用:0次
名校
解题方法
5 . 氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:
I. 的制备制备流程图如下:
的制备制备流程图如下:
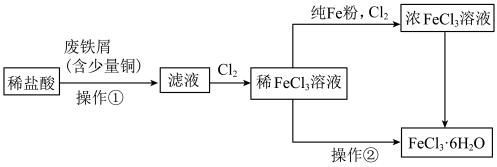
(1)将废铁屑分批加入稀盐酸中,至盐酸反应完全。含有少量铜的废铁屑比纯铁屑反应快,原因为_______ 。
(2)为增大 溶液的浓度,向稀
溶液的浓度,向稀 溶液中加入纯
溶液中加入纯 粉后通入
粉后通入 。此过程中发生的主要反应的离子方程式为
。此过程中发生的主要反应的离子方程式为_______ 。
(3)操作②为_______ 。
II.由 制备无水
制备无水
将 与液体
与液体 混合并加热,制得无水
混合并加热,制得无水 。已知
。已知 沸点为
沸点为 ,反应方程式为:
,反应方程式为: ,装置如下图所示(夹持和加热装置略)。
,装置如下图所示(夹持和加热装置略)。
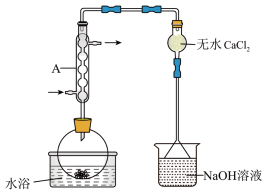
(4)仪器A的名称为_______ ,其作用为_______ 。 溶液的作用是
溶液的作用是_______ 。
(5)干燥管中无水 不能换成碱石灰,原因是
不能换成碱石灰,原因是_______ 。
(6)由下列结晶水合物制备无水盐,适宜使用上述方法的是_______ (填序号)。
a.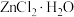 b.
b. c.
c.
I.
 的制备制备流程图如下:
的制备制备流程图如下:
(1)将废铁屑分批加入稀盐酸中,至盐酸反应完全。含有少量铜的废铁屑比纯铁屑反应快,原因为
(2)为增大
 溶液的浓度,向稀
溶液的浓度,向稀 溶液中加入纯
溶液中加入纯 粉后通入
粉后通入 。此过程中发生的主要反应的离子方程式为
。此过程中发生的主要反应的离子方程式为(3)操作②为
II.由
 制备无水
制备无水
将
 与液体
与液体 混合并加热,制得无水
混合并加热,制得无水 。已知
。已知 沸点为
沸点为 ,反应方程式为:
,反应方程式为: ,装置如下图所示(夹持和加热装置略)。
,装置如下图所示(夹持和加热装置略)。
(4)仪器A的名称为
 溶液的作用是
溶液的作用是(5)干燥管中无水
 不能换成碱石灰,原因是
不能换成碱石灰,原因是(6)由下列结晶水合物制备无水盐,适宜使用上述方法的是
a.
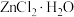 b.
b. c.
c.
您最近一年使用:0次
2024-03-28更新
|
82次组卷
|
2卷引用:湖北省恩施高中2023-2024学年高一下学期入学考试化学试题
名校
解题方法
6 . 将磷肥生产形成的副产物石膏( )转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。石膏转化为硫酸钾和氯化钙的工艺流程示意图如图所示
)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。石膏转化为硫酸钾和氯化钙的工艺流程示意图如图所示
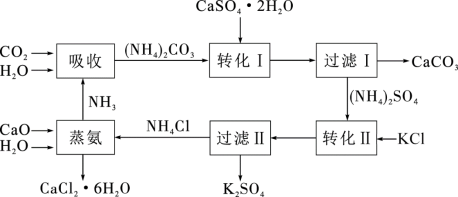
请回答下列问题:
(1)本工艺中所用的原料除 、CaCO3、H2O外,还需要的两种原料是
、CaCO3、H2O外,还需要的两种原料是______ 、______ (填化学式,不考虑损耗)。
(2)室温下, 溶液的pH
溶液的pH______ 7(填“>”、“<”或“=”),该溶液中所有微粒(水分子除外)的物质的量浓度由小到大的顺序为______ 。
(3)转化Ⅰ是将难溶的CaSO4(s)转化为更难溶的CaCO3(s),将一定量的 加入过量的CaSO4悬浊液中,充分反应后,测得溶液中
加入过量的CaSO4悬浊液中,充分反应后,测得溶液中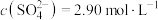 ,此时溶液中的
,此时溶液中的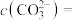
______  。[已知:
。[已知: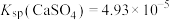 、
、 ]
]
(4)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
75℃的K2SO4饱和溶液482 g冷却到20℃,可析出K2SO4晶体______ g。
(5)写出“蒸氨”过程中的化学方程式:____________________ 。
 )转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。石膏转化为硫酸钾和氯化钙的工艺流程示意图如图所示
)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。石膏转化为硫酸钾和氯化钙的工艺流程示意图如图所示
请回答下列问题:
(1)本工艺中所用的原料除
 、CaCO3、H2O外,还需要的两种原料是
、CaCO3、H2O外,还需要的两种原料是(2)室温下,
 溶液的pH
溶液的pH(3)转化Ⅰ是将难溶的CaSO4(s)转化为更难溶的CaCO3(s),将一定量的
 加入过量的CaSO4悬浊液中,充分反应后,测得溶液中
加入过量的CaSO4悬浊液中,充分反应后,测得溶液中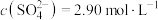 ,此时溶液中的
,此时溶液中的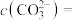
 。[已知:
。[已知: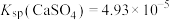 、
、 ]
](4)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
温度/℃ | 0 | 20 | 40 | 60 | 75 |
K2SO4溶解的量/g | 7.7 | 11.1 | 14.7 | 18.1 | 20.5 |
(5)写出“蒸氨”过程中的化学方程式:
您最近一年使用:0次
名校
7 . 无水氯化铁,在空气中极易潮解,加热易升华,常应用于金属蚀刻和污水处理。某化学兴趣小组设计如下实验制备无水氯化铁,并进行其性质探究。回答下列问题:
I.无水氯化铁的制备
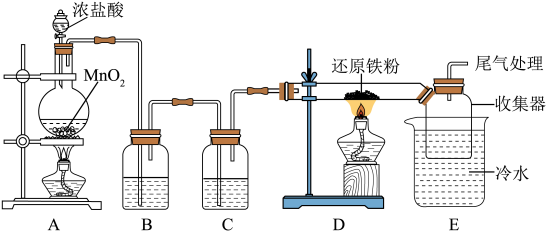
(1)盛装浓盐酸的仪器名称是_______ ,装置B中盛装的药品是_______ ,装置C的作用是_______ 。
(2)装置D中发生反应的化学方程式为_______ 。
(3)装置D、E之间用大口径玻璃管连接的原因是_______ 。
Ⅱ.氯化铁性质探究
(4)取收集器中固体配制成 溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和
溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和_______ 配制溶液时,应先将氯化铁固体溶于较浓的盐酸中,盐酸的作用是_______ 。
(5)向甲、乙两支试管中分别加入 溶液,向甲试管中滴加
溶液,向甲试管中滴加 溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加
溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加
溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加 溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加
溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。
溶液,溶液颜色加深,放置一小时后溶液变为绿色。
①甲试管中产生沉淀的化学式为_______ ,利用平衡移动原理解释产生该沉淀的原因:_______ 。
②甲、乙两支试管中最终溶液都变为绿色,发生反应的离子方程式为_______ 。
I.无水氯化铁的制备

(1)盛装浓盐酸的仪器名称是
(2)装置D中发生反应的化学方程式为
(3)装置D、E之间用大口径玻璃管连接的原因是
Ⅱ.氯化铁性质探究
(4)取收集器中固体配制成
 溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和
溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和(5)向甲、乙两支试管中分别加入
 溶液,向甲试管中滴加
溶液,向甲试管中滴加 溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加
溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加
溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加 溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加
溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。
溶液,溶液颜色加深,放置一小时后溶液变为绿色。①甲试管中产生沉淀的化学式为
②甲、乙两支试管中最终溶液都变为绿色,发生反应的离子方程式为
您最近一年使用:0次
2024-03-02更新
|
121次组卷
|
2卷引用:湖北省恩施州高中教育联盟2023-2024学年高二上学期期末考试化学试题
8 .  是周期表中
是周期表中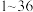 号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
(1) 的电子式为
的电子式为______________ , 中含有的化学键类型为
中含有的化学键类型为______________ .
(2)B、C两种元素的第三电离能由大到小的顺序为______________ (填元素符号)
(3)E在元素周期表中位置为______________ ,位于元素周期表的______________ 区.
(4)比较:①键角大小: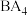
______________  ;②在水中的溶解性大小
;②在水中的溶解性大小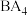
______________  ;
;
 是周期表中
是周期表中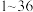 号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.(1)
 的电子式为
的电子式为 中含有的化学键类型为
中含有的化学键类型为(2)B、C两种元素的第三电离能由大到小的顺序为
(3)E在元素周期表中位置为
(4)比较:①键角大小:
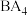
 ;②在水中的溶解性大小
;②在水中的溶解性大小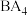
 ;
;
您最近一年使用:0次
名校
9 .  是生产金属钛及其化合物的重要中间体。工业上以高钛渣(主要成分是
是生产金属钛及其化合物的重要中间体。工业上以高钛渣(主要成分是 )为原料生产
)为原料生产 的反应原理为:
的反应原理为: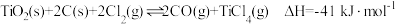 。回答下列问题:
。回答下列问题:
(1)已知: ,
,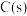 的燃烧热为
的燃烧热为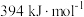 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(2) 时,将足量的
时,将足量的 和C加入一恒容密闭容器中,并通入一定量的
和C加入一恒容密闭容器中,并通入一定量的 和
和 的混合气体,
的混合气体, 不参与化学反应。容器中只发生反应:
不参与化学反应。容器中只发生反应: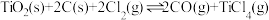 ,测得容器中的总压强(p总压)与
,测得容器中的总压强(p总压)与 的转化率(
的转化率( )随时间的变化关系如图所示:
)随时间的变化关系如图所示:
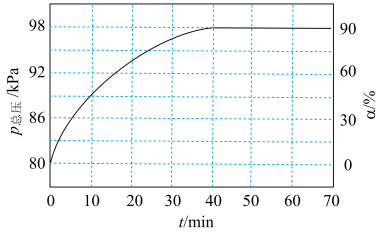
① 时,该反应的平衡常数
时,该反应的平衡常数
_______  (分压=总压×物质的量分数)。
(分压=总压×物质的量分数)。
②保持温度和起始总压相同,若向恒容密闭容器中通入的 不含
不含 ,与含
,与含 相比,
相比, 的平衡转化率将
的平衡转化率将_______ (填“>”“=”或“<”)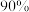 ,其原因是
,其原因是_______ 。
(3)利用 制得
制得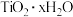 ,焙烧
,焙烧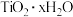 可得纳米
可得纳米 。书写用
。书写用 溶液制备
溶液制备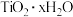 反应的化学方程式:
反应的化学方程式:_______ 。
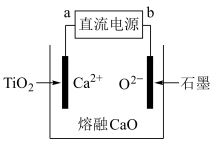
(4)电解法生产钛的原理如图所示,电解过程中,被还原的 进一步还原
进一步还原 得到钛。其中,直流电源a为
得到钛。其中,直流电源a为_______ (填“正”或“负”)极,用化学用语表示制钛的过程:_______ 、_______ 。石墨电极需要定期更换的原因是_______ 。
 是生产金属钛及其化合物的重要中间体。工业上以高钛渣(主要成分是
是生产金属钛及其化合物的重要中间体。工业上以高钛渣(主要成分是 )为原料生产
)为原料生产 的反应原理为:
的反应原理为: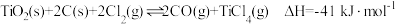 。回答下列问题:
。回答下列问题:(1)已知:
 ,
,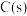 的燃烧热为
的燃烧热为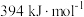 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)
 时,将足量的
时,将足量的 和C加入一恒容密闭容器中,并通入一定量的
和C加入一恒容密闭容器中,并通入一定量的 和
和 的混合气体,
的混合气体, 不参与化学反应。容器中只发生反应:
不参与化学反应。容器中只发生反应: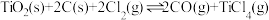 ,测得容器中的总压强(p总压)与
,测得容器中的总压强(p总压)与 的转化率(
的转化率( )随时间的变化关系如图所示:
)随时间的变化关系如图所示:
①
 时,该反应的平衡常数
时,该反应的平衡常数
 (分压=总压×物质的量分数)。
(分压=总压×物质的量分数)。②保持温度和起始总压相同,若向恒容密闭容器中通入的
 不含
不含 ,与含
,与含 相比,
相比, 的平衡转化率将
的平衡转化率将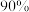 ,其原因是
,其原因是(3)利用
 制得
制得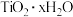 ,焙烧
,焙烧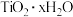 可得纳米
可得纳米 。书写用
。书写用 溶液制备
溶液制备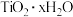 反应的化学方程式:
反应的化学方程式:(4)电解法生产钛的原理如图所示,电解过程中,被还原的
 进一步还原
进一步还原 得到钛。其中,直流电源a为
得到钛。其中,直流电源a为
您最近一年使用:0次
名校
解题方法
10 . 2-噻吩乙醇( )是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
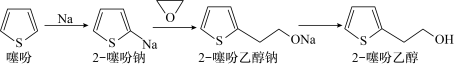
Ⅰ.制钠砂。向烧瓶中加入300 mL液体A和4.60 g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10℃,加入25 mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30 min。
Ⅳ.水解。恢复室温,加入70 mL水,搅拌30 min;加盐酸调pH至4~6,继续反应2 h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后得到产品17.92 g。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择______
a.乙醇 b.水 c.甘油 d.甲苯
(2)噻吩沸点低于吡咯(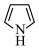 )的原因是
)的原因是____________________
(3)步骤Ⅱ的化学方程式为____________________
(4)步骤Ⅲ涉及的反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是______
(5)步骤Ⅳ中用盐酸调节pH的目的是______
(6)下列仪器在步骤Ⅴ中不需使用的是______ (填名称)

(7)产品的产率为______ (用Na计算,精确至0.1%)。
 )是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
Ⅰ.制钠砂。向烧瓶中加入300 mL液体A和4.60 g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10℃,加入25 mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30 min。
Ⅳ.水解。恢复室温,加入70 mL水,搅拌30 min;加盐酸调pH至4~6,继续反应2 h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后得到产品17.92 g。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择
a.乙醇 b.水 c.甘油 d.甲苯
(2)噻吩沸点低于吡咯(
 )的原因是
)的原因是(3)步骤Ⅱ的化学方程式为
(4)步骤Ⅲ涉及的反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是
(5)步骤Ⅳ中用盐酸调节pH的目的是
(6)下列仪器在步骤Ⅴ中不需使用的是

(7)产品的产率为
您最近一年使用:0次



