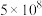23-24高三下·陕西西安·阶段练习
解题方法
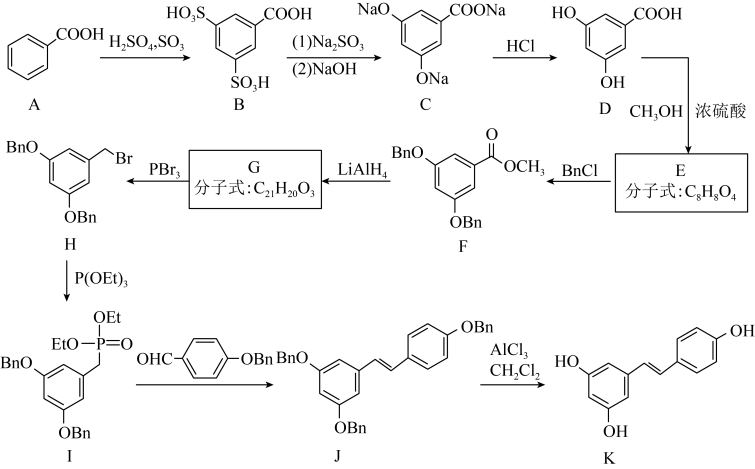
1 . 白藜芦醇(化合物K)有抗氧化、抗炎及保护心血管等作用,以下是一种合成白藜芦醇的路线:_______ ;B的分子式为_______ 。
(2)D生成E的化学方程式为_______ 。
(3)E生成F的反应类型为_______ 。
(4)G的结构简式为_______ 。
(5)H中官能团的名称是_______ 。
(6)满足下列条件的E的同分异构体有_______ 种(不考虑立体异构);
①苯环上有3个取代基,其中2个为羟基;
②官能团种类和数目与E相同。
其中,核磁共振氢谱显示4组峰,且峰面积比为3:2:2:1的同分异构体结构简式为_______ (任写一种)。
已知: ,
, 。
。
(2)D生成E的化学方程式为
(3)E生成F的反应类型为
(4)G的结构简式为
(5)H中官能团的名称是
(6)满足下列条件的E的同分异构体有
①苯环上有3个取代基,其中2个为羟基;
②官能团种类和数目与E相同。
其中,核磁共振氢谱显示4组峰,且峰面积比为3:2:2:1的同分异构体结构简式为
您最近一年使用:0次
23-24高三下·陕西西安·阶段练习
解题方法
2 . CdS、ZnS等硫化物与TiO2、SnO2、ZnO等进行复合,可以得到性能很好的复合半导体光催化剂。回答下列问题:
(1)Sn与C同主族,基态Sn原子的价层电子排布式为_______ ,基态Ti原子核外电子有_______ 种空间运动状态, 核外未成对电子数为
核外未成对电子数为_______ ,ZnS、ZnO中各元素的电负性由大到小的顺序为_______ 。
(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。_______ ;图2中N原子会和B原子形成配位键,成键时_______ (填元素符号)原子提供空轨道。
(3)N、O、F三种元素的第一电离能由大到小的顺序为_______ (填元素符号),解释其原因:_______ 。
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。_______ 。
②若晶胞参数为anm,该晶体的密度为_______ g (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Sn与C同主族,基态Sn原子的价层电子排布式为
 核外未成对电子数为
核外未成对电子数为(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。

(3)N、O、F三种元素的第一电离能由大到小的顺序为
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是
 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。
②若晶胞参数为anm,该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
3 . 四氯化锡(SnCl4)常用作分析试剂、有机合成脱水剂等。设计如下装置制备SnCl4.
②装置D中发生反应:Sn+2Cl2 SnCl4.
SnCl4.
回答下列问题:
(1)装置A中反应的化学方程式为______ ,若反应中消耗1molMnO2,则生成Cl2的体积为______ L(标准状况下)。
(2)实验前,应进行的操作是______ 。
(3)装置B、C所盛装的试剂分别是______ 、______ (填字母),装置F的作用是______ 。
a.饱和食盐水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.碱石灰 e.无水硫酸铜 f.无水氯化钙
(4)装置E中使用冰水浴的目的是______ 。
(5)常温下,装置G中发生反应的离子方程式为______ 。
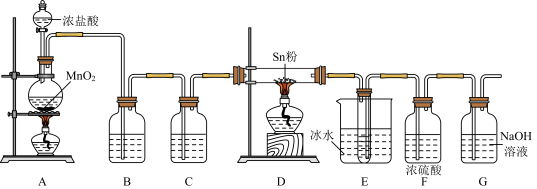
②装置D中发生反应:Sn+2Cl2
 SnCl4.
SnCl4.回答下列问题:
(1)装置A中反应的化学方程式为
(2)实验前,应进行的操作是
(3)装置B、C所盛装的试剂分别是
a.饱和食盐水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.碱石灰 e.无水硫酸铜 f.无水氯化钙
(4)装置E中使用冰水浴的目的是
(5)常温下,装置G中发生反应的离子方程式为
您最近一年使用:0次
2024-04-13更新
|
193次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
解题方法
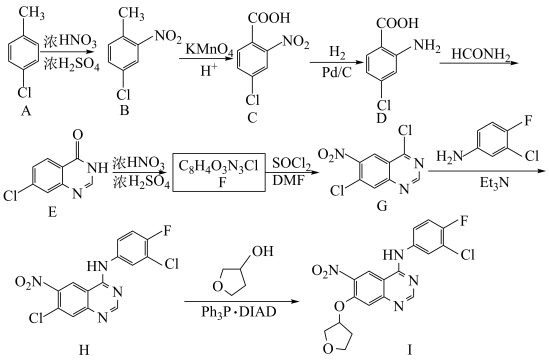
4 . 化合物I是制备抗肿瘤药物阿法替尼的重要中间体,化合物I的一种合成路线如图。
已知:RCH=NH RCH2NH2
RCH2NH2
回答下列问题:
(1)C中含氧官能团的名称是_______ 。
(2)A的化学名称为_______ 。
(3)F的结构简式为_______ ,H→I的反应类型为_______ 。
(4)G→H的化学方程式为_______ 。
(5) 有多种同分异构体,符合下列条件的有
有多种同分异构体,符合下列条件的有_______ 种(不考虑立体异构),其中核磁共振氢谱有3组峰,其峰面积比为6:1:1的结构简式为_______ (写出一种)。
a.能发生银镜反应 b.不含醚键

已知:RCH=NH
 RCH2NH2
RCH2NH2回答下列问题:
(1)C中含氧官能团的名称是
(2)A的化学名称为
(3)F的结构简式为
(4)G→H的化学方程式为
(5)
 有多种同分异构体,符合下列条件的有
有多种同分异构体,符合下列条件的有a.能发生银镜反应 b.不含醚键
您最近一年使用:0次
5 . 一氧化二氯( )可用作氯化剂,其部分性质如下:
)可用作氯化剂,其部分性质如下:
实验室制备原理: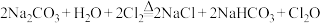
现用如图所示装置设计实验制备少量 ,并探究相关物质的性质。
,并探究相关物质的性质。

(1)装置A中仪器X的名称为________ ,写出装置A中的反应方程式________ 。
(2)若气体从左至右流动,则装置的连接顺序是A、________ 。(每个装置限用一次)
(3)装置F中盛装试剂的名称为________ 。装置E中无水氯化钙的作用________ 。
(4)装置中浓硫酸的作用________ 。写出 与
与 反应的离子方程式
反应的离子方程式________ 。
(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:________ 。
(6)已知 与水反应生成次氯酸,则D中
与水反应生成次氯酸,则D中 进入E的化学方程式
进入E的化学方程式________ 。
 )可用作氯化剂,其部分性质如下:
)可用作氯化剂,其部分性质如下:物理性质 | 化学性质 |
常温下, |
|
现用如图所示装置设计实验制备少量
 ,并探究相关物质的性质。
,并探究相关物质的性质。
(1)装置A中仪器X的名称为
(2)若气体从左至右流动,则装置的连接顺序是A、
(3)装置F中盛装试剂的名称为
(4)装置中浓硫酸的作用
 与
与 反应的离子方程式
反应的离子方程式(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:
(6)已知
 与水反应生成次氯酸,则D中
与水反应生成次氯酸,则D中 进入E的化学方程式
进入E的化学方程式
您最近一年使用:0次
6 . Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。.
①分析数据可知:大气固氮反应属于__________ (填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因:__________ 。
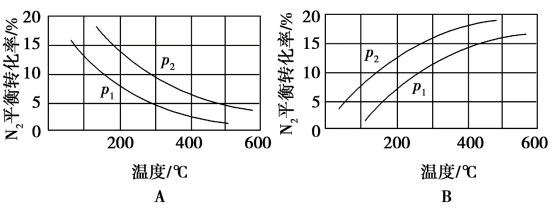
(2)工业固氮反应中,在其他条件相同时,分别测定 的平衡转化率在不同压强(
的平衡转化率在不同压强( 、
、 )下随温度变化的曲线,下图所示的图示中,正确的是
)下随温度变化的曲线,下图所示的图示中,正确的是______ (填“A”或“B”);比较 、
、 的大小关系:
的大小关系:__________ 。
Ⅱ.目前工业合成氨的原理是 。
。
(3)在一定温度下,将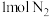 和
和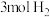 混合置于体积不变的密闭容器中发生反应。
混合置于体积不变的密闭容器中发生反应。
①下列描述能说明反应达到平衡状态的是__________ (填字母)。
A.单位时间内消耗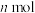 的
的 同时消耗
同时消耗 的
的
B. 、
、 、
、 的浓度相等
的浓度相等
C.混合气体的平均相对分子质量不变
D.混合气体的密度不变
②已知450℃时,某时刻测得 ,
, ,
, ,此时可逆反应
,此时可逆反应__________ 。
A.向正方向进行 B.向逆方向进行 C.处于平衡状态
(1)下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。.
| 反应 | 大气固氮 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
平衡常数K |
| 0.1 |
| 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因:
(2)工业固氮反应中,在其他条件相同时,分别测定
 的平衡转化率在不同压强(
的平衡转化率在不同压强( 、
、 )下随温度变化的曲线,下图所示的图示中,正确的是
)下随温度变化的曲线,下图所示的图示中,正确的是 、
、 的大小关系:
的大小关系:
Ⅱ.目前工业合成氨的原理是
 。
。(3)在一定温度下,将
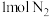 和
和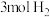 混合置于体积不变的密闭容器中发生反应。
混合置于体积不变的密闭容器中发生反应。①下列描述能说明反应达到平衡状态的是
A.单位时间内消耗
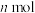 的
的 同时消耗
同时消耗 的
的
B.
 、
、 、
、 的浓度相等
的浓度相等C.混合气体的平均相对分子质量不变
D.混合气体的密度不变
②已知450℃时,某时刻测得
 ,
, ,
, ,此时可逆反应
,此时可逆反应A.向正方向进行 B.向逆方向进行 C.处于平衡状态
您最近一年使用:0次
7 . 某同学用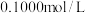 的
的 溶液滴定待测盐酸的浓度。
溶液滴定待测盐酸的浓度。
(1)选用图中仪器__________ (填“A”或“B”)取待测盐酸 于锥形瓶中,滴加2滴酚酞作指示剂,所选仪器在使用前需要
于锥形瓶中,滴加2滴酚酞作指示剂,所选仪器在使用前需要__________ 。

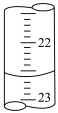
(2)如图是某次滴定时的滴定管中的液面,其读数为__________ mL。
(3)①达到滴定终点的标志是__________ 。
②若出现下列情况,测定结果偏高的是__________ (填字母)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定结束后,俯视液面读数
c.滴定过程中不慎将数滴 溶液滴在锥形瓶外
溶液滴在锥形瓶外
d.碱式滴定管在滴定前有气泡,滴定后气泡消失
(4)常温下,若用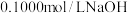 溶液分别滴定
溶液分别滴定 等浓度的盐酸和醋酸溶液,得到两条滴定曲线(已知醋酸钠溶液显碱性),如图所示:
等浓度的盐酸和醋酸溶液,得到两条滴定曲线(已知醋酸钠溶液显碱性),如图所示:
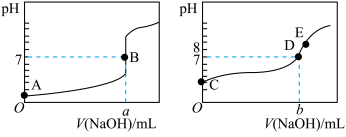
请回答:达到B、D状态时,反应消耗的 溶液的体积a
溶液的体积a______ b(填“>”“<”或“=”)。
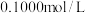 的
的 溶液滴定待测盐酸的浓度。
溶液滴定待测盐酸的浓度。(1)选用图中仪器
 于锥形瓶中,滴加2滴酚酞作指示剂,所选仪器在使用前需要
于锥形瓶中,滴加2滴酚酞作指示剂,所选仪器在使用前需要
(2)如图是某次滴定时的滴定管中的液面,其读数为

(3)①达到滴定终点的标志是
②若出现下列情况,测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定结束后,俯视液面读数
c.滴定过程中不慎将数滴
 溶液滴在锥形瓶外
溶液滴在锥形瓶外d.碱式滴定管在滴定前有气泡,滴定后气泡消失
(4)常温下,若用
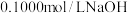 溶液分别滴定
溶液分别滴定 等浓度的盐酸和醋酸溶液,得到两条滴定曲线(已知醋酸钠溶液显碱性),如图所示:
等浓度的盐酸和醋酸溶液,得到两条滴定曲线(已知醋酸钠溶液显碱性),如图所示:
请回答:达到B、D状态时,反应消耗的
 溶液的体积a
溶液的体积a
您最近一年使用:0次
8 . 某同学利用如图1所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
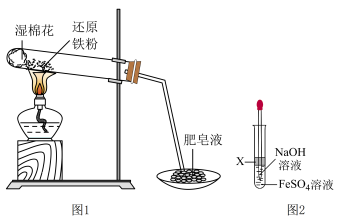
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为________ 。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B。
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分一定含有________ ,可能含有________ ,若溶液未变红色则说明硬质试管中固体物质的成分是________ (均填序号)。
a.Fe b. c.
c. 和Fe
和Fe
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是:________ (用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出上述白色沉淀变成红褐色的化学方程式________ 。
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明 具有
具有________ 性。由此可知,实验室配制含 的盐溶液时应加入少量
的盐溶液时应加入少量________ ,其原因是________ 。

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B。
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分一定含有
a.Fe b.
 c.
c. 和Fe
和Fe(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是:
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出上述白色沉淀变成红褐色的化学方程式
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明
 具有
具有 的盐溶液时应加入少量
的盐溶液时应加入少量
您最近一年使用:0次
名校
9 . 活性氧化锌(ZnO)常用于医药、涂料、陶瓷等。某科研小组以锌废料(主要成分是ZnSO4和ZnO,含少量的Fe、Cu、Pb、As等元素以及油污)为原料制备活性氧化锌及回收其他金属元素,流程如图。
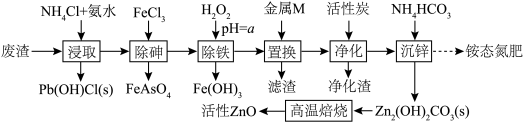
已知几种金属离子生成氢氧化物的pH如下表:
回答下列问题:
(1)As的原子结构示意图为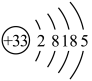 。FeAsO4中铁的化合价为
。FeAsO4中铁的化合价为______ 价。
(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是______ 。
(3)a的范围为______ 。“除铁”时发生氧化还原反应的离子方程式为______ 。
(4)金属M的化学式为______ 。
(5)“沉锌”的滤液采用______ 、______ ,过滤、洗涤、干燥等一系列操作,得到铵态氮肥。
(6)“高温焙烧”过程中发生反应的化学方程式为______ 。

已知几种金属离子生成氢氧化物的pH如下表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 3.7 |
| Zn2+ | 7.9 | 10.0 |
| Fe2+ | 6.3 | 9.7 |
| Cu2+ | 7.4 | 9.4 |
(1)As的原子结构示意图为
 。FeAsO4中铁的化合价为
。FeAsO4中铁的化合价为(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是
(3)a的范围为
(4)金属M的化学式为
(5)“沉锌”的滤液采用
(6)“高温焙烧”过程中发生反应的化学方程式为
您最近一年使用:0次
2024-03-29更新
|
131次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
解题方法
10 . 我国科学家利用锰族催化剂(Mn4CaOx,x代表氧原子数)解密光合作用。锰簇在S3Yz·态的可逆结构异构化如图。
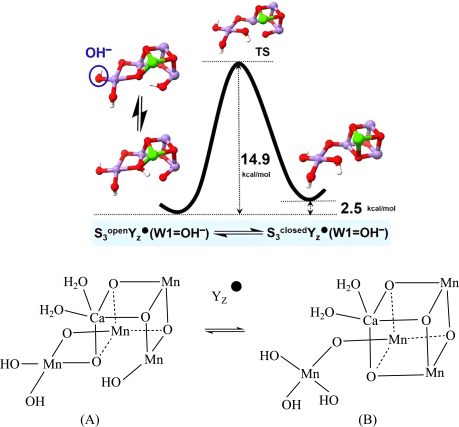
请回答下列问题:
(1)基态锰原子电子排布式为______ 。
(2)锰族催化剂Mn4CaOx中所含元素电负性由大到小的顺序为______ (用元素符号表示),Mn元素位于元素周期表第______ 周期第______ 族。
(3)根据上图可知,稳定性:A______ B(填“>”“<”或“=”)。
(4)1molA含______ molH-Oσ键。
(5)CaO晶胞与NaCl晶胞属于同种类型,如图所示。

①前者的熔点明显高于后者,其主要原因是______ 。
②该晶胞中含有Ca2+的数目为______ ,距离O2-最近的Ca2+的数目有______ 个。
③已知:Ca2+和O2-的核间距为apm,NA为阿伏加德罗常数的值。则CaO晶体密度为______ g/cm3.

请回答下列问题:
(1)基态锰原子电子排布式为
(2)锰族催化剂Mn4CaOx中所含元素电负性由大到小的顺序为
(3)根据上图可知,稳定性:A
(4)1molA含
(5)CaO晶胞与NaCl晶胞属于同种类型,如图所示。

①前者的熔点明显高于后者,其主要原因是
②该晶胞中含有Ca2+的数目为
③已知:Ca2+和O2-的核间距为apm,NA为阿伏加德罗常数的值。则CaO晶体密度为
您最近一年使用:0次
2024-03-29更新
|
259次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题