1 . 氯气是一种重要的工业原料,某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。他们利用该反应设计如图所示制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O。他们利用该反应设计如图所示制取氯气并验证其性质的实验。

回答下列问题:
(1)该实验中A部分的装置是______ (填标号)。
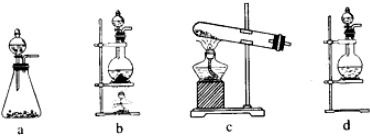
(2)装置B中产生的现象为______ 。
(3)请设计实验验证装置C中的Na2SO3已被氧化______ 。
(4)写出D装置中发生反应的离子方程式______ 。
(5)该实验存在明显的缺陷,请你提出改进的方法______ 。
(6)若将上述装置改为制取SO2并分别验证SO2的漂白性、氧化性和还原性等性质。B中______ 溶液褪色,则说明产生的气体为SO2;C中Na2S溶液出现______ ;D中______ 溶液褪色,说明SO2有还原性。
 2CaSO4+2Cl2↑+2H2O。他们利用该反应设计如图所示制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O。他们利用该反应设计如图所示制取氯气并验证其性质的实验。
回答下列问题:
(1)该实验中A部分的装置是

(2)装置B中产生的现象为
(3)请设计实验验证装置C中的Na2SO3已被氧化
(4)写出D装置中发生反应的离子方程式
(5)该实验存在明显的缺陷,请你提出改进的方法
(6)若将上述装置改为制取SO2并分别验证SO2的漂白性、氧化性和还原性等性质。B中
您最近一年使用:0次
2 . 高铁酸钾( )是一种新型、高效、多功能水处理剂,且不会造成二次污染。
)是一种新型、高效、多功能水处理剂,且不会造成二次污染。
查阅资料:
① 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
② 与
与 溶液在20℃以下反应生成
溶液在20℃以下反应生成 ,在较高温度下则生成
,在较高温度下则生成 。
。
(1)实验室常利用氯气制备 后与
后与 、
、 反应制备
反应制备 。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是
。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是________ 。
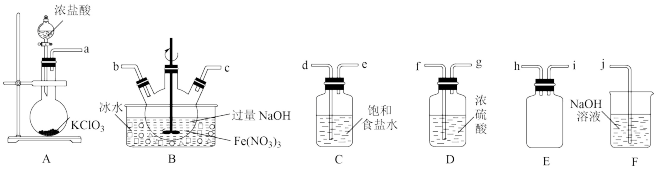
(2)写出装置A中发生反应的离子方程式________ 。
(3)三颈烧瓶用冰水浴的原因是________ ,A处盛放 的仪器名称是
的仪器名称是________ 。
(4)将实验得到的 再加入饱和
再加入饱和 溶液中,可析出紫黑色的
溶液中,可析出紫黑色的 粗晶体,其原因是
粗晶体,其原因是________ 。
(5)用滴定法测定所制粗 的纯度(杂质与
的纯度(杂质与 不反应):取
不反应):取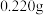 粗
粗 样品,加入足量硫酸酸化的
样品,加入足量硫酸酸化的 溶液,充分反应后,用
溶液,充分反应后,用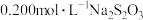 标准溶液滴定生成的I2,滴定消耗标准溶液的体积为
标准溶液滴定生成的I2,滴定消耗标准溶液的体积为 。涉及的反应有:
。涉及的反应有: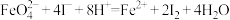 ,
, 。
。
①滴定时选用的指示剂是________ ,滴定终点的现象是________ 。
②制得粗 的纯度是
的纯度是________ 。
 )是一种新型、高效、多功能水处理剂,且不会造成二次污染。
)是一种新型、高效、多功能水处理剂,且不会造成二次污染。查阅资料:
①
 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。②
 与
与 溶液在20℃以下反应生成
溶液在20℃以下反应生成 ,在较高温度下则生成
,在较高温度下则生成 。
。(1)实验室常利用氯气制备
 后与
后与 、
、 反应制备
反应制备 。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是
。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是
(2)写出装置A中发生反应的离子方程式
(3)三颈烧瓶用冰水浴的原因是
 的仪器名称是
的仪器名称是(4)将实验得到的
 再加入饱和
再加入饱和 溶液中,可析出紫黑色的
溶液中,可析出紫黑色的 粗晶体,其原因是
粗晶体,其原因是(5)用滴定法测定所制粗
 的纯度(杂质与
的纯度(杂质与 不反应):取
不反应):取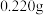 粗
粗 样品,加入足量硫酸酸化的
样品,加入足量硫酸酸化的 溶液,充分反应后,用
溶液,充分反应后,用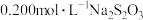 标准溶液滴定生成的I2,滴定消耗标准溶液的体积为
标准溶液滴定生成的I2,滴定消耗标准溶液的体积为 。涉及的反应有:
。涉及的反应有: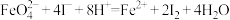 ,
, 。
。①滴定时选用的指示剂是
②制得粗
 的纯度是
的纯度是
您最近一年使用:0次
2020-07-10更新
|
243次组卷
|
2卷引用:西藏拉萨市2020届高三第二次模拟考试理科综合化学试题
3 . 无机物A~C在一定条件下的转化关系如图所示,A为淡黄色的固体化合物,B是地壳中含量最多的金属元素的单质,请回答下列问题:
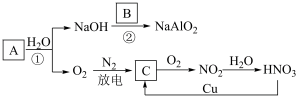
(1)写出A的化学式______ ,C的化学式______ 。
(2)写出稀HNO3与Cu反应生成C的离子方程式________ ;在该反应中,HNO3表现出酸性和强______ (填“氧化性”或“还原性”)。
(3)写出反应②的化学方程式________ 。

(1)写出A的化学式
(2)写出稀HNO3与Cu反应生成C的离子方程式
(3)写出反应②的化学方程式
您最近一年使用:0次
名校
解题方法
4 . 某小组同学用如图所示装置来完成浓硫酸和木炭反应的实验以及检验生成的CO2和SO2气体。
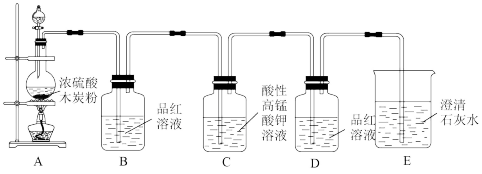
(1)装置A中反生反应的化学方程式为____ 。
(2)装置B中观察到的现象是____ ,说明这种物质具有____ (填“酸性”或“漂白性”)。
(3)装置C中酸性KMnO4溶液用于除去SO2,是利用了SO2具有____ (填“氧化性”或“还原性”),其目的是____ ,装置C中发生的方程式____ 。装置D的作用是____ 。

(1)装置A中反生反应的化学方程式为
(2)装置B中观察到的现象是
(3)装置C中酸性KMnO4溶液用于除去SO2,是利用了SO2具有
您最近一年使用:0次
解题方法
5 . 戴口罩是新冠肺炎疫情常态化防控的措施之一。一次性医用口罩绒布的主要成分是聚丙烯[(C3H6)n],随意丢弃易引起白色污染。某兴趣小组尝试用焚烧法对口罩绒布进行处理,并将燃烧产物用氢氧化钠溶液吸收。
(1)聚丙烯完全燃烧的化学方程式为:2(C3H6)n+9nO2 6nCO2+6nX,X的化学式为
6nCO2+6nX,X的化学式为________ 。
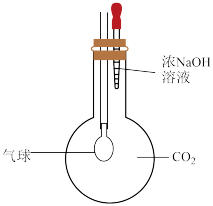
(2)为“看见”CO2与NaOH的反应,甲同学设计了如图所示的实验方案,当观察到______ 现象时,说明两者发生反应。
(3)将完全燃烧后的产物全部通入一定量的氢氧化钠溶液中,得到吸收液。乙同学对吸收液的成分产生兴趣,进行如下探究:
【提出问题】
吸收液中溶质的成分是什么?
【查阅资料】
①Na2CO3、NaHCO3的溶液均呈碱性;CaCl2溶液呈中性。
②NaOH与NaHCO3能反应
③Na2CO3+CaCl2=CaCO3↓+2NaCl
2NaHCO3+CaCl2=CaCO3↓+2NaCl+H2O+CO2↑
【猜想假设】
猜想一:NaOH、Na2CO3
猜想二:________
猜想三:Na2CO3、NaHCO3
猜想四:NaHCO3
【实验探究】
【交流反思】
实验结束后,为了对吸收液进行无害化处理,丙同学向吸收液中加入稀盐酸至不再产生气泡为止。写出其中一个反应的化学方程式:________ 。
(1)聚丙烯完全燃烧的化学方程式为:2(C3H6)n+9nO2
 6nCO2+6nX,X的化学式为
6nCO2+6nX,X的化学式为(2)为“看见”CO2与NaOH的反应,甲同学设计了如图所示的实验方案,当观察到

(3)将完全燃烧后的产物全部通入一定量的氢氧化钠溶液中,得到吸收液。乙同学对吸收液的成分产生兴趣,进行如下探究:
【提出问题】
吸收液中溶质的成分是什么?
【查阅资料】
①Na2CO3、NaHCO3的溶液均呈碱性;CaCl2溶液呈中性。
②NaOH与NaHCO3能反应
③Na2CO3+CaCl2=CaCO3↓+2NaCl
2NaHCO3+CaCl2=CaCO3↓+2NaCl+H2O+CO2↑
【猜想假设】
猜想一:NaOH、Na2CO3
猜想二:
猜想三:Na2CO3、NaHCO3
猜想四:NaHCO3
【实验探究】
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| 1 | 取吸收液少许于试管中,滴加2~3滴无色酚酞溶液 | 溶液呈碱性 | |
| 2 | 向步骤1所得溶液中加入过量的CaCl2溶液 | 产生白色沉淀,溶液为红色 | 猜想 |
实验结束后,为了对吸收液进行无害化处理,丙同学向吸收液中加入稀盐酸至不再产生气泡为止。写出其中一个反应的化学方程式:
您最近一年使用:0次
6 . 钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下:
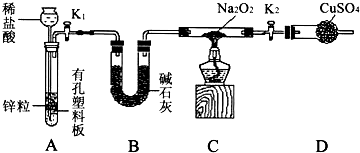
步骤1:按如图组装仪器(图中夹持仪器省略)并检查装置的气密性,然后装入药品;
步骤2:打开K1、K2,产生的氢气在流经装有Na2O2的硬质玻璃管的过程中,没有观察到任何现象;
步骤3:检验完H2的纯度后,点燃酒精灯加热,观察到硬质玻璃管内Na2O2逐渐熔化,淡黄色的粉末慢慢变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1.
根据以上信息回答下列问题:
(1)组装好仪器后,要检查装置的气密性.简述检查K2之前装置气密性的方法________ ;实验室利用A装置还可以制备的气体是________ (写出1种即可).
(2)盛装CuSO4药品的仪器名称是________ ;B装置的作用是________ ;
(3)必须检验氢气纯度的原因是________ ;
(4)设置装置D的目的是________ ;
(5)由上述实验可推出Na2O2与H2反应的化学方程式为________ 。

步骤1:按如图组装仪器(图中夹持仪器省略)并检查装置的气密性,然后装入药品;
步骤2:打开K1、K2,产生的氢气在流经装有Na2O2的硬质玻璃管的过程中,没有观察到任何现象;
步骤3:检验完H2的纯度后,点燃酒精灯加热,观察到硬质玻璃管内Na2O2逐渐熔化,淡黄色的粉末慢慢变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1.
根据以上信息回答下列问题:
(1)组装好仪器后,要检查装置的气密性.简述检查K2之前装置气密性的方法
(2)盛装CuSO4药品的仪器名称是
(3)必须检验氢气纯度的原因是
(4)设置装置D的目的是
(5)由上述实验可推出Na2O2与H2反应的化学方程式为
您最近一年使用:0次
10-11高三·西藏拉萨·阶段练习
名校
7 . 原子序数依次增大的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两种氧化物。
(1)W元素在元素周期表的位置为____________ ,用电子式表示其气态氢化物________ 。
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是_____________ 。
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是______________ 。
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为____________ 。
(1)W元素在元素周期表的位置为
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为
您最近一年使用:0次
8 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?_______________________________________ 。
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
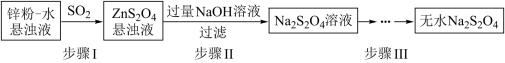
①步骤I中SO2表现了____________ (填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是____________
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥_________ ,才能使Zn(OH)2沉淀完全(已知离子浓度≤1.0×10-5mol·L-1,即沉淀完全;Ksp[Zn(OH)2]=1.0×10-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________ .
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:_________________
____HCOONa+____SO2+___Na2CO3=____Na2S2O4↓+___H2O+______
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。____________________________ .
(1)保险粉应如何保存?
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:

①步骤I中SO2表现了
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:
____HCOONa+____SO2+___Na2CO3=____Na2S2O4↓+___H2O+______
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。
您最近一年使用:0次
2016-12-09更新
|
478次组卷
|
2卷引用:西藏自治区拉萨中学2018届高三上学期第三次月考理综化学试题
9 . 某研究性学习小组利用所示装置探究二氧化硫的性质。(装置中固定仪器未画出)
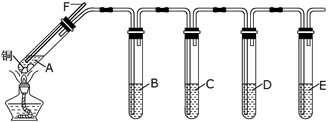
(1)A中所装试剂为铜片和____________ 。(填试剂名称)。
(2)D中试剂为0.5 mol/L BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为_______________ ,证明SO2具有_____________ 性。
(3)装置B用于验证SO2的漂白性,则其中所装溶液可以为______________ 。
(4)实验时,B中溶液褪色,并有大量气泡冒出,但始终未见C中饱和澄清石灰水出现浑浊或沉淀。请推测可能原因,并设计实验验证。
可能原因:___________________________ 。
实验验证:___________________________ 。
(5)E中Na2S溶液用于验证SO2的氧化性,预期观察到的现象为______________________ 。
(6)指出上述装置中一处明显的不足:___________________ 。
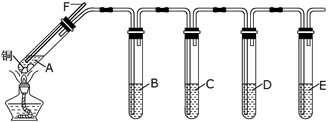
(1)A中所装试剂为铜片和
(2)D中试剂为0.5 mol/L BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为
(3)装置B用于验证SO2的漂白性,则其中所装溶液可以为
| A.酸性高锰酸钾溶液 | B.品红溶液 | C.石蕊试液 | D.蓝色的碘—淀粉溶液 |
可能原因:
实验验证:
(5)E中Na2S溶液用于验证SO2的氧化性,预期观察到的现象为
(6)指出上述装置中一处明显的不足:
您最近一年使用:0次
14-15高二上·山东德州·期中
名校
10 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是___ (用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是___ nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:__ 。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是__ ,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05g。溶液中c(Cl-)=__ mol/L。
(4)若要验证该溶液中含有Fe2+,正确的实验方法是__ 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
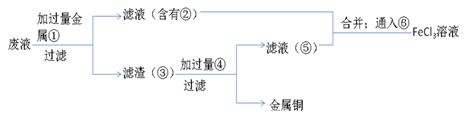
A.请写出上述实验中加入或生成的有关物质的化学式:
①___ ;②___ ;③___ ;④___ 。
B.请写出通入⑥的化学方程式___
(1)所含铁元素既有氧化性又有还原性的物质是
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是
(4)若要验证该溶液中含有Fe2+,正确的实验方法是
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A.请写出上述实验中加入或生成的有关物质的化学式:
①
B.请写出通入⑥的化学方程式
您最近一年使用:0次
2016-12-09更新
|
444次组卷
|
5卷引用:2015-2016学年西藏日喀则高级中学高一上期末化学试卷
2015-2016学年西藏日喀则高级中学高一上期末化学试卷(已下线)2014-2015学年山东省德州市普高高二上学期期中理科化学试卷2014-2015甘肃省天水市一中高一上学期期末考试化学试卷新疆自治区北京大学附属中学新疆分校2019届高三上学期10月月考化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期12月阶段考试化学试题



