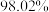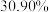名校
解题方法
1 . 随着煤和石油等不可再生能源的日益枯竭,同时在“碳达峰”与“碳中和”可持续发展的目标下,作为清洁能源的天然气受到了广泛的关注。甲烷干重整反应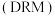 可以将两种温室气体(
可以将两种温室气体( 和
和 )直接转化为合成气(主要成分为
)直接转化为合成气(主要成分为 和
和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。
(1)已知: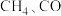 和
和 的燃烧热
的燃烧热 分别为
分别为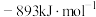 、
、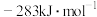 和
和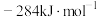 ,则甲烷干重整反应
,则甲烷干重整反应 的
的 为
为___________  。
。
(2)合成气可以用于生成甲醇,在容积为 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,发生反应
,发生反应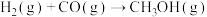 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。 内
内
_____________  ;
; 时改变的条件不可能是
时改变的条件不可能是____________ (填标号)。
A.充入 B.充入
B.充入 C.通入惰性气体
C.通入惰性气体
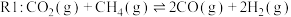 (主反应)
(主反应)
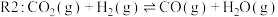
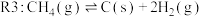
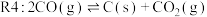
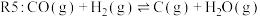
各反应的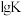 (
( 为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应
为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应____________ (填“升高温度”或“降低温度”),简述判断的理由________________________ 。
(5)在 、温度为
、温度为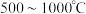 、进料配比
、进料配比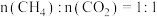 的条件下,甲烷干重整过程中甲烷的转化率、
的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。____________  。
。
②在最佳温度、初始压强 条件下,向某
条件下,向某 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,设只发生
,设只发生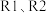 两个反应。达平衡后,测得容器中
两个反应。达平衡后,测得容器中 的浓度为
的浓度为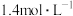 ,
, 的转化率为
的转化率为 ,则此时
,则此时 反应的压强平衡常数
反应的压强平衡常数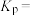
_____________ 。
(列出计算式,压强平衡常数用各组分的平衡分压代替物质的量浓度进行计算,平衡分压 物质的量分数
物质的量分数 平衡总压强)。
平衡总压强)。
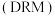 可以将两种温室气体(
可以将两种温室气体( 和
和 )直接转化为合成气(主要成分为
)直接转化为合成气(主要成分为 和
和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。(1)已知:
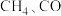 和
和 的燃烧热
的燃烧热 分别为
分别为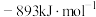 、
、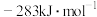 和
和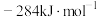 ,则甲烷干重整反应
,则甲烷干重整反应 的
的 为
为 。
。(2)合成气可以用于生成甲醇,在容积为
 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,发生反应
,发生反应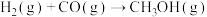 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。 内
内
 ;
; 时改变的条件不可能是
时改变的条件不可能是A.充入
 B.充入
B.充入 C.通入惰性气体
C.通入惰性气体
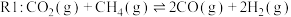 (主反应)
(主反应)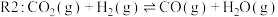
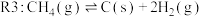
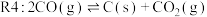
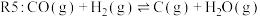
各反应的
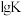 (
( 为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应
为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应
A. 和 和 的转化率相等 的转化率相等 | B.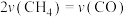 |
C. 的体积分数保持不变 的体积分数保持不变 | D.体系的温度不再变化 |
(5)在
 、温度为
、温度为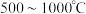 、进料配比
、进料配比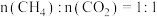 的条件下,甲烷干重整过程中甲烷的转化率、
的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。
 。
。②在最佳温度、初始压强
 条件下,向某
条件下,向某 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,设只发生
,设只发生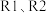 两个反应。达平衡后,测得容器中
两个反应。达平衡后,测得容器中 的浓度为
的浓度为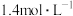 ,
, 的转化率为
的转化率为 ,则此时
,则此时 反应的压强平衡常数
反应的压强平衡常数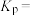
(列出计算式,压强平衡常数用各组分的平衡分压代替物质的量浓度进行计算,平衡分压
 物质的量分数
物质的量分数 平衡总压强)。
平衡总压强)。
您最近一年使用:0次
名校
2 . 用过二硫酸铵 溶液作浸取剂可以提取黄铜矿(主要成分为
溶液作浸取剂可以提取黄铜矿(主要成分为 )中的铜。
)中的铜。
已知:ⅰ.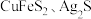 均能导电;
均能导电;
ⅱ.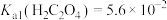 ;
;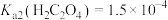 ;
;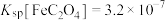
(1) 的晶体中基本结构单元如图1、图2所示。
的晶体中基本结构单元如图1、图2所示。 的配位数为
的配位数为_________ 。
②能够表示 晶胞的是
晶胞的是_____________ 。(填“图1”、“图2”或“图1和图2”)
(2)用 溶液作浸取剂浸取
溶液作浸取剂浸取 的原理示意如图3所示。
的原理示意如图3所示。 与
与 反应的离子方程式为
反应的离子方程式为____________________________ 。
②浸取初期,随着浸取时间延长, 的浸出速率迅速提高,其可能的原因是
的浸出速率迅速提高,其可能的原因是______________ 。
(3)在足量 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:
①添加 可以显著提高
可以显著提高 元素的浸出率的原因:
元素的浸出率的原因:_____________________________ 。
②进一步研究发现添加的少量 可以循环参与反应。
可以循环参与反应。 “再生”的离子方程式为:
“再生”的离子方程式为:______________ 。
(4)进一步从浸出液中提取铜并使 再生并得到相对纯净的
再生并得到相对纯净的 的流程如图所示。
的流程如图所示。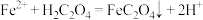 ,该反应化学平衡常数为
,该反应化学平衡常数为______________ 。有同学认为 是二元弱酸,若改用
是二元弱酸,若改用 溶液沉淀效果会更好,你是否同意?
溶液沉淀效果会更好,你是否同意?_____________ (填“是”或“否”)
②生成 的电极反应式是
的电极反应式是_____________________ 。
 溶液作浸取剂可以提取黄铜矿(主要成分为
溶液作浸取剂可以提取黄铜矿(主要成分为 )中的铜。
)中的铜。已知:ⅰ.
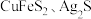 均能导电;
均能导电;ⅱ.
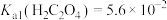 ;
;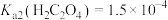 ;
;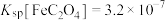
(1)
 的晶体中基本结构单元如图1、图2所示。
的晶体中基本结构单元如图1、图2所示。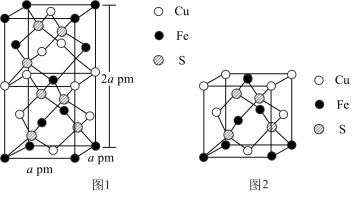
 的配位数为
的配位数为②能够表示
 晶胞的是
晶胞的是(2)用
 溶液作浸取剂浸取
溶液作浸取剂浸取 的原理示意如图3所示。
的原理示意如图3所示。
 与
与 反应的离子方程式为
反应的离子方程式为②浸取初期,随着浸取时间延长,
 的浸出速率迅速提高,其可能的原因是
的浸出速率迅速提高,其可能的原因是(3)在足量
 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:添加 | 图3未加 | |
|
|
|
过程中产物形态 |
|
|
 可以显著提高
可以显著提高 元素的浸出率的原因:
元素的浸出率的原因:②进一步研究发现添加的少量
 可以循环参与反应。
可以循环参与反应。 “再生”的离子方程式为:
“再生”的离子方程式为:(4)进一步从浸出液中提取铜并使
 再生并得到相对纯净的
再生并得到相对纯净的 的流程如图所示。
的流程如图所示。
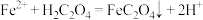 ,该反应化学平衡常数为
,该反应化学平衡常数为 是二元弱酸,若改用
是二元弱酸,若改用 溶液沉淀效果会更好,你是否同意?
溶液沉淀效果会更好,你是否同意?②生成
 的电极反应式是
的电极反应式是
您最近一年使用:0次
名校
解题方法
3 . 一种利用炼锌渣(主要含 、
、 、
、 、
、 和一定量的
和一定量的 、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示: 。
。
(1)基态 的价层电子排布式为
的价层电子排布式为___________ ,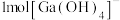 中含有
中含有 键的数目为
键的数目为___________ 。
(2)黄钠铁矾的化学式为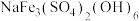 ,晶体颗粒大、易沉降。
,晶体颗粒大、易沉降。
①“沉铁”时生成黄钠铁矾的离子方程式为___________ 。
②不采用调节 的方式沉铁,可能的原因是:
的方式沉铁,可能的原因是: 容易生成
容易生成 而损失;
而损失;___________ (答2点)。
(3)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量 粉,加入铜粉的目的是
粉,加入铜粉的目的是___________ 。
(4) 与
与 的各物种的分布分数随
的各物种的分布分数随 的变化如图所示。“调节
的变化如图所示。“调节 ”时,
”时, 不能过高的原因是
不能过高的原因是___________ 。 。已知:室温时,
。已知:室温时,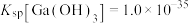 ,
,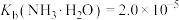 ,
,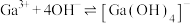
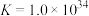 。反应
。反应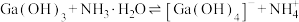 的平衡常数为
的平衡常数为___________ 。
(6)在沉铁前可以加入铁氰化钾检验 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物 ,其晶胞的
,其晶胞的 如图[
如图[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则1个该晶胞含
,则1个该晶胞含___________ 个 ,
,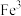 和
和 的最短距离为
的最短距离为___________  (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。
 、
、 、
、 、
、 和一定量的
和一定量的 、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
 。
。(1)基态
 的价层电子排布式为
的价层电子排布式为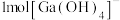 中含有
中含有 键的数目为
键的数目为(2)黄钠铁矾的化学式为
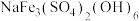 ,晶体颗粒大、易沉降。
,晶体颗粒大、易沉降。①“沉铁”时生成黄钠铁矾的离子方程式为
②不采用调节
 的方式沉铁,可能的原因是:
的方式沉铁,可能的原因是: 容易生成
容易生成 而损失;
而损失;(3)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量
 粉,加入铜粉的目的是
粉,加入铜粉的目的是(4)
 与
与 的各物种的分布分数随
的各物种的分布分数随 的变化如图所示。“调节
的变化如图所示。“调节 ”时,
”时, 不能过高的原因是
不能过高的原因是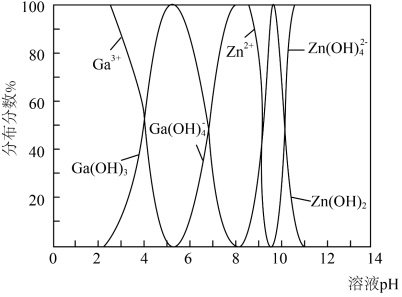
 。已知:室温时,
。已知:室温时,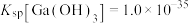 ,
,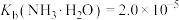 ,
,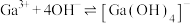
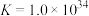 。反应
。反应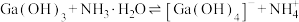 的平衡常数为
的平衡常数为(6)在沉铁前可以加入铁氰化钾检验
 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物 ,其晶胞的
,其晶胞的 如图[
如图[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则1个该晶胞含
,则1个该晶胞含 ,
,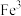 和
和 的最短距离为
的最短距离为 (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。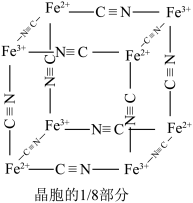
您最近一年使用:0次
名校
解题方法
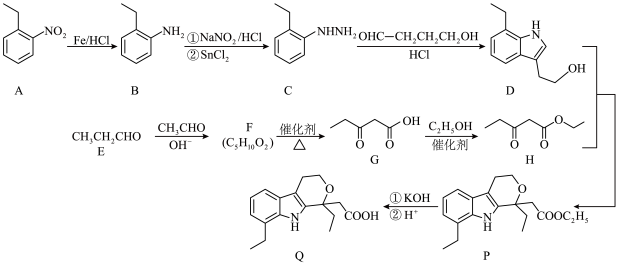
4 . 杂环化合物在药物中广泛存在,依托度酸(etodolac)用于治疗风湿性关节炎、类风湿性关节炎等,具有耐受性好、镇痛作用强等特点,尤其适用于老年患者。以下为其合成路线:
(1)由苯制备物质 ,最好应先引入
,最好应先引入___________ (填“乙基”或“硝基”);物质 中的含氧官能团的名称为
中的含氧官能团的名称为___________ 。
(2) 的系统命名为
的系统命名为___________ ,该物质存在多种同分异构体,其中一定条件下能与 溶液反应的同分异构体有
溶液反应的同分异构体有___________ 种。
(3) 的化学反应方程式为
的化学反应方程式为___________ 。
(4)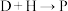 主要经历先
主要经历先___________ 后___________ 两种反应类型, 的另一种产物的结构简式为
的另一种产物的结构简式为___________ 。
(5)在医院里肠杆菌等细菌的鉴定常利用吲哚实验,转换反应式如下: 原子的孤电子对位于
原子的孤电子对位于___________ 轨道;柯氏试剂 化学式为
化学式为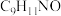 ,该步反应的另一种产物为
,该步反应的另一种产物为 ,则
,则 结构简式为
结构简式为___________ 。

(1)由苯制备物质
 ,最好应先引入
,最好应先引入 中的含氧官能团的名称为
中的含氧官能团的名称为(2)
 的系统命名为
的系统命名为 溶液反应的同分异构体有
溶液反应的同分异构体有(3)
 的化学反应方程式为
的化学反应方程式为(4)
 主要经历先
主要经历先 的另一种产物的结构简式为
的另一种产物的结构简式为(5)在医院里肠杆菌等细菌的鉴定常利用吲哚实验,转换反应式如下:
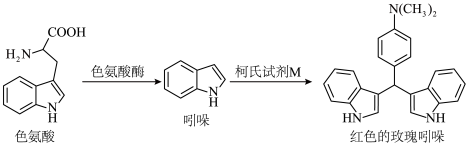
 原子的孤电子对位于
原子的孤电子对位于 化学式为
化学式为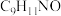 ,该步反应的另一种产物为
,该步反应的另一种产物为 ,则
,则 结构简式为
结构简式为
您最近一年使用:0次
名校
解题方法
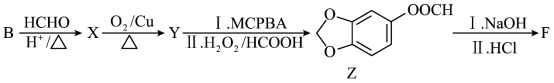
5 . 芝麻酚(F)是良好的低毒抗氧化剂,也是合成治疗高血压、肿瘤等药物的重要中间体。其合成路线如下:
(1)A的名称是_____ 。
(2)C中存在的官能团名称为_____ 。
(3)实验结果表明,B→C过程中2号位取代产物多于1号位取代产物,从物质结构的角度解释原因为_____ 。
(4)C→D的反应类型是_____ 。
(5)G是D的同分异构体,其中符合下列条件的G有_____ 种(不考虑立体异构)。
①能与 溶液发生显色反应;
溶液发生显色反应;
②含有酰胺基。
其中氢核磁共振氢谱有4组峰,峰面积之比为2∶2∶2∶1的结构简式为_____ 。
(6)由B合成F的另一种路径如下:_____ 。
②Y的结构简式为_____ 。

(1)A的名称是
(2)C中存在的官能团名称为
(3)实验结果表明,B→C过程中2号位取代产物多于1号位取代产物,从物质结构的角度解释原因为
(4)C→D的反应类型是
(5)G是D的同分异构体,其中符合下列条件的G有
①能与
 溶液发生显色反应;
溶液发生显色反应;②含有酰胺基。
其中氢核磁共振氢谱有4组峰,峰面积之比为2∶2∶2∶1的结构简式为
(6)由B合成F的另一种路径如下:
②Y的结构简式为
您最近一年使用:0次
名校
6 . 钙及其化合物在生产生活中有着重要的作用。
(1)Ca与Fe属于同一周期元素,且核外最外层电子构型相闰,但Ca的熔、沸点都比Fe低,原因是:________ 。
(2) 与水反应生成的
与水反应生成的 分子中,碳原子杂化轨道类型是
分子中,碳原子杂化轨道类型是________ ,且 中
中 与
与 互为等电子体,
互为等电子体, 中含有的
中含有的 键数目为
键数目为________ 。
(3) 的结构如图甲所示,其中B离子表示
的结构如图甲所示,其中B离子表示________ ,晶体中与 最近且等距离的
最近且等距离的 数目为
数目为________ 。 中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为
中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为________ ,已知该氧化物的密度是 ,则晶胞内最近的两个
,则晶胞内最近的两个 间的距离为
间的距离为________ cm(写出计算式即可)。
(1)Ca与Fe属于同一周期元素,且核外最外层电子构型相闰,但Ca的熔、沸点都比Fe低,原因是:
(2)
 与水反应生成的
与水反应生成的 分子中,碳原子杂化轨道类型是
分子中,碳原子杂化轨道类型是 中
中 与
与 互为等电子体,
互为等电子体, 中含有的
中含有的 键数目为
键数目为(3)
 的结构如图甲所示,其中B离子表示
的结构如图甲所示,其中B离子表示 最近且等距离的
最近且等距离的 数目为
数目为
 中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为
中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为 ,则晶胞内最近的两个
,则晶胞内最近的两个 间的距离为
间的距离为
您最近一年使用:0次
解题方法
7 . 镀锌钢构件的酸洗废液中含有2.5mol。L-1盐酸、50%FeCl2·4H2O和2%ZnCl2。实验室从酸洗废液中回收盐酸和FeCl2·4H2O的实验流程如下:
回答下列问题:
I.回收盐酸和FeCl2·4H2O粗产品
(1)操作1应选择___________ (填序号)。
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl2·4H2O粗产品,应加热至留有少量残余液时立即停止。
①立即停止可以避免Fe2+被氧化外,还能___________ 。
②如果残余液过多,可能会导致___________ 。(答一条)
Ⅱ.FeCl2·4H2O粗产品的重结晶
(3)检验FeCl2·4H2O粗产品中含有Fe3+的操作方法是___________ 。
(4)重结晶前加入的物质X为___________ ;操作2的名称是___________ 。
Ⅲ.滴定亚铁离子,测定FeCl2·4H2O晶体纯度
准确称取ag重结晶后的FeCl2·4H2O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指示剂,用cmol。L-1K2Cr2O7标准溶液滴定至终点,半分钟内不恢复原色,消耗K2Cr2O7标准溶液平均体积为VmL(此时Cl-不被氧化)。(M【FeCl2·4H2O】=199 g·mol-1)
(5)计算FeCl2·4H2O晶体的纯度为___________ %(用含a、c的最简代数式表示)。
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。___________ 。
②亚甲基蓝中N原子的杂化方式有___________ 。
③DMA的碱性比苯胺强,说明理由___________ 。
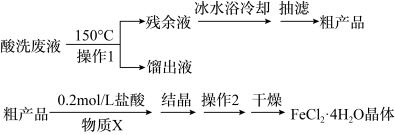
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| FeCl2 | 49.7 | 59.0 | 62.5 | 66.7 | 70.0 | 78.3 | 88.7 | 94.9 |
| ZnCl2 | 342 | 363 | 395 | 437 | 452 | 488 | 541 | 614 |
I.回收盐酸和FeCl2·4H2O粗产品
(1)操作1应选择
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl2·4H2O粗产品,应加热至留有少量残余液时立即停止。
①立即停止可以避免Fe2+被氧化外,还能
②如果残余液过多,可能会导致
Ⅱ.FeCl2·4H2O粗产品的重结晶
(3)检验FeCl2·4H2O粗产品中含有Fe3+的操作方法是
(4)重结晶前加入的物质X为
Ⅲ.滴定亚铁离子,测定FeCl2·4H2O晶体纯度
准确称取ag重结晶后的FeCl2·4H2O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指示剂,用cmol。L-1K2Cr2O7标准溶液滴定至终点,半分钟内不恢复原色,消耗K2Cr2O7标准溶液平均体积为VmL(此时Cl-不被氧化)。(M【FeCl2·4H2O】=199 g·mol-1)
(5)计算FeCl2·4H2O晶体的纯度为
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。

②亚甲基蓝中N原子的杂化方式有
③DMA的碱性比苯胺强,说明理由
您最近一年使用:0次
解题方法
8 . 以辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)和软锰矿(主要成分为MnO2)为原料制备超细氧化铋的工艺流程如下: ,
, 易发生水解,其反应的离子方程式为:
易发生水解,其反应的离子方程式为: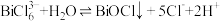 。
。
(1)Bi元素位于第6周期VA族,其价电子轨道表示式为___________ ,BiOCl叫氯氧化铋而不叫次氯酸铋,从化合价角度分析原因为___________ 。
(2)“联合焙烧”时,Bi2S3和MnO2在空气中反应生成Bi2O3和MnSO4.该反应的化学方程式为___________ 。
(3)BiCl 能被有机萃取剂(TBP)苯取,其萃取原理可表示为:
能被有机萃取剂(TBP)苯取,其萃取原理可表示为: 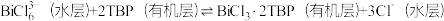 。
。
①“萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图所示。c(Cl-)最佳为1.3mol·L-1的可能原因是___________ 。
②萃取后分液所得水相中的主要阳离子为___________ (填化学式)。___________ 。
(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3·7H2O的质量的比值随温度变化的关系如图所示。400℃时制得超细氧化铋,其化学式为___________ 。(M[Bi2(C2O4)3·7H2O]=808g·mol-1)

 ,
, 易发生水解,其反应的离子方程式为:
易发生水解,其反应的离子方程式为: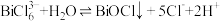 。
。(1)Bi元素位于第6周期VA族,其价电子轨道表示式为
(2)“联合焙烧”时,Bi2S3和MnO2在空气中反应生成Bi2O3和MnSO4.该反应的化学方程式为
(3)BiCl
 能被有机萃取剂(TBP)苯取,其萃取原理可表示为:
能被有机萃取剂(TBP)苯取,其萃取原理可表示为: 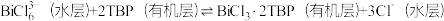 。
。①“萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图所示。c(Cl-)最佳为1.3mol·L-1的可能原因是
②萃取后分液所得水相中的主要阳离子为

(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3·7H2O的质量的比值随温度变化的关系如图所示。400℃时制得超细氧化铋,其化学式为

您最近一年使用:0次
9 . Hoffman降解是二种由酰胺合成氨的方法。县有产率高、纯度高等优点,在合成上有重要应用。一种用Hoffman降解合成普瑞巴林(pregabal)的合成路线:
回答下列问题:
(1)B中官能团的名称为___________ 。
(2)只用一种试剂鉴别A、B、C,该试剂是___________ 。
(3)D→E的反应类型是___________ 。
(4)写出B→C的化学反应方程式___________ 。
(5)写出G的结构简式___________ 。
(6)X是B的同分异构体,分子中含一个五元环。能发生银镜反应,但不能使溴的CCl4溶液褪色,其中1H-NMR谱显示有5组峰,且峰面积之比为4:4:2:1:1的结构简式为___________ 。

回答下列问题:
(1)B中官能团的名称为
(2)只用一种试剂鉴别A、B、C,该试剂是
(3)D→E的反应类型是
(4)写出B→C的化学反应方程式
(5)写出G的结构简式
(6)X是B的同分异构体,分子中含一个五元环。能发生银镜反应,但不能使溴的CCl4溶液褪色,其中1H-NMR谱显示有5组峰,且峰面积之比为4:4:2:1:1的结构简式为
您最近一年使用:0次
解题方法
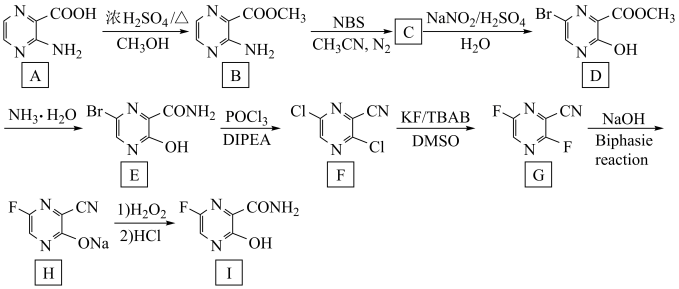
10 . 匹拉韦(有机物Ⅰ)是一种广谱抗病毒仿制药,其含有的环状结构与苯的共辄结构类似。一种合成法匹拉韦的路线如图所示: ;
;
②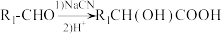 ;
;
③化合物F、G不易分离,萃取剂的极性过大则常得到黑色糊状物,过小则萃取率不高。
回答下列问题:
(1)化合物B中含氧官能团的名称为________ 。
(2)C的结构简式为________________ ,其分子中 杂化的C原子个数是
杂化的C原子个数是________ ;F到G的反应类型为________________ 。
(3)D的同分异构体J满足下列条件:
①J能发生水解反应且可以发生银镜反应;
②J的 谱峰面积之比为
谱峰面积之比为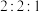 ;
;
③J含有两种含氧官能团,不存在两个氧原子相连或氧原子与溴原子相连的情况;________________ 。(写出其中一种)
(4)请写出G到H的化学方程式________________ ,本工艺与传统工艺相比,不同之处即在G到H这一步:进行此步骤前将萃取剂由正己烷/乙酸乙酯换为甲苯,反应时将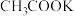 或
或 换为
换为 ,请从产率与经济性的角度分析本工艺的优点:
,请从产率与经济性的角度分析本工艺的优点:________________ ;________________ 。
(5)根据已有知识并结合相关信息,将以A为原料制备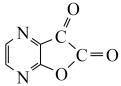 的部分合成路线如下:
的部分合成路线如下:
①最后一步反应中,有机反应物的结构简式为________________ 。
②从起始原料出发,第三步反应的反应条件为________________ 。
 ;
;②
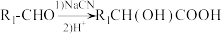 ;
;③化合物F、G不易分离,萃取剂的极性过大则常得到黑色糊状物,过小则萃取率不高。
回答下列问题:
(1)化合物B中含氧官能团的名称为
(2)C的结构简式为
 杂化的C原子个数是
杂化的C原子个数是(3)D的同分异构体J满足下列条件:
①J能发生水解反应且可以发生银镜反应;
②J的
 谱峰面积之比为
谱峰面积之比为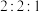 ;
;③J含有两种含氧官能团,不存在两个氧原子相连或氧原子与溴原子相连的情况;
④J含有环状结构 。
。
(4)请写出G到H的化学方程式
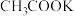 或
或 换为
换为 ,请从产率与经济性的角度分析本工艺的优点:
,请从产率与经济性的角度分析本工艺的优点:(5)根据已有知识并结合相关信息,将以A为原料制备
 的部分合成路线如下:
的部分合成路线如下: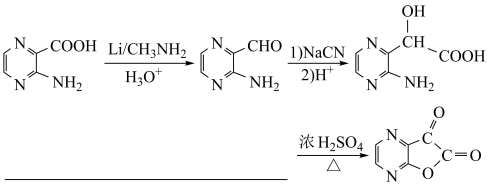
①最后一步反应中,有机反应物的结构简式为
②从起始原料出发,第三步反应的反应条件为
您最近一年使用:0次