1 . 元素周期表是学习和研究化学科学的主要工具。下表是元素周期表的一部分,按要求作答。
(1)元素a位于周期表中第___________ 周期___________ 族。
(2)元素b属于___________ (填“金属”或“非金属”)元素,它的最高化合价是___________ 。
(3)碳的原子结构示意图为___________ 。
(4)地壳中含量最多的元素是___________ 。
(5)O与S中,原子半径较大的是___________ 。
(6) 与
与 中,热稳定性较弱的是
中,热稳定性较弱的是___________ 。
(7) 与
与 中,酸性较弱的是
中,酸性较弱的是___________ 。
(8)LiOH、 和KOH中,碱性最强的是
和KOH中,碱性最强的是___________ ,呈两性的是___________ 。
(9)元素Ca和Cl形成化合物的化学式是___________ ,化学键类型是___________ 。
(10)元素硒(Se)与硫位于同一主族,预测硒及其化合物具有的性质___________(填标号)。
族 周期 |  A A |  A A |  A A |  A A | 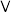 A A |  A A | 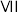 A A |
| 2 | Li | C | O | a | |||
| 3 | b | Al | Si | P | S | Cl | |
| 4 | K | Ca |
(2)元素b属于
(3)碳的原子结构示意图为
(4)地壳中含量最多的元素是
(5)O与S中,原子半径较大的是
(6)
 与
与 中,热稳定性较弱的是
中,热稳定性较弱的是(7)
 与
与 中,酸性较弱的是
中,酸性较弱的是(8)LiOH、
 和KOH中,碱性最强的是
和KOH中,碱性最强的是(9)元素Ca和Cl形成化合物的化学式是
(10)元素硒(Se)与硫位于同一主族,预测硒及其化合物具有的性质___________(填标号)。
A. 只具有氧化性 只具有氧化性 | B.Se的非金属性比S强 |
| C.其单质在常温下呈气态 | D.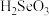 能与NaOH溶液发生反应 能与NaOH溶液发生反应 |
您最近一年使用:0次
2 . 某化学兴趣小组将制丝插入热浓硫酸中,进行如下图所示的 性质的探究实验。(a、b、c、d均为没有相应浴液的棉花,部分夹持仪器已略去)
性质的探究实验。(a、b、c、d均为没有相应浴液的棉花,部分夹持仪器已略去)_______ 。
(2)铜丝与热浓硫酸反应的化学方程式为_______ 。
(3)实验进行一段时间后:
①a处实验现象为_______ 。
②b处品红溶液褪色,原因是_______ 。
③c处酸性 溶液褪色,证明
溶液褪色,证明 具有
具有_______ 性。
④d处NaOH溶液的作用是_______ ,写出反应的离子方程式:_______ 。
(4)该实验装置中使用可抽动铜丝的优点是_______ 。
 性质的探究实验。(a、b、c、d均为没有相应浴液的棉花,部分夹持仪器已略去)
性质的探究实验。(a、b、c、d均为没有相应浴液的棉花,部分夹持仪器已略去)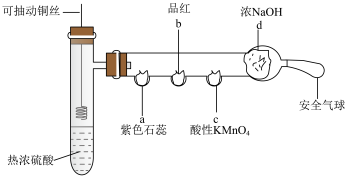
(2)铜丝与热浓硫酸反应的化学方程式为
(3)实验进行一段时间后:
①a处实验现象为
②b处品红溶液褪色,原因是
③c处酸性
 溶液褪色,证明
溶液褪色,证明 具有
具有④d处NaOH溶液的作用是
(4)该实验装置中使用可抽动铜丝的优点是
您最近一年使用:0次
2024-03-29更新
|
134次组卷
|
2卷引用:2023年6月福建省普通高中学业水平合格性考试化学试题
3 . 锰及其化合物在工业生产中具有重要用途。某兴趣小组用软锰矿(主要成分是 ,含少量
,含少量 、
、 )和黄铁矿(主要成分是
)和黄铁矿(主要成分是 ,含少量)为原料制备
,含少量)为原料制备 ,实验流程如下:
,实验流程如下: 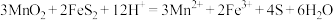
(1)与稀硫酸反应前,将黄铁矿和软锰矿混合研磨的目的是_______ 。
(2)离子反应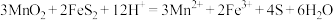 中,被氧化的元素是
中,被氧化的元素是_______ 和_______ 。
(3)步骤(Ⅰ)中分离溶液和沉淀的操作名称是_______ ,所需要的玻璃仪器除烧杯和玻璃棒外,还需要_______ 。
(4)步骤(Ⅱ)中加入NaOH溶液调节pH,是为了完全沉淀 、
、 ,写出生成
,写出生成 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
(5)将步骤(Ⅲ)中发生反应的离子方程式补充完整:______ 。
 _______
_______
 ,含少量
,含少量 、
、 )和黄铁矿(主要成分是
)和黄铁矿(主要成分是 ,含少量)为原料制备
,含少量)为原料制备 ,实验流程如下:
,实验流程如下: 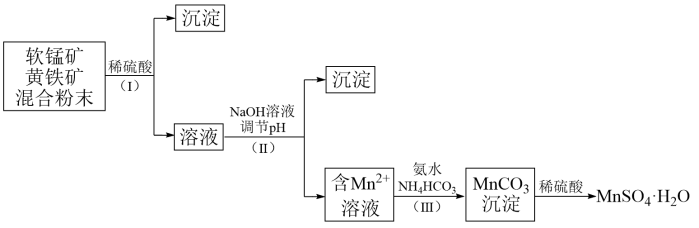
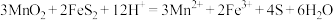
(1)与稀硫酸反应前,将黄铁矿和软锰矿混合研磨的目的是
(2)离子反应
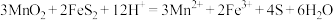 中,被氧化的元素是
中,被氧化的元素是(3)步骤(Ⅰ)中分离溶液和沉淀的操作名称是
(4)步骤(Ⅱ)中加入NaOH溶液调节pH,是为了完全沉淀
 、
、 ,写出生成
,写出生成 沉淀的离子方程式:
沉淀的离子方程式:(5)将步骤(Ⅲ)中发生反应的离子方程式补充完整:
 _______
_______
您最近一年使用:0次
2024-03-29更新
|
153次组卷
|
2卷引用:2023年6月福建省普通高中学业水平合格性考试化学试题
名校
解题方法
4 . 某化学兴趣小组利用如图装置制取并探究二氧化疏的性质。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)
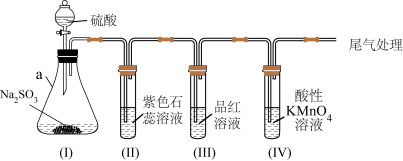
【实验探究】
(1)装置(I)仪器a的名称是___________ 。
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为___________ ,写出相关的化学方程式___________ 。
②装置(III)中品红溶液________ ,原因是________ ,加热后,溶液又恢复_________ ,可用于检验SO2。
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有___________ (填“氧化性”或“还原性”)。
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式___________ 。
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为___________ L。(已知Na2SO3的摩尔质量为126g•mol-1)
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2___________ +4H+=3S↓+2H2O。
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和___________ (填“氧化剂”或“抗氧化剂”)。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)

【实验探究】
(1)装置(I)仪器a的名称是
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为
②装置(III)中品红溶液
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g∙kg-1 | 0.25g∙kg-1 | 1g∙kg-1 |
您最近一年使用:0次
解题方法
5 . 碳、氮的单质及其化合物在生产和生活中有广泛应用。
(1)已知在298K时,C(石墨)完全燃烧的热化学方程式:C(石墨)+O2(g)=CO2(g) ∆H=-393.5kJ·mol-1。该反应属于___________ (填“放热”或“吸热”)反应。
(2)—定条件下,在某密闭容器中进行反应:N2(g)+3H2(g)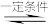 2NH3(g) ∆H<O。
2NH3(g) ∆H<O。
①若N2(g)的起始浓度为1mol-1•L-1,H2(g)的起始浓度为3mol•L-1,反应进行到2min时,测得H2(g)浓度为2mol•L-1,测2min内v(H2)=___________ mol•L-1•min•L-1。
②当反应达到平衡时,若只升高温度,则平衡向___________ (填“正反应”或“逆反应”)方向移动。
③当反应达到平衡时,若只增大压强,则化学平衡常数K___________ (填"增大”“减小”或“不变”)。
(3)常温下,往0.1mol•L-1NH4Cl溶液中滴入紫色石蕊试液后,溶液变红色,则该溶液pH___________ 7(填“〉”或“<”);c( )
)___________ c(Cl-)(填“〉”或“<”)。
(4)如图所示实验,用石墨电极电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
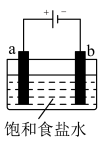
①a电极是电解池的___________ (填“阳极”或“阴极”)。
②溶液中H+向___________ (填“a”或“b”)电极移动。
③生成Cl2的电极反应式:___________ 。
(1)已知在298K时,C(石墨)完全燃烧的热化学方程式:C(石墨)+O2(g)=CO2(g) ∆H=-393.5kJ·mol-1。该反应属于
(2)—定条件下,在某密闭容器中进行反应:N2(g)+3H2(g)
 2NH3(g) ∆H<O。
2NH3(g) ∆H<O。①若N2(g)的起始浓度为1mol-1•L-1,H2(g)的起始浓度为3mol•L-1,反应进行到2min时,测得H2(g)浓度为2mol•L-1,测2min内v(H2)=
②当反应达到平衡时,若只升高温度,则平衡向
③当反应达到平衡时,若只增大压强,则化学平衡常数K
(3)常温下,往0.1mol•L-1NH4Cl溶液中滴入紫色石蕊试液后,溶液变红色,则该溶液pH
 )
)(4)如图所示实验,用石墨电极电解饱和食盐水:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
①a电极是电解池的
②溶液中H+向
③生成Cl2的电极反应式:
您最近一年使用:0次
解题方法
6 . 某化学兴趣小组为制取氯气并探究其性质,按下列装置(部分夹持仪器已略去)进行实验。
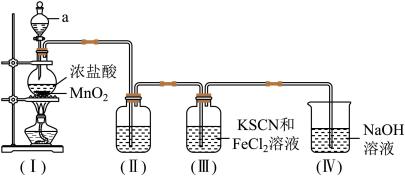
【装置(I)中发生反应的化学方程式:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O】
MnCl2+Cl2↑+2H2O】
【实验探究】
(1)装置(I)中仪器a的名称是___________ 。
(2)为除去Cl2中混有的HCl气体,装置(II)中的溶液是_________ (填“饱和食盐水”或“浓硫酸”)
(3)实验进行一段时间后,装置(III)中溶液颜色变为___________ (填“红色”或“紫色”),该反应中Cl2表现出___________ (填“氧化性”或“还原性”)。
(4)装置(IV)中NaOH溶液的作用是___________ 。
(5)若要生成标准状况下2.24LCl2,理论上参加反应的MnO2的质量是___________ g。(MnO2的摩尔质量为87g·mol-1)
【实验拓展】
(6)图是探究Cl2性质的微型实验,a处是湿润的红纸,b处是浸有淀粉KI溶液的滤纸。向KClO3晶体中滴加浓盐酸后,立即用另一培养皿扣在上面。
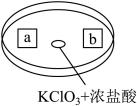
已知:KC1O3+6HCl(浓)=KC1+3C12↑+3H2O
回答下列问题:
①a处湿润的红纸___________ (填“褪色”或“不褪色”)
②b处滤纸变蓝色,写出Cl2与KI反应的化学方程式:___________
【知识应用】
(7)84消毒液(有效成分是NaClO)是常用的消毒剂,NaClO与水和空气里的二氧化碳反应生成___________ 可以消毒杀菌;84消毒液与洁厕灵(其中含盐酸)混合使用会发生反应,补充完整该反应的化学方程式:NaClO+2HCl=NaCl+___________ ↑+H2O。

【装置(I)中发生反应的化学方程式:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O】
MnCl2+Cl2↑+2H2O】【实验探究】
(1)装置(I)中仪器a的名称是
(2)为除去Cl2中混有的HCl气体,装置(II)中的溶液是
(3)实验进行一段时间后,装置(III)中溶液颜色变为
(4)装置(IV)中NaOH溶液的作用是
(5)若要生成标准状况下2.24LCl2,理论上参加反应的MnO2的质量是
【实验拓展】
(6)图是探究Cl2性质的微型实验,a处是湿润的红纸,b处是浸有淀粉KI溶液的滤纸。向KClO3晶体中滴加浓盐酸后,立即用另一培养皿扣在上面。

已知:KC1O3+6HCl(浓)=KC1+3C12↑+3H2O
回答下列问题:
①a处湿润的红纸
②b处滤纸变蓝色,写出Cl2与KI反应的化学方程式:
【知识应用】
(7)84消毒液(有效成分是NaClO)是常用的消毒剂,NaClO与水和空气里的二氧化碳反应生成
您最近一年使用:0次
7 . 为了保护环境,化学实验产生的废液必须处理后才能排放。某兴趣小组对含有Fe3+、Cu2+、Ba2+三种金属离子的废液进行处理,设计实验流程如下:

(1)步骤(I)中沉淀A和滤液B分离的操作名称是___________ ,滤液B中的金属阳离子有Ba2+和___________ 。
(2)步骤(II)中生成的沉淀C是___________ 。
(3)步骤(III)中H2O2把Fe2+转化为Fe3+,H2O2作为___________ (填“氧化剂”或“还原剂”)。
(4)步骤(IV)中Fe3+和OH-反应的离子方程式为___________ 。

(1)步骤(I)中沉淀A和滤液B分离的操作名称是
(2)步骤(II)中生成的沉淀C是
(3)步骤(III)中H2O2把Fe2+转化为Fe3+,H2O2作为
(4)步骤(IV)中Fe3+和OH-反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 下表是元素周期表的一部分,根据表中给出的10种元素(其中X、Y分别表示某种元素),按要求作答。
(1)X、Y两种元素符号分别是___________ 和___________ ;
(2)O的原子结构示意图是___________ ;
(3)C与N原子半径较大的是___________ ;
(4)原子最外层电子数为8的元素是___________ ;
(5)漂白粉有效成分是Ca(ClO)2,其中Cl元素的化合价是___________ ;
(6)Na与Al的单质,能与冷水发生剧烈反应的是___________ ;
(7)NH3与H2O相比,热稳定性较弱的是___________ ;
(8)Na2O与A12O3,其中属于两性氧化物的是___________ ;
(9)S的一种常见氧化物能使品红溶液褪色,其化学式是___________ ;写出Na与S在加热条件下反应生成Na2S的化学方程式:___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | O | X | ||||
| 3 | Na | Y | Al | S | Cl | Ar |
(2)O的原子结构示意图是
(3)C与N原子半径较大的是
(4)原子最外层电子数为8的元素是
(5)漂白粉有效成分是Ca(ClO)2,其中Cl元素的化合价是
(6)Na与Al的单质,能与冷水发生剧烈反应的是
(7)NH3与H2O相比,热稳定性较弱的是
(8)Na2O与A12O3,其中属于两性氧化物的是
(9)S的一种常见氧化物能使品红溶液褪色,其化学式是
您最近一年使用:0次
9 . 为研究二氧化硫的性质,某兴趣小组设计如下装置进行实验。

(1)a是___________ (填仪器名称)。
(2)在组装好装置装入药品前,需要进行的操作是___________ 。
(3)将少量 溶液缓慢推入
溶液缓慢推入 粉末处,发生反应。
粉末处,发生反应。
① 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
②随着反应的进行,c处实验现象为___________ ,b处实验现象为___________ 。
③几分钟后,发现d处气球变小,逐渐恢复至原样,说明二氧化硫具有的性质是___________ 。
④为证明二氧化硫与水反应具有可逆性,需要进行的实验操作是___________ 。
(4)这种实验设计的优点之一是___________ 。

(1)a是
(2)在组装好装置装入药品前,需要进行的操作是
(3)将少量
 溶液缓慢推入
溶液缓慢推入 粉末处,发生反应。
粉末处,发生反应。①
 与
与 反应的化学方程式为
反应的化学方程式为②随着反应的进行,c处实验现象为
③几分钟后,发现d处气球变小,逐渐恢复至原样,说明二氧化硫具有的性质是
④为证明二氧化硫与水反应具有可逆性,需要进行的实验操作是
(4)这种实验设计的优点之一是
您最近一年使用:0次
解题方法
10 . 氧化镁在医药、建筑等行业应用广泛。某兴趣小组用菱镁矿(主要成分为 ,还含少量
,还含少量 及不溶于酸的杂质)制备氧化镁,设计实验流程如下:
及不溶于酸的杂质)制备氧化镁,设计实验流程如下:

(1)菱镁矿与稀硫酸反应前,将菱镁矿石粉碎成粉末的目的是___ 。
(2)步骤(Ⅰ)中生成气体的分子式为______ 。分离溶液A和沉淀的操作的名称是_____ 。
(3)步骤(Ⅱ)中发生的反应 ,其中还原剂是
,其中还原剂是_______ 。
(4)溶液B中含有的主要阴离子是______ 。
(5)为检验步骤(Ⅲ)中所得 溶液是否还含有
溶液是否还含有 ,使用的试剂是
,使用的试剂是_____ 。
(6)步骤(Ⅳ)中发生反应的离子方程式为______ 。
(7)步骤(Ⅴ)中 受热分解的化学方程式为
受热分解的化学方程式为________ 。
 ,还含少量
,还含少量 及不溶于酸的杂质)制备氧化镁,设计实验流程如下:
及不溶于酸的杂质)制备氧化镁,设计实验流程如下:
(1)菱镁矿与稀硫酸反应前,将菱镁矿石粉碎成粉末的目的是
(2)步骤(Ⅰ)中生成气体的分子式为
(3)步骤(Ⅱ)中发生的反应
 ,其中还原剂是
,其中还原剂是(4)溶液B中含有的主要阴离子是
(5)为检验步骤(Ⅲ)中所得
 溶液是否还含有
溶液是否还含有 ,使用的试剂是
,使用的试剂是(6)步骤(Ⅳ)中发生反应的离子方程式为
(7)步骤(Ⅴ)中
 受热分解的化学方程式为
受热分解的化学方程式为
您最近一年使用:0次



