解题方法
1 . 过氧化钠可与二氧化碳反应放出氧气,因此常用在缺乏空气的场合,如矿井、坑道、潜水、宇宙飞船等,以供呼吸应急用。利用下图所示装置进行实验,模拟过氧化钠在呼吸面具或潜水解中作供氧剂。
已知:A中分液漏斗盛放试剂为2.00mol/L盐酸、B中盛放试剂为饱和 溶液,C中盛放试剂为过氧化钠,D中盛放试剂为足量NaOH溶液。请回答下列问题:
溶液,C中盛放试剂为过氧化钠,D中盛放试剂为足量NaOH溶液。请回答下列问题:
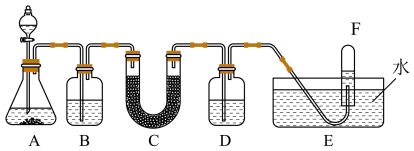
(1)实验室欲精确配制100mL2.00mol/L盐酸,不需要使用的仪器是________
(2)A是实验室中制取 的装置,锥形瓶中盛放试剂是________
的装置,锥形瓶中盛放试剂是________
(3)B中盛放的饱和 溶液的作用是________
溶液的作用是________
(4)C中发生反应: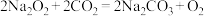 ,
, 中氧元素化合价的变化是________
中氧元素化合价的变化是________
(5)下列关于试管F中收集气体的叙述错误的是________
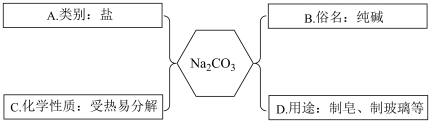
(6)某同学对 部分相关知识梳理的思维导图如下所示,其中叙述错误的是________
部分相关知识梳理的思维导图如下所示,其中叙述错误的是________
已知:A中分液漏斗盛放试剂为2.00mol/L盐酸、B中盛放试剂为饱和
 溶液,C中盛放试剂为过氧化钠,D中盛放试剂为足量NaOH溶液。请回答下列问题:
溶液,C中盛放试剂为过氧化钠,D中盛放试剂为足量NaOH溶液。请回答下列问题:
(1)实验室欲精确配制100mL2.00mol/L盐酸,不需要使用的仪器是________
| A.量筒 | B.托盘天平 | C.胶头滴管 | D.100mL容量瓶 |
 的装置,锥形瓶中盛放试剂是________
的装置,锥形瓶中盛放试剂是________A. | B. | C. | D. |
 溶液的作用是________
溶液的作用是________| A.鉴别HCl | B.除去HCl | C.鉴别 | D.除去 |
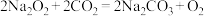 ,
, 中氧元素化合价的变化是________
中氧元素化合价的变化是________| A.只升高 | B.只降低 |
| C.既有升高,又有降低 | D.既不升高,也不降低 |
A.可以用 分解制取 分解制取 | B.可以使澄清石灰水变浑浊 |
| C.可以使带火星的木条复燃 | D.其某种同素异形体可用作自来水消毒剂 |
 部分相关知识梳理的思维导图如下所示,其中叙述错误的是________
部分相关知识梳理的思维导图如下所示,其中叙述错误的是________
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . X、Y、Z、W、Q、R均为短周期主族元素,且原子序数依次增大。X的原子半径最小,Y是形成有机化合物的必需元素,Z是短周期金属性最强的元素,W是地壳中含量最多的金属元素,Q元素的原子最外层电子数是电子层数的2倍。请回答下列问题:
(1)Y在周期表中的位置是_______
(2)Z与R形成的化合物灼烧时,火焰呈现的颜色是_______
(3)W、Q、R的原子半径由大到小的顺序是_______
(4)已知元素最高价氧化物的水化物的酸性:Q>Y,则元素Q、Y非金属性强弱关系正确的是_______
(5)下列各组元素形成的化合物中一定含有离子键的是_______
(6)元素X的一种核素的质量数是3,则该核素的中子数是_______
(1)Y在周期表中的位置是_______
| A.第二周期IA族 | B.第三周期ⅡA族 |
| C.第二周期IVA族 | D.第三周期IVA族 |
| A.红色 | B.黄色 | C.绿色 | D.紫色 |
| A.R>Q>W | B.W>R>Q | C.Q>R>W | D.W>Q>R |
| A.Q>Y | B.Q=Y | C.Q<Y | D.无法判断 |
| A.X和Q | B.X和Y | C.Y和Q | D.Z和R |
| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
3 . “匹伐他汀钙(M)”是一种用来降低胆固醇的新型他汀类药物,因其使用剂量小,耐受性好,安全性高被称为“超级他汀类药物(Superstatin)”,其合成路线如下:
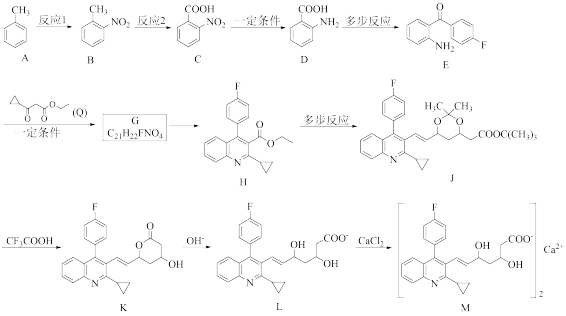
已知:苯环上原有的取代基对新进入取代基与苯环相连的位置有显著影响, 是邻、对位定位基团,-COOH是间位定位基团。
是邻、对位定位基团,-COOH是间位定位基团。
回答下列问题:
(1)E的分子式为_______ ,C→D的反应类型为_______ 。
(2)A→B反应的化学方程式为_______ 。
(3)不能将反应1和反应2顺序颠倒的原因为_______ 。
(4)G含有3个六元环,1mol的G转化成H需要脱去2mol水,G的结构简式是_______ 。
(5)酸性:
_______  (填“大于”或“小于”)。
(填“大于”或“小于”)。
(6)若X的分子式比Q少2个C原子和4个H原子,则满足以下条件的X的同分异构体有_______ 种(不考虑立体异构);
i.无环状结构
ii.能发生银镜反应
iii.能和碳酸氢钠溶液反应生成
其中,核磁共振氢谱显示有3组峰,且峰面积之比为3:3:1:1,则该结构简式为_______ 。

已知:苯环上原有的取代基对新进入取代基与苯环相连的位置有显著影响,
 是邻、对位定位基团,-COOH是间位定位基团。
是邻、对位定位基团,-COOH是间位定位基团。回答下列问题:
(1)E的分子式为
(2)A→B反应的化学方程式为
(3)不能将反应1和反应2顺序颠倒的原因为
(4)G含有3个六元环,1mol的G转化成H需要脱去2mol水,G的结构简式是
(5)酸性:

 (填“大于”或“小于”)。
(填“大于”或“小于”)。(6)若X的分子式比Q少2个C原子和4个H原子,则满足以下条件的X的同分异构体有
i.无环状结构
ii.能发生银镜反应
iii.能和碳酸氢钠溶液反应生成

其中,核磁共振氢谱显示有3组峰,且峰面积之比为3:3:1:1,则该结构简式为
您最近一年使用:0次
解题方法
4 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料等。 的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为:
的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为:
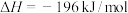 。回答下列问题:
。回答下列问题:
(1)已知 在
在 作用下的催化氧化历程如图所示反应
作用下的催化氧化历程如图所示反应

①的活化能为 ,反应②的活化能为
,反应②的活化能为 ,则
,则
_______  (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
(2)当 、
、 、
、 (不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为
(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为 、
、 和
和 下,
下, 平衡转化率α随温度的变化如图所示。
平衡转化率α随温度的变化如图所示。

① 、
、 和
和 由小到大的顺序为
由小到大的顺序为_______ ,判断的依据是_______ 。
②在550℃、 条件下进行反应。平衡时,若
条件下进行反应。平衡时,若 转化率为α,则压强平衡常数Kp=
转化率为α,则压强平衡常数Kp=_______ 。(分压=总压×物质的量分数,用含α和 的代数式表示,不用写单位)
的代数式表示,不用写单位)
(3)以 为基础固硫材料,探究复合不同的催化剂(
为基础固硫材料,探究复合不同的催化剂( 、
、 -
- 、
、 -
- )在不同温度下催化
)在不同温度下催化 向
向 的转化效率(用单位时间
的转化效率(用单位时间 转化率表示)如图所示:
转化率表示)如图所示:

①仅使用 而不使用催化剂获得的X线的实验目的是
而不使用催化剂获得的X线的实验目的是_______ 。
②下列有关说法正确的是_______
a.同温度下,三种催化剂中 催化剂效率最低
催化剂效率最低
b.温度越高一定越有利于催化剂催化效率的提升
c.同温同压下,使用复合催化剂有利于提高 的平衡产率
的平衡产率
d.催化剂通过改变反应历程,增大活化分子百分数,实现加快反应速率
(4)某 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: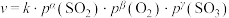 ,根据表中数据,γ=
,根据表中数据,γ=_______ 。
(5)利用 与
与 反应既可消除污染又可以制备
反应既可消除污染又可以制备 ,将含有
,将含有 尾气和一定比例的空气通入
尾气和一定比例的空气通入 悬浊液中,保持温度不变的情况下,测得溶液中
悬浊液中,保持温度不变的情况下,测得溶液中 和
和 随反应时间的变化如图所示。导致溶液中
随反应时间的变化如图所示。导致溶液中 和
和 的变化产生明显差异的原因是:
的变化产生明显差异的原因是:_______ 。

 的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为:
的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为:
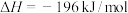 。回答下列问题:
。回答下列问题:(1)已知
 在
在 作用下的催化氧化历程如图所示反应
作用下的催化氧化历程如图所示反应
①的活化能为
 ,反应②的活化能为
,反应②的活化能为 ,则
,则
 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)(2)当
 、
、 、
、 (不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为
(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为 、
、 和
和 下,
下, 平衡转化率α随温度的变化如图所示。
平衡转化率α随温度的变化如图所示。
①
 、
、 和
和 由小到大的顺序为
由小到大的顺序为②在550℃、
 条件下进行反应。平衡时,若
条件下进行反应。平衡时,若 转化率为α,则压强平衡常数Kp=
转化率为α,则压强平衡常数Kp= 的代数式表示,不用写单位)
的代数式表示,不用写单位)(3)以
 为基础固硫材料,探究复合不同的催化剂(
为基础固硫材料,探究复合不同的催化剂( 、
、 -
- 、
、 -
- )在不同温度下催化
)在不同温度下催化 向
向 的转化效率(用单位时间
的转化效率(用单位时间 转化率表示)如图所示:
转化率表示)如图所示:
①仅使用
 而不使用催化剂获得的X线的实验目的是
而不使用催化剂获得的X线的实验目的是②下列有关说法正确的是
a.同温度下,三种催化剂中
 催化剂效率最低
催化剂效率最低b.温度越高一定越有利于催化剂催化效率的提升
c.同温同压下,使用复合催化剂有利于提高
 的平衡产率
的平衡产率d.催化剂通过改变反应历程,增大活化分子百分数,实现加快反应速率
(4)某
 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: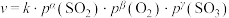 ,根据表中数据,γ=
,根据表中数据,γ=| 实验 |  |  |  | V |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 1.414q |
 与
与 反应既可消除污染又可以制备
反应既可消除污染又可以制备 ,将含有
,将含有 尾气和一定比例的空气通入
尾气和一定比例的空气通入 悬浊液中,保持温度不变的情况下,测得溶液中
悬浊液中,保持温度不变的情况下,测得溶液中 和
和 随反应时间的变化如图所示。导致溶液中
随反应时间的变化如图所示。导致溶液中 和
和 的变化产生明显差异的原因是:
的变化产生明显差异的原因是:
您最近一年使用:0次
5 . 连二亚硫酸钠( )广泛用于纺织、印染、造纸等行业,因其使用时对织物的损伤很小,故又称“保险粉”。
)广泛用于纺织、印染、造纸等行业,因其使用时对织物的损伤很小,故又称“保险粉”。
I. 制备
制备
锌粉法是最早应用于工业生产连二亚硫酸钠的方法,其制备原理及装置如下:
步骤1:检查装置气密性并加入药品;
步骤2:打开仪器a的活塞,向装置C中通入一段时间 ,发生反应:
,发生反应: ;
;
步骤3:打开仪器c的活塞滴加稍过量的NaOH溶液使装置C中溶液的pH处在8.2~10.5之间,发生反应
步骤4:过滤,将滤液经“一系列操作”可获得 。
。

已知:
① 易溶于水,不溶于乙醇,在碱性介质中较稳定。
易溶于水,不溶于乙醇,在碱性介质中较稳定。
② 与
与 的化学性质相似。
的化学性质相似。
回答下列问题:
(1)仪器d的名称为_______ 。
(2)装置B(单向阀)的作用为_______ 。
(3)一系列操作包括盐析、过滤、脱水、洗涤、干燥等操作,其中洗涤所用的试剂为_______。
(4)步骤3需控制溶液的pH在8.2~10.5之间,其原因为_______ 。
II. 含量的测定
含量的测定
称取2.0g制得的 产品溶于冷水配成250mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性
产品溶于冷水配成250mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性 标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为19.98mL、20.90mL、20.02mL。
标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为19.98mL、20.90mL、20.02mL。
(5) 是一种比较弱的氧化剂,能将
是一种比较弱的氧化剂,能将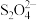 氧化为
氧化为 ,自身被还原为
,自身被还原为 ,滴定中发生反应的离子反应方程式为
,滴定中发生反应的离子反应方程式为_______ 。
(6)选择指示剂时,指示剂的条件电位要在滴定突跃电位之间,本实验滴定突跃范围为0.01V~0.38V,根据下表,可选择_______ 为指示剂。
(7)样品中 的质量分数为
的质量分数为_______ (杂质不参与反应,计算结果精确到0.1%)。
 )广泛用于纺织、印染、造纸等行业,因其使用时对织物的损伤很小,故又称“保险粉”。
)广泛用于纺织、印染、造纸等行业,因其使用时对织物的损伤很小,故又称“保险粉”。I.
 制备
制备锌粉法是最早应用于工业生产连二亚硫酸钠的方法,其制备原理及装置如下:
步骤1:检查装置气密性并加入药品;
步骤2:打开仪器a的活塞,向装置C中通入一段时间
 ,发生反应:
,发生反应: ;
;步骤3:打开仪器c的活塞滴加稍过量的NaOH溶液使装置C中溶液的pH处在8.2~10.5之间,发生反应

步骤4:过滤,将滤液经“一系列操作”可获得
 。
。
已知:
①
 易溶于水,不溶于乙醇,在碱性介质中较稳定。
易溶于水,不溶于乙醇,在碱性介质中较稳定。②
 与
与 的化学性质相似。
的化学性质相似。回答下列问题:
(1)仪器d的名称为
(2)装置B(单向阀)的作用为
(3)一系列操作包括盐析、过滤、脱水、洗涤、干燥等操作,其中洗涤所用的试剂为_______。
| A.乙醇 | B.NaOH溶液 | C.水 | D.浓硫酸 |
II.
 含量的测定
含量的测定称取2.0g制得的
 产品溶于冷水配成250mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性
产品溶于冷水配成250mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性 标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为19.98mL、20.90mL、20.02mL。
标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为19.98mL、20.90mL、20.02mL。(5)
 是一种比较弱的氧化剂,能将
是一种比较弱的氧化剂,能将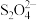 氧化为
氧化为 ,自身被还原为
,自身被还原为 ,滴定中发生反应的离子反应方程式为
,滴定中发生反应的离子反应方程式为(6)选择指示剂时,指示剂的条件电位要在滴定突跃电位之间,本实验滴定突跃范围为0.01V~0.38V,根据下表,可选择
| 常用氧化还原指示剂条件电位 | 颜色变化 | ||
| 提示剂 | 条件电位(V) | 还原态 | 氧化态 |
| 亚甲基蓝 | 0.36 | 无色 | 蓝色 |
| 二苯胺 | 0.76 | 无色 | 紫色 |
| 二苯胺磺酸钠 | 0.84 | 无色 | 紫红 |
| 邻苯氨基苯甲酸 | 0.89 | 无色 | 紫红 |
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
6 . 钪(Sc)是一种重要且价格昂贵的稀土金属,广泛用于航空航天、超导等领域。从赤泥(含有Sc2O3、Al2O3、Fe2O3、TiO2等)中回收钪,同时生产聚合硫酸铁铝的工艺流程如图所示:
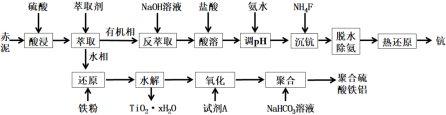
回答下列问题:
(1)写出基态Sc原子的简化电子排布式:_______ 。
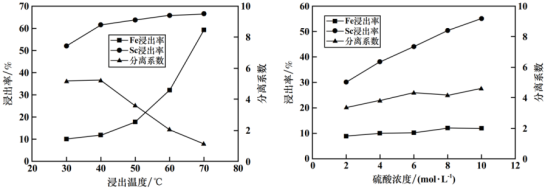
(2)在酸浸赤泥的后续萃取分离过程中,Fe3+与Sc3+会发生共萃而进入有机相,从而使后续分离难度加大,经探究温度、硫酸浓度与铁、钪的浸出率及分离系数(钪的浸出率和铁的浸出率比值)关系如下图所示,则酸浸的最佳浸出温度为_______ ℃,最佳硫酸浓度为_______ mol/L。
(3)该工艺条件下,溶液中有关离子开始沉淀和完全沉淀的pH值如下表所示:
①已知TiO2和硫酸反应生成水溶性的TiO2+,则流程中TiO2+水解生成TiO2·xH2O的离子方程式为_______ 。
②试剂A常选用H2O2,写出其在生产、生活中可能的用途_______ 。(填一条即可)
③该工艺流程中引入“还原”与“氧化”这两个步骤的原因是_______ 。
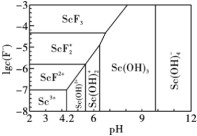
(4)含钪元素的微粒与lgc(F-)、pH的关系如下图所示,“沉钪”时,溶液的pH=3,c(F-)=10-4 mol/L,则此时钪的存在形式为_______ (填化学式)。
(5)“聚合”生成聚合硫酸铁铝AlFe(OH)2(SO4)2时,同时产生气体,该步骤的离子方程式为_______ 。

回答下列问题:
(1)写出基态Sc原子的简化电子排布式:
(2)在酸浸赤泥的后续萃取分离过程中,Fe3+与Sc3+会发生共萃而进入有机相,从而使后续分离难度加大,经探究温度、硫酸浓度与铁、钪的浸出率及分离系数(钪的浸出率和铁的浸出率比值)关系如下图所示,则酸浸的最佳浸出温度为

(3)该工艺条件下,溶液中有关离子开始沉淀和完全沉淀的pH值如下表所示:
| 离子 | Fe2+ | Fe3+ | Al3+ | TiO2+ |
| 开始沉淀的pH | 7.0 | 1.9 | 3.0 | 0.3 |
| 完全沉淀的pH | 9.0 | 3.2 | 4.7 | 2.0 |
②试剂A常选用H2O2,写出其在生产、生活中可能的用途
③该工艺流程中引入“还原”与“氧化”这两个步骤的原因是
(4)含钪元素的微粒与lgc(F-)、pH的关系如下图所示,“沉钪”时,溶液的pH=3,c(F-)=10-4 mol/L,则此时钪的存在形式为

(5)“聚合”生成聚合硫酸铁铝AlFe(OH)2(SO4)2时,同时产生气体,该步骤的离子方程式为
您最近一年使用:0次
解题方法
7 . 为了庆祝元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究中发挥着越来越重要的作用。图是元素周期表的一部分,请回答下列问题:

(1)元素②在周期表中的位置是
(2)元素⑦最高价氧化物的水化物的化学式是
(3)元素⑤、⑥、⑧的金属性由强到弱的顺序为
(4)下列各组元素形成的化合物中一定含有离子键的是
(5)元素②、③、④的原子半径由大到小的顺序为
(6)元素⑥的单质及其化合物在生活中应用广泛,下列说法中错误的是

(1)元素②在周期表中的位置是
| A.第二周期第ⅢA族 | B.第二周期第ⅣA族 | C.第三周期第ⅤA族 | D.第三周期第ⅥA族 |
| A.HCl | B.HClO | C. | D. |
| A.⑤>⑥>⑧ | B.⑤>⑧>⑥ | C.⑧>⑤>⑥ | D.⑥>⑤>⑧ |
| A.②和④ | B.①和⑦ | C.③和⑥ | D.⑤和⑦ |
| A.④>③>② | B.②>③>④ | C.③>②>④ | D.④>②>③ |
| A.元素⑥是地壳中含量最多的金属元素 | B.元素⑥的氧化物是两性氧化物 |
| C.元素⑥的氢氧化物只能与酸反应 | D.元素⑥的单质可与氧气发生反应 |
您最近一年使用:0次
解题方法
8 . 配制一定物质的量浓度溶液的方法,是高中学生必须学会的化学实验操作技能之一,对生产和科学研究也有重要意义。实验室配制100mL1.00mol/LNaCl溶液的过程示意图如图,请回答下列问题:

(1)除了如图所示的实验仪器外,还需要的仪器为
(2)该实验中所用容量瓶的规格是
(3)计算需要NaCl固体的质量是
(4)容量瓶常用于配制一定物质的量浓度的溶液,瓶上除标有容积和刻度线外,还标有
(5)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求的浓度
(6)关于溶液配制过程,下列操作中错误的是

(1)除了如图所示的实验仪器外,还需要的仪器为
| A.坩埚 | B.圆底烧瓶 | C.分液漏斗 | D.天平 |
| A.50mL | B.100mL | C.250mL | D.500mL |
| A.5.85g | B.6g | C.11g | D.11.7g |
| A.温度 | B.压强 | C.酸式 | D.碱式 |
| A.偏大 | B.偏小 | C.不变 | D.无法确定 |
| A.容量瓶使用前要检查是否漏水 |
| B.玻璃棒用于搅拌和引流 |
| C.烧杯和玻璃棒无需洗涤 |
| D.将配制好的溶液倒入试剂瓶中,并贴好标签 |
您最近一年使用:0次
9 . 元素周期表的建立成为化学发展史上的重要里程碑之一,元素周期表揭示了元素间的内在联系,是学习元素单质及其化合物的重要工具。表中列出了①~⑩10种元素在周期表中的位置。请回答下列问题:

(1)元素③在周期表中的位置是
(2)元素⑦、⑩最高价氧化物对应的水化物碱性强弱关系正确的是
(3)元素③、④、⑤、⑥中非金属性最强的是
(4)元素③、④、⑧、⑨中原子半径最大的是
(5)下列物质所含化学键类型与元素⑦、⑨形成的化合物所含化学键类型相同的是
(6)下列关于原子结构与元素性质的叙述错误的是

(1)元素③在周期表中的位置是
| A.第一周期、第ⅣA族 | B.第二周期、第ⅣA族 |
| C.第二周期、第ⅢA族 | D.第三周期、第ⅣA族 |
| A.⑦>⑩ | B.⑦=⑩ | C.⑦<⑩ | D.无法确定 |
| A.③ | B.④ | C.⑤ | D.⑥ |
| A.③ | B.④ | C.⑧ | D.⑨ |
A. | B.HCl | C. | D. |
A.元素⑤的原子结构示意图为 |
| B.元素①的原子序数等于其核电荷数 |
| C.元素⑦的单质常常保存在石蜡油或煤油中 |
| D.这10种元素中,化学性质最不活泼的是② |
您最近一年使用:0次
10 . 化学实验是研究和学习物质及其变化的基本方法,是科学探究的一种重要途径。浓硫酸与木炭在加热条件下可发生化学反应: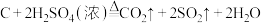 。为检验反应的产物,设计了如下图所示的实验。请基于实验事实回答下列问题:
。为检验反应的产物,设计了如下图所示的实验。请基于实验事实回答下列问题:
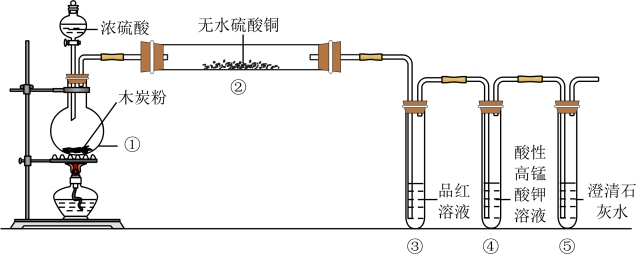
(1)装置中仪器①的名称是
(2)在浓硫酸与木炭的反应中,硫元素化合价的变化是
(3)装置②中的实验现象是白色粉末变蓝,这证明了产物中有
(4)装置③中的实验现象是品红溶液褪色,体现了二氧化硫的性质是
(5)装置④中酸性高锰酸钾溶液的作用是
(6)装置⑤中可观察到的实验现象是
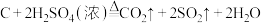 。为检验反应的产物,设计了如下图所示的实验。请基于实验事实回答下列问题:
。为检验反应的产物,设计了如下图所示的实验。请基于实验事实回答下列问题:
(1)装置中仪器①的名称是
| A.锥形瓶 | B.圆底烧瓶 | C.酒精灯 | D.分液漏斗 |
| A.升高 | B.降低 | C.不变 | D.无法判断 |
A. | B. | C. | D. 和 和 |
| A.酸性 | B.还原性 | C.氧化性 | D.漂白性 |
A.吸收 | B.吸收 | C.吸收 | D.检验 |
| A.澄清石灰水变蓝 | B.澄清石灰水变红 | C.澄清石灰水变浑浊 | D.澄清石灰水无现象 |
您最近一年使用:0次



