名校
解题方法
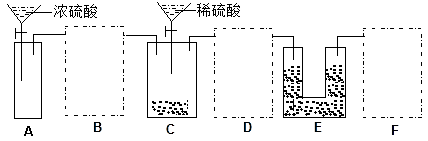
1 . 氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,并比较其氧化性。

回答下列问题:
(1)甲中盛放浓盐酸的仪器名称是_______ ,乙装置的作用是_______ 。
(2)丙中采用的加热方式是_______ 。
(3)丁中化学反应的离子方程式是_______ 。
(4)戊的作用是尾气吸收,可选用试剂_______ (填序号)。
(5)反应结束后,取出丙中试管,经冷却结晶、_______ 、洗涤、干燥,得到KClO3晶体。
(6)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。可知该条件下KClO3的氧化能力_______ NaClO(填“大于”或“小于”)。

回答下列问题:
(1)甲中盛放浓盐酸的仪器名称是
(2)丙中采用的加热方式是
(3)丁中化学反应的离子方程式是
(4)戊的作用是尾气吸收,可选用试剂
| A.H2SO4 | B.NaOH | C.NaCl | D.HNO3 |
(5)反应结束后,取出丙中试管,经冷却结晶、
(6)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。可知该条件下KClO3的氧化能力
您最近一年使用:0次
2023-11-10更新
|
231次组卷
|
3卷引用:安徽省六安市城南中学2023年普通高中化学学业水平合格性考试化学模拟试卷
2 . 下图是一些常见有机物的转化关系。A 的产量可以用来衡量一个国家的石油化工发展水平,E 是一种酸。请回答相关问题。
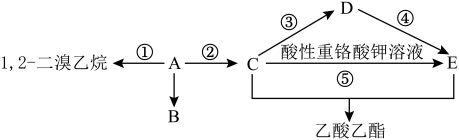
(1)C 官能团名称为___________ ,E 分子的结构简式为___________ 。
(2)在催化剂条件下,A 可形成高分子化合物 B,该反应的化学方程式为___________ 。
(3)反应①~⑤中属于加成反应的有___________ (填序号)。
(4)写出反应③的化学方程式___________ 。
(5)写出 C 与 E 反应的化学方程式:___________ 。

(1)C 官能团名称为
(2)在催化剂条件下,A 可形成高分子化合物 B,该反应的化学方程式为
(3)反应①~⑤中属于加成反应的有
(4)写出反应③的化学方程式
(5)写出 C 与 E 反应的化学方程式:
您最近一年使用:0次
2023-09-07更新
|
126次组卷
|
2卷引用:安徽省六安市城南中学2023年普通高中化学学业水平合格性考试化学模拟试卷
名校
解题方法
3 . 学校化学兴趣小组利用下列所给试剂,探究不同温度下相同质量的铝与稀盐酸反应速率的影响因素。
【实验试剂】铝条、铝粉、1mol·L—1盐酸、2mol·L—1盐酸
【设计并实验】每次实验盐酸用量均为10mL
(1)铝与稀盐酸反应的离子方程式为________________________ 。
(2)实验③和④是探究________________ 对该反应速率的影响。
(3)实验①和②是探究浓度对该反应速率的影响,表中c(HCl)应选取_______ mol·L—1。
(4)由表中数据得出结论:_______________________________ ,反应速率越快。
【实验试剂】铝条、铝粉、1mol·L—1盐酸、2mol·L—1盐酸
【设计并实验】每次实验盐酸用量均为10mL
| 实验编号 | 金属 | 温度(℃) | 盐酸的浓度 | 均收集50mL所用的时间(s) |
| ① | 铝条 | 25 | 1mol·L—1盐酸 | 32.6 |
| ② | 铝条 | 25 | c(HCl) | 18.1 |
| ③ | 铝粉 | 25 | 1mol·L—1盐酸 | 24.3 |
| ④ | 铝粉 | 100 | 1mol·L—1盐酸 | 8.3 |
(2)实验③和④是探究
(3)实验①和②是探究浓度对该反应速率的影响,表中c(HCl)应选取
(4)由表中数据得出结论:
您最近一年使用:0次
名校
4 . 某校化学兴趣小组根据反应 H2O2+2HI=2H2O+I2探究影响化学反应速率的因素。实验数据如下
回答下列问题:
(1)反应 H2O2+2HI=2H2O+I2中,氧化剂是_____ 。
(2)25℃时,表明增大反应物浓度,化学反应速率_____ (填“增大”成“减小”)。
(3)能表明温度对化学反应速率影响的实验编号是①和_____ 。
(4)H2O2不稳定,写出 H2O2发生分解反应的化学方程式:_____ 。
| 实验编号 | H2O2溶液浓度/mol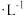 | HI溶液浓度/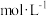 | 温度/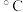 | 反应速率/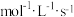 |
| ① | 0.1 | 0.1 | 25 | 0.0076 |
| ② | 0.1 | 0.2 | 25 | 0.0153 |
| ③ | 0.1 | 0.3 | 25 | 0.0227 |
| ④ | 0.1 | 0.1 | 35 | 0.0304 |
(1)反应 H2O2+2HI=2H2O+I2中,氧化剂是
(2)25℃时,表明增大反应物浓度,化学反应速率
(3)能表明温度对化学反应速率影响的实验编号是①和
(4)H2O2不稳定,写出 H2O2发生分解反应的化学方程式:
您最近一年使用:0次
名校
5 . A 的产量可以用来衡量一个国家的石油化工发展水平,E 是一种具有果香味的有机物(过程中的水或其他物质已省略)。
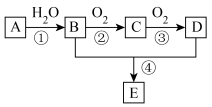
(1)D 分子中的官能团名称是_____ 。
(2)写出 C 的结构简式:_____
(3)反应①A→B 的反应类型是_____
(4)写出下列反应的化学方程式:B+D→E:_____ 。

(1)D 分子中的官能团名称是
(2)写出 C 的结构简式:
(3)反应①A→B 的反应类型是
(4)写出下列反应的化学方程式:B+D→E:
您最近一年使用:0次
2019-06-22更新
|
726次组卷
|
4卷引用:安徽省淮北师范大学附属实验中学2018-2019学年高二学业水平模拟考试化学试题
名校
6 . 硫的化合物种类较多,用途广泛。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,其制备的反应原理为:Na2SO3+ SO2==Na2S2O5
某研究小组利用下图装置制取Na2S2O5,盛硫酸的仪器叫分液漏斗。
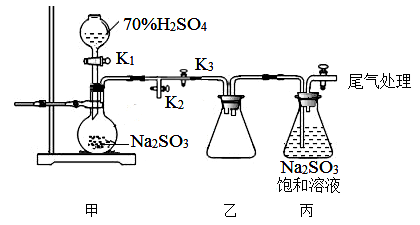
(1)写出装置甲中发生反应的化学方程式__________________ 。
(2)关闭K3,要求只检查装置甲的气密性,请至少写出两种不同的操作方法。
方法1:_________________________ 。
方法2:_________________________ 。
方法3:_________________________ 。
(3)装置乙的作用是________________ 。
(4)写出焦亚硫酸钠晶体在空气中被完全氧化的化学方程式_____________ 。
II:硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3 、FeCl2、CuCl2的混合溶液中反应用以回收S,其物质转化如图所示。

(1)反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为_____________ 。
(2)在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施是___________________ 。
(3)写出图中各步转化的化学方程式:____________________ 。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,其制备的反应原理为:Na2SO3+ SO2==Na2S2O5
某研究小组利用下图装置制取Na2S2O5,盛硫酸的仪器叫分液漏斗。

(1)写出装置甲中发生反应的化学方程式
(2)关闭K3,要求只检查装置甲的气密性,请至少写出两种不同的操作方法。
方法1:
方法2:
方法3:
(3)装置乙的作用是
(4)写出焦亚硫酸钠晶体在空气中被完全氧化的化学方程式
II:硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3 、FeCl2、CuCl2的混合溶液中反应用以回收S,其物质转化如图所示。

(1)反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为
(2)在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施是
(3)写出图中各步转化的化学方程式:
您最近一年使用:0次
名校
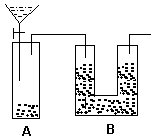
7 . 现有一瓶含NaCl杂质的Na2CO3样品,某同学设计了一种测定其纯度的方法,装置如下图,其中A容器中盛有样品10.0 g,分液漏斗内盛有稀硫酸,B容器内为碱石灰固体。
(1)该同学重复操作了三次,每次操作均正确,且装置不漏气,可是结果数据出现了较大偏差(容器内反应均完全,装置内空气的影响忽略不计),请你分析可能的原因______ 。
(2)通过仔细分析,该同学重新设计了一套实验装置如下图,请回答有关问题:
(可供选择的试剂还有 Zn片、浓硫酸、NaOH溶液、CaCO3固体、蒸馏水)
①该套装置未画完整,请在你认为需要补充装置的虚框内画出合适的简图,并注明试剂。______
②A装置的广口瓶中应加入的试剂是__________ ;该装置的作用是________________ 。
③如果实验后测得E装置质量增重3.52 g,则该Na2CO3试样的纯度为__________ 。
(3)测定该Na2CO3试样纯度的方法有多种,请你利用不同的反应原理 再设计一套方案。
要求写出实验操作流程和试样中Na2CO3纯度的表达式__________ 。(试剂任选)
操作流程按下列图示表述:

①操作流程为:

②实验时称量样品的质量为a克,所测物质的质量为b克,该试样中Na2CO3纯度的表达式为:__________ 。
(1)该同学重复操作了三次,每次操作均正确,且装置不漏气,可是结果数据出现了较大偏差(容器内反应均完全,装置内空气的影响忽略不计),请你分析可能的原因
(2)通过仔细分析,该同学重新设计了一套实验装置如下图,请回答有关问题:
(可供选择的试剂
①该套装置未画完整,请在你认为需要补充装置的虚框内画出合适的简图,并注明试剂。
②A装置的广口瓶中应加入的试剂是
③如果实验后测得E装置质量增重3.52 g,则该Na2CO3试样的纯度为
(3)测定该Na2CO3试样纯度的方法有多种,请你利用
要求写出实验操作流程和试样中Na2CO3纯度的表达式
操作流程按下列图示表述:

①操作流程为:

②实验时称量样品的质量为a克,所测物质的质量为b克,该试样中Na2CO3纯度的表达式为:
您最近一年使用:0次
8 . 顺式一茉莉酮的一种合成路线如下(部分反应条件已略去,-Ph代表苯基):[

回答下列问题:
(1)化合物A的名称为_____________ ;G与I的关系是_______________ 。
(2)C中所含官能团是_____________ (填名称)。
(3)反应②的化学方程式为______________________ ,②的反应类型是 _____________ ;④的反应类型是______________________
(4)G的一种同分异构体能与FeCl3溶液发生显色反应且核磁共振氢谱显示只有4组峰,则符合条件的异构体的结构简式为____________ (有几个写几个)。
(5)参照顺式一茉莉酮的上述合成路线,设计一条由Cl2 C=C=O和乙烯为起始原料制备聚γ一丁内酯( )的合成路线
)的合成路线_______________________ 。

回答下列问题:
(1)化合物A的名称为
(2)C中所含官能团是
(3)反应②的化学方程式为
(4)G的一种同分异构体能与FeCl3溶液发生显色反应且核磁共振氢谱显示只有4组峰,则符合条件的异构体的结构简式为
(5)参照顺式一茉莉酮的上述合成路线,设计一条由Cl2 C=C=O和乙烯为起始原料制备聚γ一丁内酯(
 )的合成路线
)的合成路线
您最近一年使用:0次
9 . 冰晶石(Na3 AlF6)难溶于水,广泛应用于铝的冶炼。工业上用萤石(CaF2)为原料生产Na3 AlF6:
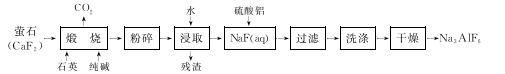
回答下列问题:
(1)在铝的冶炼中,Na3AlF6的作用是____________________ 。
(2)煅烧时总反应的化学方程式为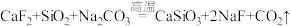 ,用水浸取后残渣的主要成分是
,用水浸取后残渣的主要成分是___________________
(3)煅烧后的固体在浸取前进行粉碎的目的是__________________ ,为达到相同目的,常温浸取时还可采取的措施是 ______________ 。
(4)写出向NaF溶液中加入硫酸铝溶液发生反应的离子方程式:___________ 。NaF溶液呈碱性,用离子方程式表示其原因:_____________________ ,因此在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物
(5)97.5 kg含CaF2 80%萤石(杂质不含氟元素)理论上可生产Na3 AlF6______________ kg(设生产过程中的每一步含氟物质均完全转化)。

回答下列问题:
(1)在铝的冶炼中,Na3AlF6的作用是
(2)煅烧时总反应的化学方程式为
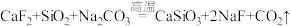 ,用水浸取后残渣的主要成分是
,用水浸取后残渣的主要成分是(3)煅烧后的固体在浸取前进行粉碎的目的是
(4)写出向NaF溶液中加入硫酸铝溶液发生反应的离子方程式:
(5)97.5 kg含CaF2 80%萤石(杂质不含氟元素)理论上可生产Na3 AlF6
您最近一年使用:0次
名校
解题方法
10 . a、b、c、d代表四种短周期主族元素。已知:a、b、c同周期,且原子序数之和为22;元素b的最简单氢化物与元素a的氢化物可化合生成离子化合物M;d是短周期中金属性最强的元素.b的最高和最低化合价的代数和为2。
请回答下列问题:
(1)a、b、c的元素符号依次为_______ 、_______ 、_______ 。d在氧气中燃烧产物的电子式为 _____________ 。
(2)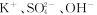 三种常见离子,在化合物M的水溶液中不能大量存在的是
三种常见离子,在化合物M的水溶液中不能大量存在的是________________ (填离子符号)。
(3)元素e为a的同主族短周期元素,e的单质可与水反应,写出反应的离子方程式:______________
(4)c的一种氢化物的相对分子质量为78,是英国科学家法拉第在1825年首先发现的,分子中两种元素的原子个数比为1:1,该氢化物的分子中有____________ 个原子共平面,写出该氢化物与e的单质在氯化铁催化作用下发生取代反应的化学方程式:_____________________ 。
请回答下列问题:
(1)a、b、c的元素符号依次为
(2)
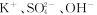 三种常见离子,在化合物M的水溶液中不能大量存在的是
三种常见离子,在化合物M的水溶液中不能大量存在的是(3)元素e为a的同主族短周期元素,e的单质可与水反应,写出反应的离子方程式:
(4)c的一种氢化物的相对分子质量为78,是英国科学家法拉第在1825年首先发现的,分子中两种元素的原子个数比为1:1,该氢化物的分子中有
您最近一年使用:0次
2016-12-09更新
|
302次组卷
|
2卷引用:2016届安徽省皖南八校高三上学期第一次联考化学试卷



