真题
解题方法
1 . 化合物1是一种药物中间体,可由下列路线合成( 代表苯基,部分反应条件略去):
代表苯基,部分反应条件略去):_______ 、_______ 。
(2)E在一定条件下还原得到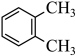 ,后者的化学名称为
,后者的化学名称为_______ 。
(3)H的结构简式为_______ 。
(4)E→F反应中、下列物质不能 用作反应溶剂的是_______ (填标号)。_______ 种(不考虑立体异构),写出其中一种同分异构体的结构简式_______ 。
①含有手性碳 ②含有2个碳碳三键 ③不含甲基
(6)参照上述合成路线,设计以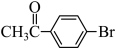 和不超过3个碳的有机物为原料,制备一种光刻胶单体
和不超过3个碳的有机物为原料,制备一种光刻胶单体 的合成路线
的合成路线_______ (其他试剂任选)。
 代表苯基,部分反应条件略去):
代表苯基,部分反应条件略去):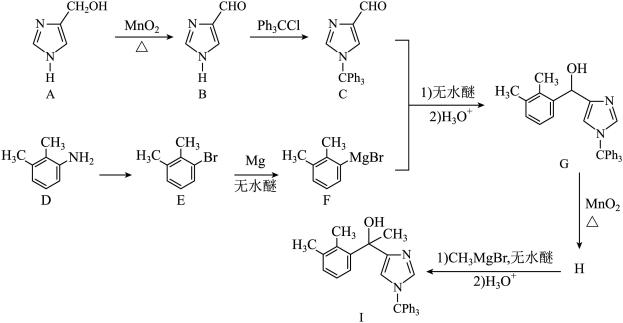
i) 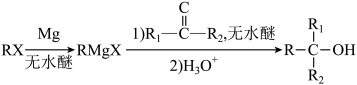
ii)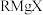 易与含活泼氢化合物(
易与含活泼氢化合物(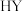 )反应:
)反应:
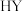 代表
代表 、
、 、
、 、
、 等。
等。
(2)E在一定条件下还原得到
 ,后者的化学名称为
,后者的化学名称为(3)H的结构简式为
(4)E→F反应中、下列物质
a. b.
b.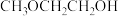 c.
c. 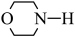 d.
d.
①含有手性碳 ②含有2个碳碳三键 ③不含甲基
(6)参照上述合成路线,设计以
 和不超过3个碳的有机物为原料,制备一种光刻胶单体
和不超过3个碳的有机物为原料,制备一种光刻胶单体 的合成路线
的合成路线
您最近一年使用:0次
2 . 乙烯是一种用途广泛的有机化工原料。由乙烷制乙烯的研究备受关注。回答下列问题:
【乙烷制乙烯】
(1) 氧化脱氢反应:
氧化脱氢反应:
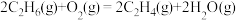
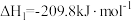
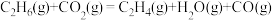
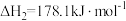
计算: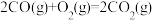

_______ 
(2) 直接脱氢反应为
直接脱氢反应为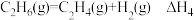 ,
, 的平衡转化率与温度和压强的关系如图所示,则
的平衡转化率与温度和压强的关系如图所示,则
_______ 0(填“>”“<”或“=”)。结合下图。下列条件中,达到平衡时转化率最接近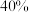 的是
的是_______ (填标号)。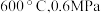 b.
b.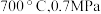 c.
c.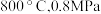
(3)一定温度和压强下、反应i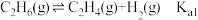
反应ⅱ (
( 远大于
远大于 )(
)( 是以平衡物质的量分数代替平衡浓度计算的平衡常数)
是以平衡物质的量分数代替平衡浓度计算的平衡常数)
①仅发生反应i时。 的平衡转化宰为
的平衡转化宰为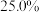 ,计算
,计算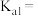
_______ 。
②同时发生反应i和ⅱ时。与仅发生反应i相比, 的平衡产率
的平衡产率_______ (填“增大”“减小”或“不变”)。
【乙烷和乙烯混合气的分离】
(4)通过 修饰的Y分子筛的吸附-脱附。可实现
修饰的Y分子筛的吸附-脱附。可实现 和
和 混合气的分离。
混合气的分离。 的
的_______ 与 分子的
分子的 键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离
键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离 和
和 的优点是
的优点是_______ 。
(5)常温常压下,将 和
和 等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度(
等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度( )之比随时间变化关系如图所示。下列推断合理的是
)之比随时间变化关系如图所示。下列推断合理的是_______ (填标号)。 ,两种气体均未被吸附
,两种气体均未被吸附
B.p点对应的时刻,出口气体的主要成分是
C.a-b对应的时间段内,吸附的 逐渐被
逐渐被 替代
替代
【乙烷制乙烯】
(1)
 氧化脱氢反应:
氧化脱氢反应: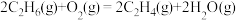
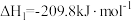
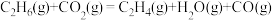
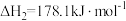
计算:
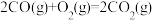


(2)
 直接脱氢反应为
直接脱氢反应为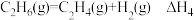 ,
, 的平衡转化率与温度和压强的关系如图所示,则
的平衡转化率与温度和压强的关系如图所示,则
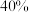 的是
的是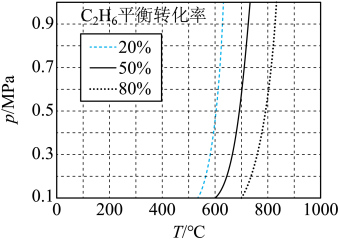
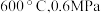 b.
b.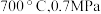 c.
c.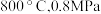
(3)一定温度和压强下、反应i
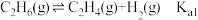
反应ⅱ
 (
( 远大于
远大于 )(
)( 是以平衡物质的量分数代替平衡浓度计算的平衡常数)
是以平衡物质的量分数代替平衡浓度计算的平衡常数)①仅发生反应i时。
 的平衡转化宰为
的平衡转化宰为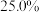 ,计算
,计算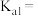
②同时发生反应i和ⅱ时。与仅发生反应i相比,
 的平衡产率
的平衡产率【乙烷和乙烯混合气的分离】
(4)通过
 修饰的Y分子筛的吸附-脱附。可实现
修饰的Y分子筛的吸附-脱附。可实现 和
和 混合气的分离。
混合气的分离。 的
的 分子的
分子的 键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离
键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离 和
和 的优点是
的优点是(5)常温常压下,将
 和
和 等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度(
等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度( )之比随时间变化关系如图所示。下列推断合理的是
)之比随时间变化关系如图所示。下列推断合理的是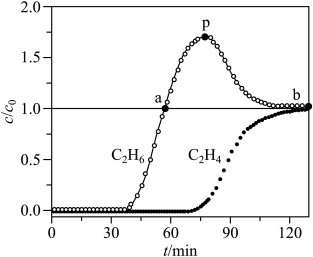
 ,两种气体均未被吸附
,两种气体均未被吸附B.p点对应的时刻,出口气体的主要成分是

C.a-b对应的时间段内,吸附的
 逐渐被
逐渐被 替代
替代
您最近一年使用:0次
真题
解题方法
3 . 测定铁矿石中铁含量的传统方法是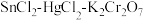 ,滴定法。研究小组用该方法测定质量为
,滴定法。研究小组用该方法测定质量为 的某赤铁矿试样中的铁含量。
的某赤铁矿试样中的铁含量。
【配制溶液】
①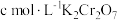 标准溶液。
标准溶液。
② 溶液:称取
溶液:称取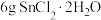 溶于
溶于 浓盐酸,加水至
浓盐酸,加水至 ,加入少量锡粒。
,加入少量锡粒。
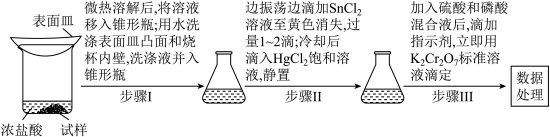
【测定含量】按下图所示(加热装置路去)操作步骤进行实验。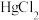 ,可将
,可将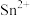 氧化为
氧化为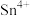 。难以氧化
。难以氧化 ;
; 可被
可被 还原为
还原为 。回答下列问题:
。回答下列问题:
(1)下列仪器在本实验中必须用到的有_______ (填名称)。 溶液时加入锡粒的原因:
溶液时加入锡粒的原因:_______ 。
(3)步骤I中“微热”的原因是_______ 。
(4)步琛Ⅲ中,若未“立即滴定”,则会导致测定的铁含量_______ (填“偏大”“偏小”或“不变”)。
(5)若消耗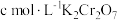 标准溶液
标准溶液 ,则
,则 试样中
试样中 的质量分数为
的质量分数为_______ (用含a、c、V的代数式表示)。
(6)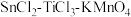 滴定法也可测定铁的含量,其主要原理是利用
滴定法也可测定铁的含量,其主要原理是利用 和
和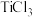 将铁矿石试样中
将铁矿石试样中 还原为
还原为 ,再用
,再用 标准溶液滴定。
标准溶液滴定。
①从环保角度分析,该方法相比于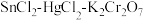 ,滴定法的优点是
,滴定法的优点是_______ 。
②为探究 溶液滴定时,
溶液滴定时, 在不同酸度下对
在不同酸度下对 测定结果的影响,分别向下列溶液中加入1滴
测定结果的影响,分别向下列溶液中加入1滴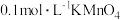 溶液,现象如下表:
溶液,现象如下表:
表中试剂X为_______ ;根据该实验可得出的结论是_______ 。
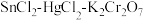 ,滴定法。研究小组用该方法测定质量为
,滴定法。研究小组用该方法测定质量为 的某赤铁矿试样中的铁含量。
的某赤铁矿试样中的铁含量。【配制溶液】
①
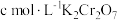 标准溶液。
标准溶液。②
 溶液:称取
溶液:称取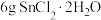 溶于
溶于 浓盐酸,加水至
浓盐酸,加水至 ,加入少量锡粒。
,加入少量锡粒。【测定含量】按下图所示(加热装置路去)操作步骤进行实验。
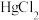 ,可将
,可将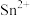 氧化为
氧化为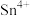 。难以氧化
。难以氧化 ;
; 可被
可被 还原为
还原为 。回答下列问题:
。回答下列问题:(1)下列仪器在本实验中必须用到的有
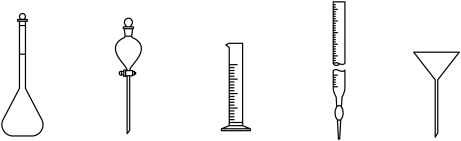
 溶液时加入锡粒的原因:
溶液时加入锡粒的原因:(3)步骤I中“微热”的原因是
(4)步琛Ⅲ中,若未“立即滴定”,则会导致测定的铁含量
(5)若消耗
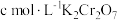 标准溶液
标准溶液 ,则
,则 试样中
试样中 的质量分数为
的质量分数为(6)
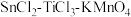 滴定法也可测定铁的含量,其主要原理是利用
滴定法也可测定铁的含量,其主要原理是利用 和
和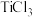 将铁矿石试样中
将铁矿石试样中 还原为
还原为 ,再用
,再用 标准溶液滴定。
标准溶液滴定。①从环保角度分析,该方法相比于
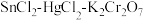 ,滴定法的优点是
,滴定法的优点是②为探究
 溶液滴定时,
溶液滴定时, 在不同酸度下对
在不同酸度下对 测定结果的影响,分别向下列溶液中加入1滴
测定结果的影响,分别向下列溶液中加入1滴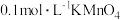 溶液,现象如下表:
溶液,现象如下表:| 溶液 | 现象 | |
| 空白实验 | 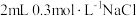 溶液 溶液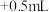 试剂X 试剂X | 紫红色不褪去 |
| 实验I | 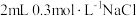 溶液 溶液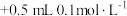 硫酸 硫酸 | 紫红色不褪去 |
| 实验ⅱ | 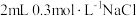 溶液 溶液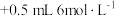 硫酸 硫酸 | 紫红色明显变浅 |
您最近一年使用:0次
真题
解题方法
4 . 精炼铜产生的铜阳极泥富含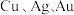 等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如下图所示。
等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如下图所示。
(1) 位于元素周期表第
位于元素周期表第_______ 周期第_______ 族。
(2)“浸出液1”中含有的金属离子主要是_______ 。
(3)“浸取2”步骤中,单质金转化为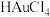 的化学方程式为
的化学方程式为_______ 。
(4)“浸取3”步骤中,“浸渣2”中的_______ (填化学式)转化为 。
。
(5)“电沉积”步骤中阴极的电极反应式为_______ 。“电沉积”步骤完成后,阴极区溶液中可循环利用的物质为_______ (填化学式)。
(6)“还原”步骤中,被氧化的 与产物
与产物 的物质的量之比为
的物质的量之比为_______ 。
(7) 可被
可被 氧化为
氧化为 。从物质结构的角度分析
。从物质结构的角度分析 的结构为(a)而不是(b)的原因:
的结构为(a)而不是(b)的原因:_______ 。
 等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如下图所示。
等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如下图所示。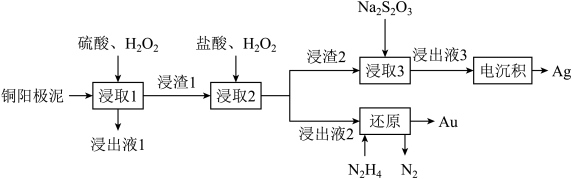
(1)
 位于元素周期表第
位于元素周期表第(2)“浸出液1”中含有的金属离子主要是
(3)“浸取2”步骤中,单质金转化为
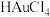 的化学方程式为
的化学方程式为(4)“浸取3”步骤中,“浸渣2”中的
 。
。(5)“电沉积”步骤中阴极的电极反应式为
(6)“还原”步骤中,被氧化的
 与产物
与产物 的物质的量之比为
的物质的量之比为(7)
 可被
可被 氧化为
氧化为 。从物质结构的角度分析
。从物质结构的角度分析 的结构为(a)而不是(b)的原因:
的结构为(a)而不是(b)的原因: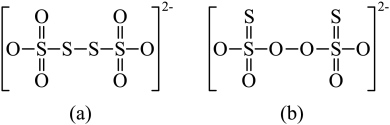
您最近一年使用:0次
解题方法
5 . 乙二胺双缩水杨醛合钴(Ⅱ)是一种简单的载氧体,对开发在特殊条件下(如潜艇、高空飞行)的氧供应材料具有重要意义。乙二胺双缩水杨醛合钴(Ⅱ)的制备原理如下图所示:
②水杨醛:微溶于水,易溶于乙醇;乙二胺;溶于水、乙醇、温度过高会引起爆炸。
制备过程如下:
Ⅱ.在搅拌条件下,加入0.55mL含0.0078mol的乙二胺,反应4~5min,生成亮黄色的乙二胺双缩水杨醛片状晶体。
Ⅲ.溶解0.0078 mol Co(CH3COO)2于热水中。
……
请回答:
(1)乙二胺中H-N-C的夹角___________ 乙二胺双缩水杨醛合钴(Ⅱ)中C-N-C的夹角(填“大于”“小于”或“等于”)。
(2)仪器A的名称为___________ 。
(3)步骤Ⅲ后的操作如下:
A.待亮黄色片状晶体全部溶解后,将Co(CH3COO)2迅速加入仪器A中,生成棕色胶状沉淀,恒温搅拌1h,使棕色胶状沉淀全部转变为暗红色晶体;
B.停止通入N2
C.过滤晶体,用5mL水洗涤3次,再用乙醇洗涤;
D.向仪器A中通入N2,并调节氮气流速至稳定;
E.停止加热,用冷水冷却仪器A;
F.向冷凝管中通入冷凝水,开始加热A,并保持温度在70~80℃;
G.真空干燥箱烘干产品,称重得2.03g产品。
①正确的操作顺序为D→F→___________ →G。
②向仪器A中通入N2的目的是___________ 。
③步骤F中保持温度在70~80℃的原因是___________ 。
④用乙醇洗涤晶体的目的是___________ 。
(4)产品的产率为___________ (列出计算式即可)。

②水杨醛:微溶于水,易溶于乙醇;乙二胺;溶于水、乙醇、温度过高会引起爆炸。
制备过程如下:

Ⅱ.在搅拌条件下,加入0.55mL含0.0078mol的乙二胺,反应4~5min,生成亮黄色的乙二胺双缩水杨醛片状晶体。
Ⅲ.溶解0.0078 mol Co(CH3COO)2于热水中。
……
请回答:
(1)乙二胺中H-N-C的夹角
(2)仪器A的名称为
(3)步骤Ⅲ后的操作如下:
A.待亮黄色片状晶体全部溶解后,将Co(CH3COO)2迅速加入仪器A中,生成棕色胶状沉淀,恒温搅拌1h,使棕色胶状沉淀全部转变为暗红色晶体;
B.停止通入N2
C.过滤晶体,用5mL水洗涤3次,再用乙醇洗涤;
D.向仪器A中通入N2,并调节氮气流速至稳定;
E.停止加热,用冷水冷却仪器A;
F.向冷凝管中通入冷凝水,开始加热A,并保持温度在70~80℃;
G.真空干燥箱烘干产品,称重得2.03g产品。
①正确的操作顺序为D→F→
②向仪器A中通入N2的目的是
③步骤F中保持温度在70~80℃的原因是
④用乙醇洗涤晶体的目的是
(4)产品的产率为
您最近一年使用:0次
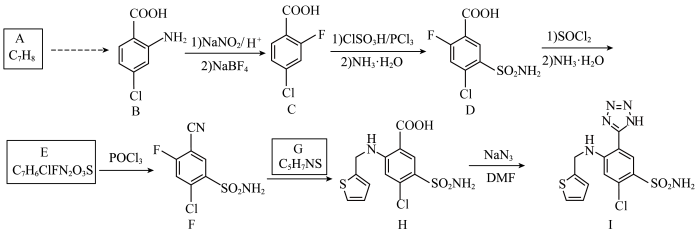
6 . 阿佐塞米(化合物I)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物.I的一种合成路线如下(部分试剂和条件略去).
回答下列问题:
(1)C中含氧官能团名称是___________ ,B生成C的反应类型为___________ 。
(2)下列说法正确的是___________。
(3)写出化合物G的结构简式___________ 。
(4)写出D生成E的第一步反应的化学方程式___________ 。
(5)写出同时符合下列条件的化合物B的一种同分异构体的结构简式_____ 。___________  (用流程图表示,无机试剂任选)。
(用流程图表示,无机试剂任选)。
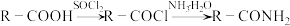
回答下列问题:
(1)C中含氧官能团名称是
(2)下列说法正确的是___________。
A.化合物F中N的杂化方式有 和 和 |
B.化合物F的分子式为: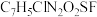 |
| C.B物质既能和强酸反应,也能和强碱反应 |
| D.A分子中所有原子可能共平面 |
(3)写出化合物G的结构简式
(4)写出D生成E的第一步反应的化学方程式
(5)写出同时符合下列条件的化合物B的一种同分异构体的结构简式
①分子中含有苯环:② 谱和
谱和 谱检测表明:分子中共有4种不同化学环境的氢原子,含有
谱检测表明:分子中共有4种不同化学环境的氢原子,含有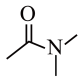 基团,没有
基团,没有 键、
键、 键.
键.
 (用流程图表示,无机试剂任选)。
(用流程图表示,无机试剂任选)。
您最近一年使用:0次
名校
7 . 普瑞巴林能用于治疗多种疾病,结构简式为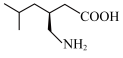 ,其合成路线如下:
,其合成路线如下:

(2)D→E反应的条件为
(3)在下图用“*”标出G化合物中的手性碳原子。
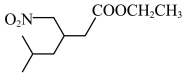
(5)符合下列条件的同分异构体,共有
ⅰ.和E互为同系物,且比E相对分子质量少14;
ⅱ.能发生银镜反应,且有机物和Ag的物质的量之比为1∶4
其中核磁共振氢谱中有三组峰且峰面积比为3∶1∶1的是
(6)已知:酚不容易与羧酸反应生成酚酯,可以用ii反应制取酚酯。
ⅰ.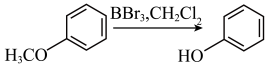
ⅱ.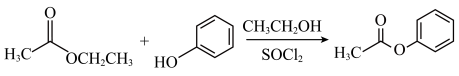
参考以上合成路线及反应条件,以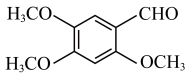 和
和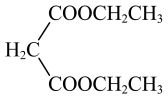 和必要的无机试剂为原料,合成
和必要的无机试剂为原料,合成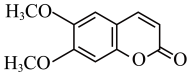 ,写出路线流程图。
,写出路线流程图。
您最近一年使用:0次
名校
8 . Ⅰ.亚硫酰氯( )又称氯化亚砜,沸点
)又称氯化亚砜,沸点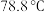 ,遇水强烈水解,是一种重要的脱水剂。
,遇水强烈水解,是一种重要的脱水剂。
(1) 属于___________。
属于___________。
(2)已知 分子中S为中心原子,其中心原子的杂化方式和分子结构分别为___________。
分子中S为中心原子,其中心原子的杂化方式和分子结构分别为___________。
(3) 的两种水解产物均是有刺激性气味的气体,其中一种产物属于强电解质。写出该产物分子的电子式
的两种水解产物均是有刺激性气味的气体,其中一种产物属于强电解质。写出该产物分子的电子式___________ 。检验另一产物的实验方法为___________ 。
(4) 作脱水剂时可使含结晶水的盐变成无水盐。设计简单实验证明其脱水性
作脱水剂时可使含结晶水的盐变成无水盐。设计简单实验证明其脱水性___________ 。
Ⅱ.工业上利用尾气 与
与 、反应合成氯化亚砜。发生如下反应:
、反应合成氯化亚砜。发生如下反应:
 反应①
反应①
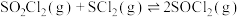 反应②
反应②
 时,在
时,在 密闭容器中,充入一定量的、
密闭容器中,充入一定量的、 和
和 ,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示,起始各组分及达平衡时
,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示,起始各组分及达平衡时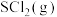 的物质的量如下表。
的物质的量如下表。
(5) 内,二氯亚砜的平均反应速率
内,二氯亚砜的平均反应速率
___________  。
。 时
时 的转化率为
的转化率为___________ 。
(6) 时,上述反应②的
时,上述反应②的
___________ 。
 )又称氯化亚砜,沸点
)又称氯化亚砜,沸点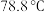 ,遇水强烈水解,是一种重要的脱水剂。
,遇水强烈水解,是一种重要的脱水剂。(1)
 属于___________。
属于___________。| A.分子晶体 | B.离子晶体 | C.共价晶体 | D.金属晶体 |
 分子中S为中心原子,其中心原子的杂化方式和分子结构分别为___________。
分子中S为中心原子,其中心原子的杂化方式和分子结构分别为___________。A. ,角形 ,角形 | B. ,三角锥形 ,三角锥形 |
C. ,平面三角形 ,平面三角形 | D. ,四面体形 ,四面体形 |
 的两种水解产物均是有刺激性气味的气体,其中一种产物属于强电解质。写出该产物分子的电子式
的两种水解产物均是有刺激性气味的气体,其中一种产物属于强电解质。写出该产物分子的电子式(4)
 作脱水剂时可使含结晶水的盐变成无水盐。设计简单实验证明其脱水性
作脱水剂时可使含结晶水的盐变成无水盐。设计简单实验证明其脱水性Ⅱ.工业上利用尾气
 与
与 、反应合成氯化亚砜。发生如下反应:
、反应合成氯化亚砜。发生如下反应: 反应①
反应①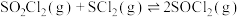 反应②
反应② 时,在
时,在 密闭容器中,充入一定量的、
密闭容器中,充入一定量的、 和
和 ,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示,起始各组分及达平衡时
,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示,起始各组分及达平衡时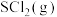 的物质的量如下表。
的物质的量如下表。
| 物质 |  |  | 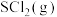 | 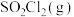 |  |
起始 | 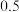 | 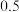 | 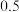 | 0 | 0 |
平衡 | 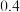 |
 内,二氯亚砜的平均反应速率
内,二氯亚砜的平均反应速率
 。
。 时
时 的转化率为
的转化率为(6)
 时,上述反应②的
时,上述反应②的
您最近一年使用:0次
解题方法
9 . 钕铁硼永磁材料被广泛应用于汽车、家电、电子产品等领域。以江西赣州某公司的钕铁硼油泥废料(主要物相为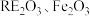 )为原料,回收有价金属的工艺流程如图所示。
)为原料,回收有价金属的工艺流程如图所示。
②配位阴离子的稳定常数越大,配位阴离子越稳定。几种配位阴离子的稳定常数如下:
回答下列问题:
(1)钕(Nd)属于f区元素,其原子轨道共有___________ 种不同的形状。
(2) 溶液能洗涤钕铁硼油泥废料的原因是
溶液能洗涤钕铁硼油泥废料的原因是___________ (用离子方程式表示)。
(3)浸取后,对浸取液进行紫外可见光光度测试,结果如图所示。写出 与盐酸反应的离子方程式:
与盐酸反应的离子方程式:___________ 。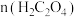 )与
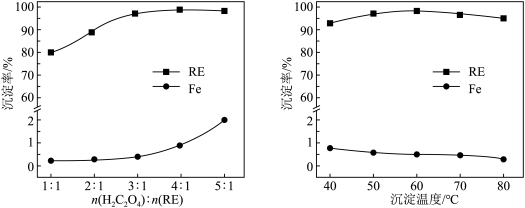
)与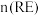 的最佳物质的量之比为
的最佳物质的量之比为___________ ,请说明原因:___________ 。最佳沉淀温度为60℃,,温度继续升高,稀土沉淀率略下降的原因可能是___________ 。
(5)在沉淀后的滤液中加入 ,溶液中主要存在的配位阴离子是
,溶液中主要存在的配位阴离子是___________ ,该离子在加入铁粉后生成 的离子方程式为
的离子方程式为___________ 。
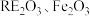 )为原料,回收有价金属的工艺流程如图所示。
)为原料,回收有价金属的工艺流程如图所示。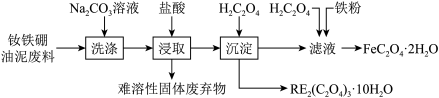
②配位阴离子的稳定常数越大,配位阴离子越稳定。几种配位阴离子的稳定常数如下:
| 配位阴离子 |  | 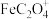 |  | 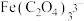 |
| 稳定常数 | 25.4 | 9.4 | 16.2 | 20.2 |
(1)钕(Nd)属于f区元素,其原子轨道共有
(2)
 溶液能洗涤钕铁硼油泥废料的原因是
溶液能洗涤钕铁硼油泥废料的原因是(3)浸取后,对浸取液进行紫外可见光光度测试,结果如图所示。写出
 与盐酸反应的离子方程式:
与盐酸反应的离子方程式: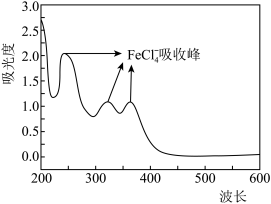
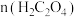 )与
)与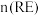 的最佳物质的量之比为
的最佳物质的量之比为(5)在沉淀后的滤液中加入
 ,溶液中主要存在的配位阴离子是
,溶液中主要存在的配位阴离子是 的离子方程式为
的离子方程式为
您最近一年使用:0次
2024-03-09更新
|
528次组卷
|
6卷引用:大题预测卷(安徽专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
(已下线)大题预测卷(安徽专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)(已下线)大题预测卷01 (新高考通用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)(已下线)大题预测卷(新七省高考专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)(已下线)大题预测卷(江西专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)江西省赣州市2024届高三下学期3月摸底考试化学试题江西省赣州市2024届高三下学期年3月摸底考试化学试题
10 . 硫脲[ ]是一种有机合成中常用的试剂。实验室合成硫脲的装置(夹持和加热装置省略)如图所示。
]是一种有机合成中常用的试剂。实验室合成硫脲的装置(夹持和加热装置省略)如图所示。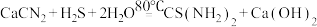
回答下列问题:
(1)硫脲分子中的所有原子均满足2电子或8电子稳定结构,该分子中σ键与π键的数目之比为___________ 。
(2)仪器a的名称是___________ ,用离子方程式表示B中饱和NaHS溶液的作用___________ 。
(3)C中适宜的加热方式是___________ 。
(4)已知 溶于水得到二元弱酸氢硫酸,若反应结束后D中溶液含等物质的量的
溶于水得到二元弱酸氢硫酸,若反应结束后D中溶液含等物质的量的 和NaOH,下列表达式正确的是___________(填字母)。
和NaOH,下列表达式正确的是___________(填字母)。
(5)反应结束后将C中溶液进行一系列处理得到含硫脲的产品。按如下步骤测定产品中硫脲的含量:
步骤1:称取20.00g产品溶于水,配制成100mL溶液备用
步骤2:向一锥形瓶中加入0.03mol碘单质和足量NaOH溶液,发生反应: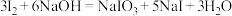
步骤3:向锥形瓶中加入10.00mL步骤1配制的溶液,发生反应: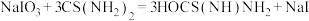
步骤4:待步骤3反应充分后加稀硫酸,发生反应: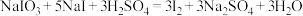
步骤5:以淀粉溶液作为指示剂,用1.00 的
的 ,标准液滴定步骤4得到的溶液,发生反应:
,标准液滴定步骤4得到的溶液,发生反应: ,平行滴定三次,消耗
,平行滴定三次,消耗 标准液的平均体积为20.00mL
标准液的平均体积为20.00mL
①判断达到滴定终点的实验现象是___________ 。
②产品中硫脲的含量为___________ 。
③下列操作会导致测得的硫脲含量偏高的是___________ (填字母)。
A.配制溶液时,所用容量瓶未干燥
B.“步骤4”加入稀硫酸的量不足
C.盛装 标准液的试管未润洗
标准液的试管未润洗
D.滴定开始时俯视读数,达到滴定终点时仰视读数
 ]是一种有机合成中常用的试剂。实验室合成硫脲的装置(夹持和加热装置省略)如图所示。
]是一种有机合成中常用的试剂。实验室合成硫脲的装置(夹持和加热装置省略)如图所示。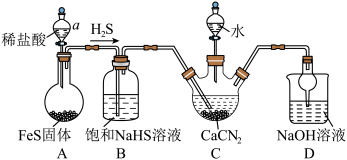
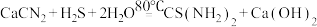
回答下列问题:
(1)硫脲分子中的所有原子均满足2电子或8电子稳定结构,该分子中σ键与π键的数目之比为
(2)仪器a的名称是
(3)C中适宜的加热方式是
(4)已知
 溶于水得到二元弱酸氢硫酸,若反应结束后D中溶液含等物质的量的
溶于水得到二元弱酸氢硫酸,若反应结束后D中溶液含等物质的量的 和NaOH,下列表达式正确的是___________(填字母)。
和NaOH,下列表达式正确的是___________(填字母)。A.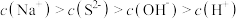 |
B. |
C. |
D.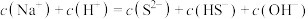 |
(5)反应结束后将C中溶液进行一系列处理得到含硫脲的产品。按如下步骤测定产品中硫脲的含量:
步骤1:称取20.00g产品溶于水,配制成100mL溶液备用
步骤2:向一锥形瓶中加入0.03mol碘单质和足量NaOH溶液,发生反应:
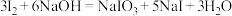
步骤3:向锥形瓶中加入10.00mL步骤1配制的溶液,发生反应:
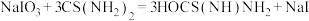
步骤4:待步骤3反应充分后加稀硫酸,发生反应:
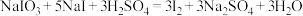
步骤5:以淀粉溶液作为指示剂,用1.00
 的
的 ,标准液滴定步骤4得到的溶液,发生反应:
,标准液滴定步骤4得到的溶液,发生反应: ,平行滴定三次,消耗
,平行滴定三次,消耗 标准液的平均体积为20.00mL
标准液的平均体积为20.00mL①判断达到滴定终点的实验现象是
②产品中硫脲的含量为
③下列操作会导致测得的硫脲含量偏高的是
A.配制溶液时,所用容量瓶未干燥
B.“步骤4”加入稀硫酸的量不足
C.盛装
 标准液的试管未润洗
标准液的试管未润洗 D.滴定开始时俯视读数,达到滴定终点时仰视读数
您最近一年使用:0次
2024-03-09更新
|
566次组卷
|
4卷引用:大题预测卷(安徽专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
(已下线)大题预测卷(安徽专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)(已下线)大题02 化学实验综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)广西壮族自治区河池市2024届高三高考联合模拟考试(3月)化学试题广西2024年高考联合模拟考试(3月)化学试题



