1 . 过二硫酸钠( )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: 。
。
(1)写出装置中生成 的反应的化学方程式:
的反应的化学方程式:___________ 。
(2)盛装NaOH溶液的仪器名称为___________ ,持续通入氮气的目的是___________ 。
(3)装置中硫酸的作用是___________ 。
(4)某兴趣小组设计实验探究不同环境下 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
①在___________ (填“中性”“酸性”或“碱性”)条件下, 的氧化能力最强。
的氧化能力最强。
②若用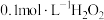 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___________ ;达到滴定终点时,消耗 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中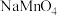 的质量为
的质量为___________ g(用含 的代数式表示,
的代数式表示,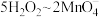 )
)
 )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: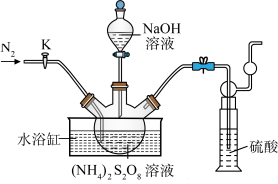
 。
。(1)写出装置中生成
 的反应的化学方程式:
的反应的化学方程式:(2)盛装NaOH溶液的仪器名称为
(3)装置中硫酸的作用是
(4)某兴趣小组设计实验探究不同环境下
 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变为深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色( ) ) | 10s后溶液逐渐变为深紫色( ),没有明显冒气泡现象 ),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀硫酸无明显现象 | 煮沸3min后,有气泡冒出 |
 的氧化能力最强。
的氧化能力最强。②若用
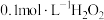 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中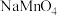 的质量为
的质量为 的代数式表示,
的代数式表示,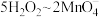 )
)
您最近一年使用:0次
解题方法
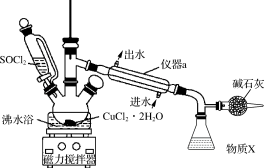
2 . 氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2,并回收过量的SOCl2。回答下列问题:
②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2 CuCl2+2SO2↑+4HCl↑。
CuCl2+2SO2↑+4HCl↑。
(1)仪器a的名称是_______ ,锥形瓶中得到的物质X的化学式为_______ 。
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是_______
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(滴定反应为I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
①滴定到终点时溶液中的颜色变化是_______
②该试样中铜元素的百分含量为_______ 。
②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2
 CuCl2+2SO2↑+4HCl↑。
CuCl2+2SO2↑+4HCl↑。(1)仪器a的名称是
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(滴定反应为I2+2S2O
 =S4O
=S4O +2I-)。
+2I-)。①滴定到终点时溶液中的颜色变化是
②该试样中铜元素的百分含量为
您最近一年使用:0次
名校
解题方法
3 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛应用于纺织业和造纸业。利用碱性NaBH4溶液或Zn还原含硫化合物是制备Na2S2O4常用方法。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入___________ (请完成溶液配制,所需试剂为40gNaOH固体及12gNaBH4固体)。
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是___________ 。

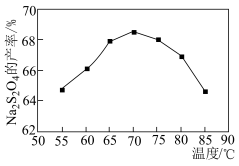
(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是___________ 。Na2S2O4在水溶液中发生歧化反应的离子方程式为___________ 。
Ⅱ.锌粉还原法
已知:①Zn+2H2SO3 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;
②二价锌在水溶液中的存在形式与pH的关系如图所示。
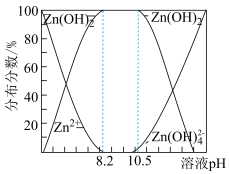
(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,___________ ,向滤液中加入氯化钠粉末至有大量晶体析出,过滤得到Na2S2O4粗品(实验中须使用的试剂:SO2、1mol·L-1NaOH溶液)。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是

(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是

Ⅱ.锌粉还原法
已知:①Zn+2H2SO3
 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;②二价锌在水溶液中的存在形式与pH的关系如图所示。

(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,
您最近一年使用:0次
2024-02-22更新
|
343次组卷
|
2卷引用:江苏省南通市如东中学,如东一高等四校2023-2024学年高三上学期12月学情调研化学试题
名校
4 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+),实现镍、钴、镁元素的回收。
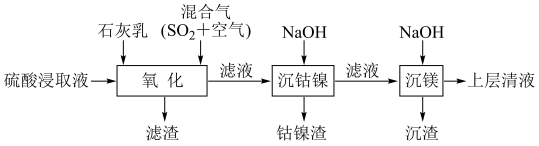
回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为___________ 。(答出一条即可)
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:___________ 。
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为___________ 。(H2SO5的电离第一步完全,第二步微弱)
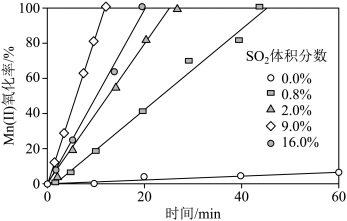
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。
(5)将“钴镍渣”酸溶后,进行如下流程:
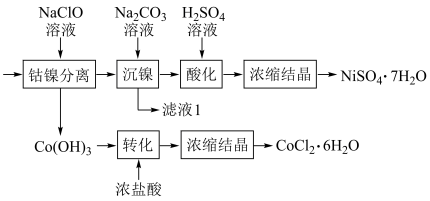
①写出“钴镍分离”时发生反应的离子方程式:___________ 。
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率=___________ (要求写出计算过程)。[已知:Ksp(NiCO3)=1.0×10-7,沉镍率= ]
]

回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是

(5)将“钴镍渣”酸溶后,进行如下流程:

①写出“钴镍分离”时发生反应的离子方程式:
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO
 )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率= ]
]
您最近一年使用:0次
名校
解题方法
5 . 关于氢能源制取和CO2减排和成为研究热点。
(一)热解H2S制H2.根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(s) 2H2(g)+S2(g);ΔH1=170kJ·mol-1
2H2(g)+S2(g);ΔH1=170kJ·mol-1
Ⅱ.CH4(g)+S2(g) CS2(g)+2H2(g);ΔH2=64kJ·mol-1
CS2(g)+2H2(g);ΔH2=64kJ·mol-1
总反应:Ⅲ.2H2S(g)+CH4(g) CS2(g)+4H2(g)
CS2(g)+4H2(g)
投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
(1)①已知ΔG=ΔH-TΔS,当ΔG<0时,反应Ⅲ能自发进行的条件是___________ 。
②在950~1150℃范围内(其他条件不变),S2(g)的体积分数随温度升高的变化是___________ (填“先升高后降低”或“先降低后升高”),分析原因:___________ 。
(二)我国科学家研究LiCO2电池,在获得能量的同时可以达到碳固定的目的。LiCO2电池中,Li为单质锂片。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行。
Ⅰ.2CO2+2e-=C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ.___________
Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
(2)写出步骤Ⅲ的离子方程式________ 。
(三)科研的工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳减排的目标,如图所示。
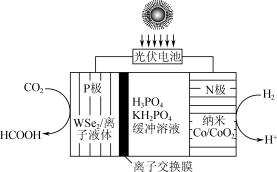
(3)①离子交换膜为质子交换膜,当消耗标准状况下11.2LH2时,P极电解液质量变化情况为___________ 。
②光伏电池中涉及NOCl光化学分解反应,在一定频率(ν)光的照射下机理如下:NOCl+hν→NOCl*、NOCl+NOCl*→2NO+Cl2,其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收___________ mol光子。
(四)已知反应CO2(g)+H2(g) HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g)
HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g) HCOOH(g) K=2。
HCOOH(g) K=2。
(4)实验测得v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。温度为T2℃时,k正=1.8k逆,则T2℃>T1℃,请通过计算说明原因:___________ 。
(一)热解H2S制H2.根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(s)
 2H2(g)+S2(g);ΔH1=170kJ·mol-1
2H2(g)+S2(g);ΔH1=170kJ·mol-1Ⅱ.CH4(g)+S2(g)
 CS2(g)+2H2(g);ΔH2=64kJ·mol-1
CS2(g)+2H2(g);ΔH2=64kJ·mol-1总反应:Ⅲ.2H2S(g)+CH4(g)
 CS2(g)+4H2(g)
CS2(g)+4H2(g)投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
| H2/V(%) | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
| CS2/V(%) | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
(1)①已知ΔG=ΔH-TΔS,当ΔG<0时,反应Ⅲ能自发进行的条件是
②在950~1150℃范围内(其他条件不变),S2(g)的体积分数随温度升高的变化是
(二)我国科学家研究LiCO2电池,在获得能量的同时可以达到碳固定的目的。LiCO2电池中,Li为单质锂片。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行。
Ⅰ.2CO2+2e-=C2O

Ⅱ.C2O
 =CO2+CO
=CO2+CO
Ⅲ.___________
Ⅳ.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3(2)写出步骤Ⅲ的离子方程式
(三)科研的工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳减排的目标,如图所示。

(3)①离子交换膜为质子交换膜,当消耗标准状况下11.2LH2时,P极电解液质量变化情况为
②光伏电池中涉及NOCl光化学分解反应,在一定频率(ν)光的照射下机理如下:NOCl+hν→NOCl*、NOCl+NOCl*→2NO+Cl2,其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收
(四)已知反应CO2(g)+H2(g)
 HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g)
HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g) HCOOH(g) K=2。
HCOOH(g) K=2。(4)实验测得v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。温度为T2℃时,k正=1.8k逆,则T2℃>T1℃,请通过计算说明原因:
您最近一年使用:0次
名校
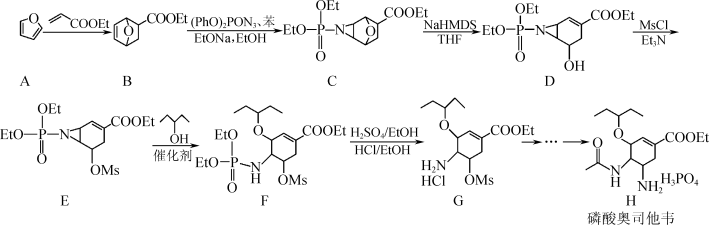
6 . 化合物H(磷酸奥司他韦)适用于流感病毒的治疗,尤其对甲流效果明显,部分合成路线如下:
注:Et-:C2H5-;Ms-: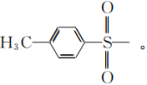
(1)H中含氧官能团的名称为醚键、___________ ;A→B的反应类型为___________ 。
(2)D→E反应中使用Et3N的作用为___________ 。
(3)E转化为F时有副产品M(与F互为同分异构体)生成,M的结构简式为___________ 。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________ 。
①分子中含有3种不同化学环境的氢原子;
②不能与FeCl3发生显色反应;
③1mol该同分异构体能与活泼金属钠反应产生1.5molH2。
(5)写出以 、CH3CH2OH、(PhO)2PON3为原料制备
、CH3CH2OH、(PhO)2PON3为原料制备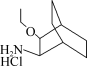 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。__________

注:Et-:C2H5-;Ms-:

(1)H中含氧官能团的名称为醚键、
(2)D→E反应中使用Et3N的作用为
(3)E转化为F时有副产品M(与F互为同分异构体)生成,M的结构简式为
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①分子中含有3种不同化学环境的氢原子;
②不能与FeCl3发生显色反应;
③1mol该同分异构体能与活泼金属钠反应产生1.5molH2。
(5)写出以
 、CH3CH2OH、(PhO)2PON3为原料制备
、CH3CH2OH、(PhO)2PON3为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
您最近一年使用:0次
名校
7 . 锰元素能形成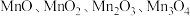 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为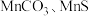 ),和软锰矿(主要成分为
),和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
已知: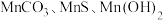 常温下皆为难溶于水的固体,硫化氢
常温下皆为难溶于水的固体,硫化氢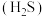 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
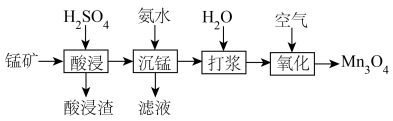
(1)“酸浸”: 溶于硫酸的离子方程式:
溶于硫酸的离子方程式:___________ 。
(2)“打浆”:将所得 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是___________ 。
(3)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。
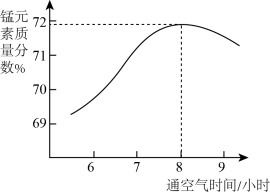
通空气超过8小时,产物中锰元素质量分数减小的原因是___________ 。
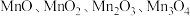 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为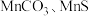 ),和软锰矿(主要成分为
),和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。已知:
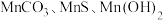 常温下皆为难溶于水的固体,硫化氢
常温下皆为难溶于水的固体,硫化氢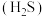 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
(1)“酸浸”:
 溶于硫酸的离子方程式:
溶于硫酸的离子方程式:(2)“打浆”:将所得
 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是(3)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。

通空气超过8小时,产物中锰元素质量分数减小的原因是
您最近一年使用:0次
解题方法
8 . 硫酸亚铁可用于治疗缺铁性贫血症。某兴趣小组为探究硫酸亚铁的分解产物,设计实验方案如下:
①先按要求搭配好装置再检查装置的气密性;
②打开弹簧夹K1和K2,向装置中缓缓通入N2一段时间后,加热装有15.20gFeSO4的硬质玻璃管;
③观察到的实验现象:A装置中有红棕色固体出现,B中有白色沉淀生成,C中品红溶液褪色;
④冷却后A装置中剩余固体的质量为10.88g。

(1)根据B装置中的实验现象可推测分解产物中含有_____ (填化学式)。
(2)将装置B、C顺序颠倒_____ (填“能”或“不能”)达到原来的实验目的,原因是_____ 。
(3)D装置中发生的主要反应的离子反应方程式是_____ 。
(4)通过计算确定已分解的FeSO4物质的量(写出计算过程)_____ 。
①先按要求搭配好装置再检查装置的气密性;
②打开弹簧夹K1和K2,向装置中缓缓通入N2一段时间后,加热装有15.20gFeSO4的硬质玻璃管;
③观察到的实验现象:A装置中有红棕色固体出现,B中有白色沉淀生成,C中品红溶液褪色;
④冷却后A装置中剩余固体的质量为10.88g。

(1)根据B装置中的实验现象可推测分解产物中含有
(2)将装置B、C顺序颠倒
(3)D装置中发生的主要反应的离子反应方程式是
(4)通过计算确定已分解的FeSO4物质的量(写出计算过程)
您最近一年使用:0次
9 . 近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇(CH3OH)。其工艺流程如图所示:

(1)甲醇具有的官能团名称是_____ 。
(2)在分解池中,发生反应的化学反应方程式为_____ 。
(3)在合成塔中的反应条件下,0.1molCO2参与反应生成CH3OH,转移的电子的物质的量为_____ mol。
(4)乙酸甲酯(C3H6O2)是合成某些香料的原料,可由甲醇与乙酸在浓硫酸、加热条件下反应得到。生成乙酸甲酯的化学反应方程式是_____ 。

(1)甲醇具有的官能团名称是
(2)在分解池中,发生反应的化学反应方程式为
(3)在合成塔中的反应条件下,0.1molCO2参与反应生成CH3OH,转移的电子的物质的量为
(4)乙酸甲酯(C3H6O2)是合成某些香料的原料,可由甲醇与乙酸在浓硫酸、加热条件下反应得到。生成乙酸甲酯的化学反应方程式是
您最近一年使用:0次
名校
解题方法
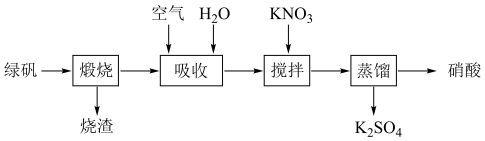
10 . 我国在明代就有了利用绿矾(FeSO4·7H2O)和硝酸钾制备硝酸的工艺,其主要流程如下:_______ 。
(2)“吸收”过程通入足量空气的目的是_______ 。
(3)“蒸馏”获得的硝酸液体显黄色是因为溶有_______ (用化学式表示)。
(4)通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.2000 g样品置于锥形瓶中,用50 mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.02000 mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液41.00 mL。___
(2)“吸收”过程通入足量空气的目的是
(3)“蒸馏”获得的硝酸液体显黄色是因为溶有
(4)通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.2000 g样品置于锥形瓶中,用50 mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.02000 mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液41.00 mL。
已知:8H++MnO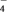 +5Fe2+=Mn2++5Fe3++4H2O。计算硫酸亚铁晶体样品中FeSO4·7H2O的质量分数(写出计算过程)。
+5Fe2+=Mn2++5Fe3++4H2O。计算硫酸亚铁晶体样品中FeSO4·7H2O的质量分数(写出计算过程)。
您最近一年使用:0次
2024-01-10更新
|
127次组卷
|
3卷引用:江苏省连云港市2023-2024学年高二上学期普通高中学业水平合格性考试模拟化学试题



