1 . 某实验小组研究Zn单质与三价铁盐的反应。
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
【实验过程】
【分析解释】
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为___________ 。
(2)实验II中,产生的大量气体为___________ (填化学式)。
(3)实验III中,溶液变成深棕色,NO 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:___________ 。
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为___________ (填实验编号)。
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为___________
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO
 [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。【实验过程】
| 实验 | 编号 | 试剂 | 现象 |
| I | 0.1 mol·L-1 FeCl3溶液(pH≈1.30 ) | 黄色溶液很快变浅,有无色气泡产生,无铁产生 |
| II | 1 mol·L-1 FeCl3溶液 (pH≈0.70 ) | 片刻后有大量气体产生,出现红褐色浑浊,约半小时后,产生红褐色沉淀,溶液颜色变浅,产生少量铁 | |
| III | 1 mol·L-1 Fe(NO3)3溶液(pH≈0.70 ) | 约半小时后,溶液变为深棕色且浑浊,无铁产生 | |
| IV | 0.5 mol·L-1 Fe2(SO4)3溶液(pH≈0.70 ) | 约半小时后,溶液呈浅绿色且浑浊,产生少量铁 |
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为
(2)实验II中,产生的大量气体为
(3)实验III中,溶液变成深棕色,NO
 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:3Zn + NO
NO +8H+=3Zn2++
+8H+=3Zn2++ ___________+4H2O
___________+4H2O
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为
您最近一年使用:0次
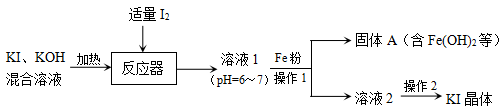
2 . KI广泛用于皮肤科、眼科等疾病的治疗,可以利用海水中获得的I2与KI、KOH的混合溶液为原料制备KI,流程如下:
ii.pH=6~7的溶液显弱酸性;
iii.KI的溶解度:
(1)溶液1中的溶质主要为KI、___________ (填化学式)。
(2)使用粉末状的铁能加快反应速率,原因是___________ 。
(3)用文字描述Fe所起的作用是___________ 。
(4)向固体A中加入稀硫酸能够制备FeSO4,该过程的离子方程式:___________ 、___________ 。
(5)操作2是___________ ,过滤,洗涤,干燥。
ii.pH=6~7的溶液显弱酸性;
iii.KI的溶解度:
| 温度/℃ | 6 | 20 | 60 | 100 |
| KI溶解度/g | 128 | 140 | 176 | 206 |
(2)使用粉末状的铁能加快反应速率,原因是
(3)用文字描述Fe所起的作用是
(4)向固体A中加入稀硫酸能够制备FeSO4,该过程的离子方程式:
(5)操作2是
您最近一年使用:0次
解题方法
3 . 化学电池的发明,改变了人们的生活方式。
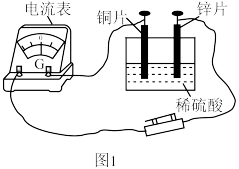
(1)某原电池实验装置如图1。 片作
片作_______ (填“正极”或“负极”)。
② 片上的电极反应为
片上的电极反应为_______ 。
③能证明化学能转化为电能的实验现象是_______ 。
(2)某种氢氧燃料电池的装置如图2所示。
下列说法正确的是_______ (填字母)。
 在负极发生反应
在负极发生反应  发生还原反应
发生还原反应
(1)某原电池实验装置如图1。
 片作
片作②
 片上的电极反应为
片上的电极反应为③能证明化学能转化为电能的实验现象是
(2)某种氢氧燃料电池的装置如图2所示。


下列说法正确的是
 在负极发生反应
在负极发生反应  发生还原反应
发生还原反应
您最近一年使用:0次
解题方法
4 . 为探究 与
与 的反应,小组同学选用两种不同的铁盐进行了如下实验。
的反应,小组同学选用两种不同的铁盐进行了如下实验。
【查阅资料】
ⅰ. 在水溶液中不能稳定存在。
在水溶液中不能稳定存在。
ⅱ.氯化亚铜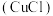 是难溶于水的白色固体。
是难溶于水的白色固体。
【分析解释】
(1)实验Ⅰ中发生反应的离子方程式是_______ 。
(2)为探究实验Ⅱ中白色固体是否为 ,小组同学设计并完成了如图实验。
,小组同学设计并完成了如图实验。 价铜的实验现象是
价铜的实验现象是_______ 。
② 中滴加
中滴加 溶液的目的是
溶液的目的是_______ 。
通过以上实验,证明了实验Ⅱ中白色固体为 。
。
【反思评价】
(3)实验Ⅰ和实验Ⅱ现象不同的原因可能是_______ 。
 与
与 的反应,小组同学选用两种不同的铁盐进行了如下实验。
的反应,小组同学选用两种不同的铁盐进行了如下实验。| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 向盛有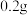 铜片的试管中加入 铜片的试管中加入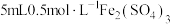 溶液 溶液 | 铜片部分溶解,溶液变为蓝色 |
| Ⅱ | 向盛有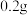 铜片的试管中加入 铜片的试管中加入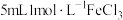 溶液 溶液 | 铜片部分溶解,溶液黄色变浅,铜片表面有白色固体出现 |
ⅰ.
 在水溶液中不能稳定存在。
在水溶液中不能稳定存在。ⅱ.氯化亚铜
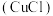 是难溶于水的白色固体。
是难溶于水的白色固体。【分析解释】
(1)实验Ⅰ中发生反应的离子方程式是
(2)为探究实验Ⅱ中白色固体是否为
 ,小组同学设计并完成了如图实验。
,小组同学设计并完成了如图实验。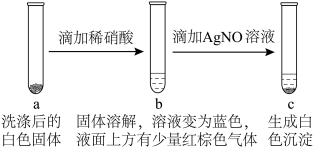
 价铜的实验现象是
价铜的实验现象是②
 中滴加
中滴加 溶液的目的是
溶液的目的是通过以上实验,证明了实验Ⅱ中白色固体为
 。
。【反思评价】
(3)实验Ⅰ和实验Ⅱ现象不同的原因可能是
您最近一年使用:0次
5 . 氨和硝酸是重要的化工原料。工业合成氨及氨氧化制取硝酸的流程示意图如图。 和
和 反应生成
反应生成 。
。 中氮元素的化合价是
中氮元素的化合价是_______ 。
(2)氧化炉中, 转化为
转化为 。为提高该反应的化学反应速率,可采取的措施是
。为提高该反应的化学反应速率,可采取的措施是_______ (写出一条即可)。
(3)吸收塔中, 最终可转化为
最终可转化为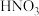 。通入空气是为了提供
。通入空气是为了提供_______ (填字母)。
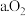
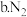
(4)尾气处理装置中,可用 将尾气中
将尾气中 还原为
还原为 。补全该反应的化学方程式:
。补全该反应的化学方程式:__________ 。
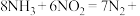 □
□

 和
和 反应生成
反应生成 。
。 中氮元素的化合价是
中氮元素的化合价是(2)氧化炉中,
 转化为
转化为 。为提高该反应的化学反应速率,可采取的措施是
。为提高该反应的化学反应速率,可采取的措施是(3)吸收塔中,
 最终可转化为
最终可转化为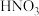 。通入空气是为了提供
。通入空气是为了提供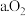
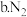
(4)尾气处理装置中,可用
 将尾气中
将尾气中 还原为
还原为 。补全该反应的化学方程式:
。补全该反应的化学方程式: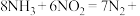 □
□
您最近一年使用:0次
解题方法
6 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了6种元素在周期表中的位置,其中①~③代表3种元素。
(1)①的元素符号是_______ 。
(2)下列能说明 比
比 失电子能力强的事实是
失电子能力强的事实是_______ (填字母)。
 比
比 更容易与水反应置换出氢
更容易与水反应置换出氢
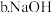 是强碱,
是强碱, 是中强碱
是中强碱
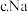 的密度比
的密度比 的小
的小
(3)非金属性②强于③,用原子结构解释原因:②和③位于同一主族,最外层电子数相同,_______ ,原子半径②小于③,得电子能力②强于③。
(4)依据元素周期律,预测气态氢化物的热稳定性: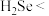
_______ (填写化学式,一种即可)。
| \ | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ||||||||
| 3 |  |  | ① | ② | ||||
| 4 |  | ③ |
(2)下列能说明
 比
比 失电子能力强的事实是
失电子能力强的事实是 比
比 更容易与水反应置换出氢
更容易与水反应置换出氢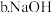 是强碱,
是强碱, 是中强碱
是中强碱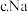 的密度比
的密度比 的小
的小(3)非金属性②强于③,用原子结构解释原因:②和③位于同一主族,最外层电子数相同,
(4)依据元素周期律,预测气态氢化物的热稳定性:
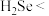
您最近一年使用:0次
解题方法
7 . 探究 和
和 的性质,进行如下实验。
的性质,进行如下实验。
(1)实验Ⅰ, 固体完全溶解,
固体完全溶解, 固体有剩余。相同条件下,在水中的溶解能力:
固体有剩余。相同条件下,在水中的溶解能力:
_______  (填“>”或“<”)。
(填“>”或“<”)。
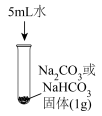
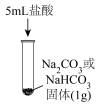
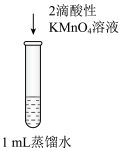
(2)实验Ⅱ,观察到均有气体产生,该气体是_______ 。
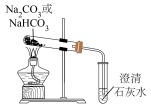
(3)实验Ⅲ,加热 固体,澄清石灰水中无明显变化;加热
固体,澄清石灰水中无明显变化;加热 固体,澄清石灰水变浑浊,写出
固体,澄清石灰水变浑浊,写出 受热分解的化学方程式:
受热分解的化学方程式:_______ 。
(4)下列说法中,正确的是_______ (填字母)。
a.可用盐酸除去 固体中少量的
固体中少量的
b.可用加热的方法鉴别 和
和 两种固体
两种固体
 和
和 的性质,进行如下实验。
的性质,进行如下实验。实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验装置 |
|
|
|
(1)实验Ⅰ,
 固体完全溶解,
固体完全溶解, 固体有剩余。相同条件下,在水中的溶解能力:
固体有剩余。相同条件下,在水中的溶解能力:
 (填“>”或“<”)。
(填“>”或“<”)。(2)实验Ⅱ,观察到均有气体产生,该气体是
(3)实验Ⅲ,加热
 固体,澄清石灰水中无明显变化;加热
固体,澄清石灰水中无明显变化;加热 固体,澄清石灰水变浑浊,写出
固体,澄清石灰水变浑浊,写出 受热分解的化学方程式:
受热分解的化学方程式:(4)下列说法中,正确的是
a.可用盐酸除去
 固体中少量的
固体中少量的
b.可用加热的方法鉴别
 和
和 两种固体
两种固体
您最近一年使用:0次
8 . 小组同学探究 与水的反应。
与水的反应。
在注射器中充入 ,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。
,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。_______ 。
(2)进一步探究无色气体增多的原因。
【查阅资料】
ⅰ. 与水反应:
与水反应: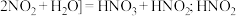 不稳定,分解产生气体。
不稳定,分解产生气体。
ⅱ. 能与KI反应生成
能与KI反应生成 。
。
【提出猜想】溶液A中含有 。
。
【进行实验】
①实验Ⅰ的目的是_______ 。
②实验Ⅱ中选择 溶液的依据是
溶液的依据是_______ (填字母)。
a. 具有氧化性,
具有氧化性, 具有还原性
具有还原性
b. 溶液有颜色,反应前后溶液颜色有变化
溶液有颜色,反应前后溶液颜色有变化
③甲同学认为,实验Ⅲ不能证明溶液A中含有 ,理由是
,理由是_______ 。
【实验反思】
本实验条件下, 与水反应生成了
与水反应生成了 ;
; 分解产生气体,且速率较小。
分解产生气体,且速率较小。
 与水的反应。
与水的反应。在注射器中充入
 ,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。
,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。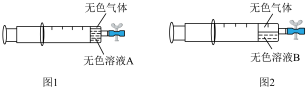
(2)进一步探究无色气体增多的原因。
【查阅资料】
ⅰ.
 与水反应:
与水反应: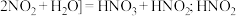 不稳定,分解产生气体。
不稳定,分解产生气体。ⅱ.
 能与KI反应生成
能与KI反应生成 。
。【提出猜想】溶液A中含有
 。
。【进行实验】
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验操作 |
|
|
|
实验现象 | 液体颜色变为浅红色 | 溶液颜色仍为无色 | 溶液颜色变为蓝色 |
②实验Ⅱ中选择
 溶液的依据是
溶液的依据是a.
 具有氧化性,
具有氧化性, 具有还原性
具有还原性b.
 溶液有颜色,反应前后溶液颜色有变化
溶液有颜色,反应前后溶液颜色有变化③甲同学认为,实验Ⅲ不能证明溶液A中含有
 ,理由是
,理由是【实验反思】
本实验条件下,
 与水反应生成了
与水反应生成了 ;
; 分解产生气体,且速率较小。
分解产生气体,且速率较小。
您最近一年使用:0次
9 . 某实验小组探究铜粉和 溶液的反应。
溶液的反应。
【查阅资料】
i. 遇
遇 生成蓝色沉淀。
生成蓝色沉淀。
ii. 能与NO反应生成棕色的
能与NO反应生成棕色的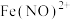 。
。
【实验过程】操作过程及实验现象如下图所示。

【分析解释】
(1)①中能说明Cu被氧化的现象是___________ 。
(2)①中具有氧化性的微粒有___________ 。
(3)②中产生蓝色沉淀,说明①中发生了反应:___________ (用离子方程式表示)。
【反思评价】
(4)小组同学反思后认为,除②中产生蓝色沉淀外,还有其它现象也能判定将Cu氧化的微粒。请结合该现象说明判断依据:___________ 。
 溶液的反应。
溶液的反应。【查阅资料】
i.
 遇
遇 生成蓝色沉淀。
生成蓝色沉淀。ii.
 能与NO反应生成棕色的
能与NO反应生成棕色的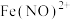 。
。【实验过程】操作过程及实验现象如下图所示。

【分析解释】
(1)①中能说明Cu被氧化的现象是
(2)①中具有氧化性的微粒有
(3)②中产生蓝色沉淀,说明①中发生了反应:
【反思评价】
(4)小组同学反思后认为,除②中产生蓝色沉淀外,还有其它现象也能判定将Cu氧化的微粒。请结合该现象说明判断依据:
您最近一年使用:0次
解题方法
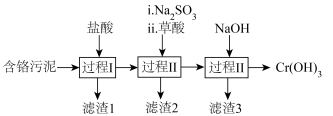
10 . 绿水青山就是金山银山,工业废水废渣均需进行处理。皮革工业含铬污泥处理的一种工艺流程如下图。
已知:草酸( )是二元弱酸。
)是二元弱酸。
(1)过程I、II、III用到的物质分离方法是___________ 。
(2)过程I的作用是从含铬污泥中浸出 、
、 等离子,为加快浸出速率,可以采取的措施是
等离子,为加快浸出速率,可以采取的措施是___________ 。(写出1种即可)
(3)过程II中,滤渣2的成分是 ,推测加入
,推测加入 的作用是
的作用是___________ 。
(4)过程III中, 转化成
转化成 沉淀的离子方程式是
沉淀的离子方程式是___________ 。

已知:草酸(
 )是二元弱酸。
)是二元弱酸。(1)过程I、II、III用到的物质分离方法是
(2)过程I的作用是从含铬污泥中浸出
 、
、 等离子,为加快浸出速率,可以采取的措施是
等离子,为加快浸出速率,可以采取的措施是(3)过程II中,滤渣2的成分是
 ,推测加入
,推测加入 的作用是
的作用是(4)过程III中,
 转化成
转化成 沉淀的离子方程式是
沉淀的离子方程式是
您最近一年使用:0次