解题方法
1 . 工业合成氨对提高农业生产意义重大。回答下列问题:_____ ( 用含
用含 和
和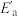 的代数式表示)。
的代数式表示)。
(2)10L密闭容器中充入 和
和 ,一定条件下反应,10min末,
,一定条件下反应,10min末, 的浓度为
的浓度为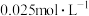 ,则0~10min时间内
,则0~10min时间内 的平均反应速率为
的平均反应速率为
_____  。此时,将容器体积压缩为5L,则达到平衡后,
。此时,将容器体积压缩为5L,则达到平衡后,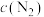
_____ (填“>”“<”或“=”) ,平衡常数K
,平衡常数K_____ (填“增大”“减小”或“不变”)。
(3)工业合成氨控制压强范围为10~30MPa,压强太低则_____ (结合速率平衡作答),压强太高对设备要求高
(4)反应物在铁催化剂表面上合成氨的反应历程可简化为图2所示,吸附在铁催化剂表面上的物种用*标注。
①该历程中能垒
_____ eV(用含a和b的代数式表示),写出该历程的化学方程式_____ 。
②铁催化合成氨时,铁表面吸附 的速率比
的速率比 快得多,则
快得多,则_____ (填“ ”或“
”或“ ”)的吸附速率决定了合成氨的整体反应速率。
”)的吸附速率决定了合成氨的整体反应速率。
③下列关于合成氨实际生产的说法正确的是_____ 。
A.选择400-500℃是因该温度下氨的平衡产率最高
B.将含 和
和 的原料气循环使用可以提高原料的转化率
的原料气循环使用可以提高原料的转化率
C.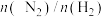 常采用1∶2.8而不是1∶3,原因是
常采用1∶2.8而不是1∶3,原因是 适度过量可加快
适度过量可加快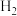 转化率
转化率
D.催化剂活性位点若被杂质气体占据,会导致 和
和 的反应速率变快
的反应速率变快

 用含
用含 和
和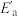 的代数式表示)。
的代数式表示)。(2)10L密闭容器中充入
 和
和 ,一定条件下反应,10min末,
,一定条件下反应,10min末, 的浓度为
的浓度为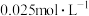 ,则0~10min时间内
,则0~10min时间内 的平均反应速率为
的平均反应速率为
 。此时,将容器体积压缩为5L,则达到平衡后,
。此时,将容器体积压缩为5L,则达到平衡后,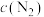
 ,平衡常数K
,平衡常数K(3)工业合成氨控制压强范围为10~30MPa,压强太低则
(4)反应物在铁催化剂表面上合成氨的反应历程可简化为图2所示,吸附在铁催化剂表面上的物种用*标注。
①该历程中能垒

②铁催化合成氨时,铁表面吸附
 的速率比
的速率比 快得多,则
快得多,则 ”或“
”或“ ”)的吸附速率决定了合成氨的整体反应速率。
”)的吸附速率决定了合成氨的整体反应速率。③下列关于合成氨实际生产的说法正确的是
A.选择400-500℃是因该温度下氨的平衡产率最高
B.将含
 和
和 的原料气循环使用可以提高原料的转化率
的原料气循环使用可以提高原料的转化率C.
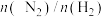 常采用1∶2.8而不是1∶3,原因是
常采用1∶2.8而不是1∶3,原因是 适度过量可加快
适度过量可加快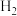 转化率
转化率D.催化剂活性位点若被杂质气体占据,会导致
 和
和 的反应速率变快
的反应速率变快
您最近一年使用:0次
2 . R是一种亲氯有机物,属于非电解质,易溶于水,在含 的溶液中能发生反应:
的溶液中能发生反应:
反应Ⅰ: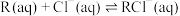 ;反应Ⅱ:
;反应Ⅱ: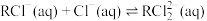
回答下列问题:
(1)写出反应Ⅰ平衡常数的表达式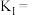
_____ 。
(2)常温下,向R溶液中加入适量NaCl,下列情况能说明反应Ⅰ和反应Ⅱ已达到平衡状态的是_____(填序号)
(3)某学习小组想研究氯水与R的反应。向水中通入 得到1L氯水(设
得到1L氯水(设 无逸出)。
无逸出)。
①写出 与
与 反应的离子方程式
反应的离子方程式_____ 。
②用pH计连续监测发现,新制氯水pH缓慢变小,原因是_____ 。
③实验测得该氯水的pH=4,计算溶液中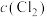 为多少?
为多少?_____ (注:写出计算过程,忽略水和HClO的电离,忽略HClO的分解)
(4)①向氯水中加入R,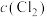 会
会_____ (填“变大”或“变小”)
②室温下,向初始浓度 的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种
的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种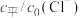 随
随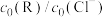 的数据记录如下表(b和d代表数字,忽略溶液体积变化):
的数据记录如下表(b和d代表数字,忽略溶液体积变化):
根据表中数据分析d=_____ 。
 的溶液中能发生反应:
的溶液中能发生反应:反应Ⅰ:
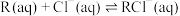 ;反应Ⅱ:
;反应Ⅱ: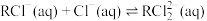
回答下列问题:
(1)写出反应Ⅰ平衡常数的表达式
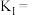
(2)常温下,向R溶液中加入适量NaCl,下列情况能说明反应Ⅰ和反应Ⅱ已达到平衡状态的是_____(填序号)
A.溶液中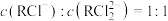 |
B.容器中生成一个R分子的同时产生一个 |
C.溶液中 不再发生变化 不再发生变化 |
| D.R的消耗速率等于生成速率 |
(3)某学习小组想研究氯水与R的反应。向水中通入
 得到1L氯水(设
得到1L氯水(设 无逸出)。
无逸出)。①写出
 与
与 反应的离子方程式
反应的离子方程式②用pH计连续监测发现,新制氯水pH缓慢变小,原因是
③实验测得该氯水的pH=4,计算溶液中
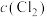 为多少?
为多少?(4)①向氯水中加入R,
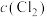 会
会②室温下,向初始浓度
 的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种
的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种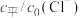 随
随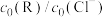 的数据记录如下表(b和d代表数字,忽略溶液体积变化):
的数据记录如下表(b和d代表数字,忽略溶液体积变化):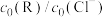 | 0 | 0.25 | 0.50 | 0.75 | 1.00 | |
 |  | 1.00 | 0.79 | 0.64 | 0.54 | 0.46 |
 | 0 | 0.09 | 0.16 | 0.22 | 0.28 | |
 | 0 | 0.06 | b | d | 0.13 | |
您最近一年使用:0次
解题方法
3 . 锂是一种重要的战略性金属,从废旧磷酸铁锂正极材料(含石墨、Al、 等,还有少量不溶性杂质)中浸取锂的工艺流程如下:
等,还有少量不溶性杂质)中浸取锂的工艺流程如下: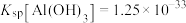 ;②
;② 。
。
(1)粉碎研磨废旧电池正极材料的目的是_____ 。
(2)完全浸出时发生主要反应的化学方程式:_____ 。
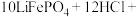 _____
_____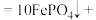 _____
_____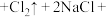 _____;
_____;
浸出时Al与酸作用的离子方程式为_____ 。
(3)滤泥中主要成分为_____ (填化学式)。
(4)当 恰好完全沉淀(浓度等于
恰好完全沉淀(浓度等于 )时,净化液中
)时,净化液中
_____ ,此时溶液pH=_____ 。
(5)沉锂后母液中可回收利用的主要物质为_____ (填名称)。
(6)已知磷酸( )为三元弱酸,“浸出”时,盐酸用量对各元素的浸出率影响如图,当盐酸用量超过1.0倍后,Fe、P元素浸出率随盐酸用量增多而增大,用平衡移动原理解释可能的原因
)为三元弱酸,“浸出”时,盐酸用量对各元素的浸出率影响如图,当盐酸用量超过1.0倍后,Fe、P元素浸出率随盐酸用量增多而增大,用平衡移动原理解释可能的原因_____ 。
 等,还有少量不溶性杂质)中浸取锂的工艺流程如下:
等,还有少量不溶性杂质)中浸取锂的工艺流程如下:
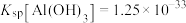 ;②
;② 。
。(1)粉碎研磨废旧电池正极材料的目的是
(2)完全浸出时发生主要反应的化学方程式:
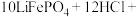 _____
_____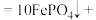 _____
_____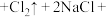 _____;
_____;浸出时Al与酸作用的离子方程式为
(3)滤泥中主要成分为
(4)当
 恰好完全沉淀(浓度等于
恰好完全沉淀(浓度等于 )时,净化液中
)时,净化液中
(5)沉锂后母液中可回收利用的主要物质为
(6)已知磷酸(
 )为三元弱酸,“浸出”时,盐酸用量对各元素的浸出率影响如图,当盐酸用量超过1.0倍后,Fe、P元素浸出率随盐酸用量增多而增大,用平衡移动原理解释可能的原因
)为三元弱酸,“浸出”时,盐酸用量对各元素的浸出率影响如图,当盐酸用量超过1.0倍后,Fe、P元素浸出率随盐酸用量增多而增大,用平衡移动原理解释可能的原因
您最近一年使用:0次
解题方法
4 . 过氧化氢( )是一种用途广泛的工业原料。回答下列问题:
)是一种用途广泛的工业原料。回答下列问题:
(1)已知:反应①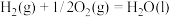
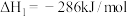
反应②
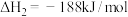
则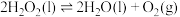 的
的
_____ kJ/mol;不同温度下 分解反应的平衡常数
分解反应的平衡常数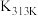
_____  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 是一种极弱的酸,在水中电离的示意图如下:
是一种极弱的酸,在水中电离的示意图如下:
①实验i和ii探究浓度对反应速率的影响,则a=_____ ,b=_____ 。
②实验_____ (填编号)探究催化剂对速率的影响,能说明催化剂加快反应速率的实验记录是_____ 。
③温度越高反应速率越快,用碰撞理论解释正确的是_____ 。
A.单位体积内活化分子数增多 B.活化分子百分数不变
C.单位体积内有效碰撞的次数增大 D.改变了反应的路径
④实验i中几乎没有收集到气体,可能原因是_____ 。
(3)写出 在生活中的一种用途
在生活中的一种用途_____ 。
 )是一种用途广泛的工业原料。回答下列问题:
)是一种用途广泛的工业原料。回答下列问题:(1)已知:反应①
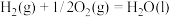
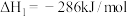
反应②

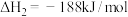
则
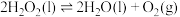 的
的
 分解反应的平衡常数
分解反应的平衡常数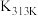
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 是一种极弱的酸,在水中电离的示意图如下:
是一种极弱的酸,在水中电离的示意图如下:| 编号 | 温度/℃ | 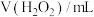 |  | 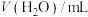 |  |
| i | 25 | 10.0 | 0 | 10.0 |  |
| ii | 25 | 15.0 | a | b |  |
| iii | 25 | 10.0 | 2.0 | c | 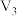 |
| iv | 60 | d | 0 | 10.0 | 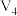 |
②实验
③温度越高反应速率越快,用碰撞理论解释正确的是
A.单位体积内活化分子数增多 B.活化分子百分数不变
C.单位体积内有效碰撞的次数增大 D.改变了反应的路径
④实验i中几乎没有收集到气体,可能原因是
(3)写出
 在生活中的一种用途
在生活中的一种用途
您最近一年使用:0次
5 . 兴趣小组模拟工业废卤水(主要含 、
、 、
、 )固定
)固定 并回收钠盐的过程,实验流程如下:
并回收钠盐的过程,实验流程如下:
(1)“调pH”的目的是使废卤水呈碱性,则X可以为___________。
(2)“固定”过程中___________。
(3)“过滤”需要使用的仪器有___________。
(4)“操作a”除对滤液调pH外,还包括___________。
(5) 可由如图装置制备。下列说法正确的是___________。
可由如图装置制备。下列说法正确的是___________。
 、
、 、
、 )固定
)固定 并回收钠盐的过程,实验流程如下:
并回收钠盐的过程,实验流程如下:
(1)“调pH”的目的是使废卤水呈碱性,则X可以为___________。
| A.CaO | B.HCl | C.NaOH | D. |
(2)“固定”过程中___________。
| A.溶液pH下降 | B.有HCl放出 |
C.需通入适量的 | D. 浓度减小 浓度减小 |
(3)“过滤”需要使用的仪器有___________。
| A.漏斗 | B.研钵 | C.烧杯 | D.玻璃棒 |
(4)“操作a”除对滤液调pH外,还包括___________。
| A.加热蒸发 | B.搅拌 | C.冷却 | D.干燥 |
(5)
 可由如图装置制备。下列说法正确的是___________。
可由如图装置制备。下列说法正确的是___________。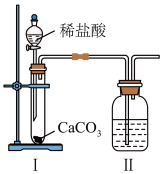
A.Ⅰ中反应为: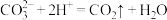 |
B.Ⅰ中装置更换合适试剂后也可用于制备 |
C.Ⅱ中盛放饱和 溶液,用于除去气体中的HCl 溶液,用于除去气体中的HCl |
D.Ⅱ中盛放饱和 溶液,用于除去气体中的HCl 溶液,用于除去气体中的HCl |
您最近一年使用:0次
6 . 拟用如图装置设计实验来探究纯净、干燥的氯气与氨气的反应。___________ 。
(2)如图中的装置连接顺序为A→___________ (用大写字母表示)。若按照正确顺序连接实验装置后,整套实验装置存在的主要缺点___________ 。
(3)写出F装置中的反应的一种工业用途:___________ 。
(4)在工业上利用反应N2+3H2 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是___________ (填字母)。
A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)

(2)如图中的装置连接顺序为A→
(3)写出F装置中的反应的一种工业用途:
(4)在工业上利用反应N2+3H2
 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)
您最近一年使用:0次
解题方法
7 . I.如图所示,在一个带导管的胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝;在A试管里加入 2 mL 浓H2SO4,盖好胶塞,使铜丝与浓H2SO4接触,加热进行反应,将生成的气体导入B试管的品红溶液中。请回答下列问题:
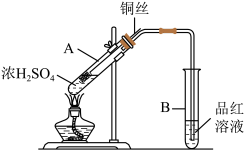
(1)铜与浓H2SO4反应,铜作
(2)B试管中的现象是
(3)本实验中将铜丝嵌入胶塞侧面的凹槽中,使铜丝可以自由抽动,该设计的特点是
Ⅱ.请回答:
(4)已知稀硫酸能与硫代硫酸钠发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2↑+H2O+S↓,下列各组实验中溶液最先变浑浊的是___________(填字母)。
| A.0.1 mol/L Na2S2O3和H2SO4各5 mL,加水5 mL,反应温度10℃ |
| B.0.1 mol/L Na2S2O3和H2SO4各5 mL,加水10 mL,反应温度10℃ |
| C.0.1 mol/L Na2S2O3和H2SO4各5 mL,加水5 mL,反应温度30℃ |
| D.0.2 mol/L Na2S2O3和H2SO4各5 mL,加水10 mL,反应温度30℃ |
您最近一年使用:0次
8 . 乙酰水杨酸,俗称阿司匹林,具有解热、镇痛、消炎和免疫调节等作用。阿司匹林可由水杨酸与乙酸酐反应得到:
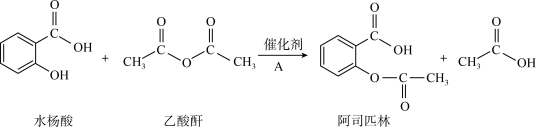
已知:
(1)乙酸酐的分子式为___________ 。
(2)水杨酸与阿司匹林含有的相同含氧官能团是___________ (写名称)。
(3)乙酸( )和甲酸甲酯(
)和甲酸甲酯(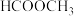 )互为
)互为___________ 。
(4)由水杨酸与乙酸酐制备阿司匹林的反应类型是___________ (填字母)。
A.取代反应 B.加成反应 C.聚合反应
(5)与乙酸类似,阿司匹林可发生酯化反应。下列物质能与阿司匹林发生酯化反应的是___________(填字母)。
(6)补充完整以 为原料合成乙酸酐的路线(写化合物的结构简式);
为原料合成乙酸酐的路线(写化合物的结构简式);__________
 →___________→___________→
→___________→___________→

已知:

(1)乙酸酐的分子式为
(2)水杨酸与阿司匹林含有的相同含氧官能团是
(3)乙酸(
 )和甲酸甲酯(
)和甲酸甲酯(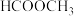 )互为
)互为(4)由水杨酸与乙酸酐制备阿司匹林的反应类型是
A.取代反应 B.加成反应 C.聚合反应
(5)与乙酸类似,阿司匹林可发生酯化反应。下列物质能与阿司匹林发生酯化反应的是___________(填字母)。
A. | B. | C. | D. |
 为原料合成乙酸酐的路线(写化合物的结构简式);
为原料合成乙酸酐的路线(写化合物的结构简式); →___________→___________→
→___________→___________→
您最近一年使用:0次
9 . 2021年10月16日,神舟十三号载人飞船与“天和”核心舱成功径向交会对接。化学助力我国航天事业发展,借助元素周期表可以认识各种材料的组成、结构和性质。a~h8种元素在元素周期表中的位置如下:
(1)液态a单质和液态d单质可用作火箭推进剂,二者反应的化学方程式为___________ 。常温下,与a单质更容易反应的是___________ (填“c”或“d”或“e”)单质。
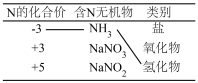
(2)空间站再生式生活保障系统能将尿液处理得到再生水,再生水后处理需除去残留的有机物和含N无机物。按示例,在答题卡相应位置补齐连线。_________
(3)我国科学家自主研发了用于航空航天的f合金材料。f原子的核外电子排布为___________ ;h最高价氧化物对应的水化物的稀溶液,与f的最高价氧化物反应的离子方程式为___________ 。
(4)g单质在太阳能电池和芯片制造等领域有着重要应用。g最高价氧化物的化学式为___________ ;b和g组成的化合物可作为新型陶瓷材料,其化学式为___________ 。上述g的两种化合物含有的化学键类型均为___________ 。
| 周期 | ⅠA | 0 | |||||||
| 1 | a | ⅡA | … | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | b | c | d | e | |||||
| 3 | f | g | h | ||||||
(2)空间站再生式生活保障系统能将尿液处理得到再生水,再生水后处理需除去残留的有机物和含N无机物。按示例,在答题卡相应位置补齐连线。

(3)我国科学家自主研发了用于航空航天的f合金材料。f原子的核外电子排布为
(4)g单质在太阳能电池和芯片制造等领域有着重要应用。g最高价氧化物的化学式为
您最近一年使用:0次
10 . SO2可用作漂白剂、食品添加剂等。某兴趣小组用如下装置制取SO2,并验证其性质:

(1)盛放 的仪器名称为
的仪器名称为___________ 。
(2)D装置用于吸收尾气。在答题卡虚线框内画出D装置图,并注明所用试剂___________ 。
(3)进行实验,观察并记录现象,做出相应解释。

(1)盛放
 的仪器名称为
的仪器名称为(2)D装置用于吸收尾气。在答题卡虚线框内画出D装置图,并注明所用试剂
(3)进行实验,观察并记录现象,做出相应解释。
| 实验操作 | 实验现象 | 分析与解释 |
| 打开装置A中的漏斗活塞 | A装置中有气泡产生 | 化学方程式为 |
| B装置中浸润过品红溶液的滤纸a的颜色 |  具有 具有 | |
B装置中浸润过酸性 溶液的滤纸b褪色 溶液的滤纸b褪色 |  具有 具有 | |
| C装置中的现象是 |  具有氧化性 具有氧化性 |
您最近一年使用:0次



