1 . Ⅰ.已知A和B两支试管的溶液中共含有 、
、 、
、 、
、 、
、 、
、 六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
(1)试管B中含有的离子为_______ ;
(2)若向试管A的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是_______ (填化学式);
(3)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,该物质可以用作_______ (列举一种用途即可),混合过程中发生反应的离子方程式为:_______ 、_______ 。
Ⅱ.甲同学用如下装置模拟“侯氏制碱法”制纯碱。
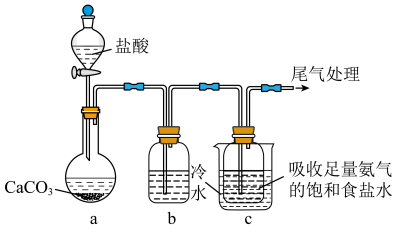
(4)c中饱和食盐水事先吸收足量 的原因是
的原因是_______ ;
(5)装置c中发生反应的离子反应方程式为_______ 。
 、
、 、
、 、
、 、
、 、
、 六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:(1)试管B中含有的离子为
(2)若向试管A的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是
(3)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,该物质可以用作
Ⅱ.甲同学用如下装置模拟“侯氏制碱法”制纯碱。

(4)c中饱和食盐水事先吸收足量
 的原因是
的原因是(5)装置c中发生反应的离子反应方程式为
您最近一年使用:0次
2 . 含氯消毒剂在生产生活中有着广泛的用途,这些都与氯气息息相关。
Ⅰ.实验室制备和收集氯气的常用装置如图:
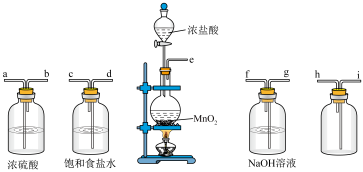
(1)在实验过程中饱和食盐水的作用是_______ 。
(2)实验装置接口的连接顺序为e→_______ →g→f;
(3)工业上常将 通入石灰乳中来制备漂白粉。使用漂白粉时,一般先将其溶于水形成溶液,在空气中放置一段时间后再使用,这样做的原因是(用化学方程式表示)
通入石灰乳中来制备漂白粉。使用漂白粉时,一般先将其溶于水形成溶液,在空气中放置一段时间后再使用,这样做的原因是(用化学方程式表示)_______ 。
Ⅱ.为探究NaCl对 在水中溶解度的影响,某兴趣小组同学进行实验,测定常温下
在水中溶解度的影响,某兴趣小组同学进行实验,测定常温下 在不同浓度NaCl溶液中的溶解度,结果如下表所示:
在不同浓度NaCl溶液中的溶解度,结果如下表所示:
已知: 在常温下水中的溶解度为
在常温下水中的溶解度为 。
。
(4)根据实验数据,当NaCl溶液浓度大于_______  时,NaCl溶液浓度增加对
时,NaCl溶液浓度增加对 在水中溶解度无明显影响;
在水中溶解度无明显影响;
(5)为进一步探究食盐水中哪些微粒能降低 在水中的溶解度,该小组同学取三支试管,分别加入一定浓度NaCl溶液、
在水中的溶解度,该小组同学取三支试管,分别加入一定浓度NaCl溶液、 溶液和KCl溶液,通入足量
溶液和KCl溶液,通入足量 后,测其溶解度,结果如下表所示:
后,测其溶解度,结果如下表所示:
请回答下列问题:
① ,b=
,b=_______  ,c=
,c=_______  ;
;
②设置实验2的目的是_______ ;
③对比实验1和实验3可以得到的结论是_______ ;
④实验结论:食盐水中能够降低 在水中溶解度的微粒有
在水中溶解度的微粒有_______ 。
Ⅰ.实验室制备和收集氯气的常用装置如图:

(1)在实验过程中饱和食盐水的作用是
(2)实验装置接口的连接顺序为e→
(3)工业上常将
 通入石灰乳中来制备漂白粉。使用漂白粉时,一般先将其溶于水形成溶液,在空气中放置一段时间后再使用,这样做的原因是(用化学方程式表示)
通入石灰乳中来制备漂白粉。使用漂白粉时,一般先将其溶于水形成溶液,在空气中放置一段时间后再使用,这样做的原因是(用化学方程式表示)Ⅱ.为探究NaCl对
 在水中溶解度的影响,某兴趣小组同学进行实验,测定常温下
在水中溶解度的影响,某兴趣小组同学进行实验,测定常温下 在不同浓度NaCl溶液中的溶解度,结果如下表所示:
在不同浓度NaCl溶液中的溶解度,结果如下表所示: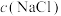 / / | 0.50 | 1.00 | 2.00 | 4.50 | 5.00 |
 溶解度( 溶解度( ) ) | 0.0658 | 0.0580 | 0.0490 | 0.0360 | 0.0360 |
 在常温下水中的溶解度为
在常温下水中的溶解度为 。
。(4)根据实验数据,当NaCl溶液浓度大于
 时,NaCl溶液浓度增加对
时,NaCl溶液浓度增加对 在水中溶解度无明显影响;
在水中溶解度无明显影响;(5)为进一步探究食盐水中哪些微粒能降低
 在水中的溶解度,该小组同学取三支试管,分别加入一定浓度NaCl溶液、
在水中的溶解度,该小组同学取三支试管,分别加入一定浓度NaCl溶液、 溶液和KCl溶液,通入足量
溶液和KCl溶液,通入足量 后,测其溶解度,结果如下表所示:
后,测其溶解度,结果如下表所示:| 实验编号 | 1 | 2 | 3 |
| 实验装置 | 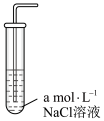 | 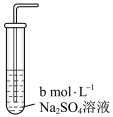 | 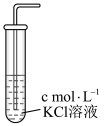 |
 溶解度 溶解度 | 0.0580 | 0.0800 | 0.0665 |
①
 ,b=
,b= ,c=
,c= ;
;②设置实验2的目的是
③对比实验1和实验3可以得到的结论是
④实验结论:食盐水中能够降低
 在水中溶解度的微粒有
在水中溶解度的微粒有
您最近一年使用:0次
3 . 焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶。其性质活泼,具有强还原性,在食品加工中作防腐剂、漂白剂、疏松剂。某实验小组拟采用如图1装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5).
(1)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式为_____________ .如果想控制反应速度,如图2中可选用的发生装置是_______________ (填写字母).
(2)装置Ⅱ中发生反应的化学方程式为:2 NaHSO3=Na2S2O5+ H2O,当有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是______________ ;某同学需要420mL0.1mol/L焦亚硫酸钠溶液来研究其性质,配制时需称量焦亚硫酸钠的质量为____________ ;配制时除用到托盘天平、药匙、烧杯、玻璃棒等仪器外,还必须用到的玻璃仪器是_______________ .
(3)装置Ⅲ用于处理尾气,可选用如图3的最合理装置(夹持仪器已略去)为____________ (填序号).

(1)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式为
(2)装置Ⅱ中发生反应的化学方程式为:2 NaHSO3=Na2S2O5+ H2O,当有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是
(3)装置Ⅲ用于处理尾气,可选用如图3的最合理装置(夹持仪器已略去)为

您最近一年使用:0次
4 . 氮是一种重要的元素,在很多物质中都含有它的身影。
(1)在9.3胜利日阅兵活动中,我国展示了多款导弹,向世界展示了我们捍卫和平的决心和能力。偏二甲肼(CH3)2NNH2是一种无色易燃的液体,常与N2O4作为常用火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g)
①该反应(Ⅰ)中氧化剂是_____________ 。
②火箭残骸中常现红棕色气体,原因为:N2O4 (g) 2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是_________ 。
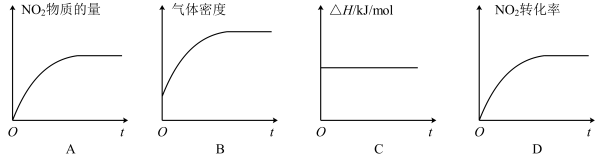
若在相同温度下,将上述反应改在体积为2L的恒容密闭容器中进行,平衡常数____________ (填“增大”“不变”或“减小”),反应4min后N2O4的物质的量为0.8mol,则0~4min内的平均反应速率v(NO2)=_________________ 。
(2)硝酸铵(NH4NO3)是一种重要的铵盐,它的主要用途作肥料及工业用和军用炸药。在25℃时,将1mol 硝酸铵溶于水,溶液显酸性,原因是__________________ (用离子方程式表示)。向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将__________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___________ mol·L-1。(NH3·H2O的电离平衡常数Kb=2×10-5 mol·L-1)
(1)在9.3胜利日阅兵活动中,我国展示了多款导弹,向世界展示了我们捍卫和平的决心和能力。偏二甲肼(CH3)2NNH2是一种无色易燃的液体,常与N2O4作为常用火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g)
①该反应(Ⅰ)中氧化剂是
②火箭残骸中常现红棕色气体,原因为:N2O4 (g)
 2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
若在相同温度下,将上述反应改在体积为2L的恒容密闭容器中进行,平衡常数
(2)硝酸铵(NH4NO3)是一种重要的铵盐,它的主要用途作肥料及工业用和军用炸药。在25℃时,将1mol 硝酸铵溶于水,溶液显酸性,原因是
您最近一年使用:0次
解题方法
5 . 一种重要的有机化工原料有机物X,下面是以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。Y是一种功能高分子材料。
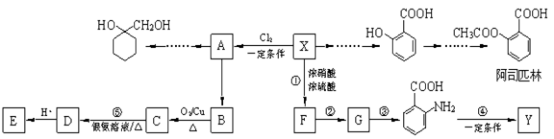
已知:(1)X为芳香烃,其相对分子质量为92
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基: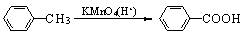
(3)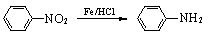 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为______________ 。
(2)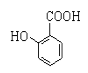 中官能团的名称为
中官能团的名称为____________________ ;
(3)反应③的反应类型是___________ ;已知A为一氯代物,则E的结构简式是____________ ;
(4)反应④的化学方程式为_______________________ ;
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有________ 种:①含有苯环;②既不能发生水解反应,也不能发生银镜反应;③1mol该有机物能与2molNaHCO3完全反应。
(6)请写出以A为原料制备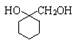 的合成路线流程图 (无机试剂任用)
的合成路线流程图 (无机试剂任用)_______ 。合成路线流程图示例如下:
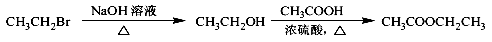

已知:(1)X为芳香烃,其相对分子质量为92
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:
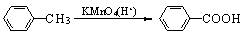
(3)
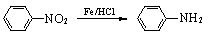 (苯胺,易被氧化)
(苯胺,易被氧化)请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为
(2)
 中官能团的名称为
中官能团的名称为(3)反应③的反应类型是
(4)反应④的化学方程式为
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有
(6)请写出以A为原料制备
 的合成路线流程图 (无机试剂任用)
的合成路线流程图 (无机试剂任用)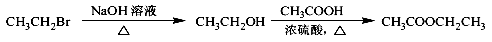
您最近一年使用:0次
2016-12-09更新
|
434次组卷
|
4卷引用:2016届江西省红色七校高三上学期第一次联考化学试卷
6 . 溴化钙是一种无色斜方针状结晶或晶块,无臭,味咸而苦。医药上用作中枢神经抑制药,具有抑制、镇静作用,用以治疗神经衰弱、癫痫等症。工业用溴化亚铁法制备,其流程如下:

(1)与液溴的反应温度不能超过40℃的原因是____________________ 。
(2)滤渣的成分可能是_________________ 。
(3)试剂M是____________ ,加入M的目的是_____________________ 。
(4)操作Ⅱ的步骤为蒸发浓缩、____________ 、洗涤、干燥
(5)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式_________________________ 。
(6)制得的CaBr2·2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g固体,则CaBr2·2H2O的质量分数为___________ 。

(1)与液溴的反应温度不能超过40℃的原因是
(2)滤渣的成分可能是
(3)试剂M是
(4)操作Ⅱ的步骤为蒸发浓缩、
(5)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式
(6)制得的CaBr2·2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g固体,则CaBr2·2H2O的质量分数为
您最近一年使用:0次



