氮是一种重要的元素,在很多物质中都含有它的身影。
(1)在9.3胜利日阅兵活动中,我国展示了多款导弹,向世界展示了我们捍卫和平的决心和能力。偏二甲肼(CH3)2NNH2是一种无色易燃的液体,常与N2O4作为常用火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g)
①该反应(Ⅰ)中氧化剂是_____________ 。
②火箭残骸中常现红棕色气体,原因为:N2O4 (g) 2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是_________ 。
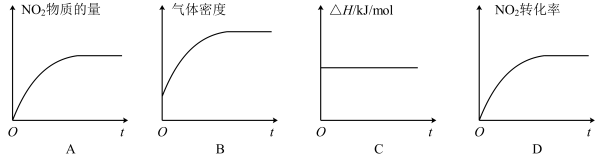
若在相同温度下,将上述反应改在体积为2L的恒容密闭容器中进行,平衡常数____________ (填“增大”“不变”或“减小”),反应4min后N2O4的物质的量为0.8mol,则0~4min内的平均反应速率v(NO2)=_________________ 。
(2)硝酸铵(NH4NO3)是一种重要的铵盐,它的主要用途作肥料及工业用和军用炸药。在25℃时,将1mol 硝酸铵溶于水,溶液显酸性,原因是__________________ (用离子方程式表示)。向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将__________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___________ mol·L-1。(NH3·H2O的电离平衡常数Kb=2×10-5 mol·L-1)
(1)在9.3胜利日阅兵活动中,我国展示了多款导弹,向世界展示了我们捍卫和平的决心和能力。偏二甲肼(CH3)2NNH2是一种无色易燃的液体,常与N2O4作为常用火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g)
①该反应(Ⅰ)中氧化剂是
②火箭残骸中常现红棕色气体,原因为:N2O4 (g)
 2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
若在相同温度下,将上述反应改在体积为2L的恒容密闭容器中进行,平衡常数
(2)硝酸铵(NH4NO3)是一种重要的铵盐,它的主要用途作肥料及工业用和军用炸药。在25℃时,将1mol 硝酸铵溶于水,溶液显酸性,原因是
更新时间:2019-01-30 18:14:09
|
相似题推荐
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐1】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
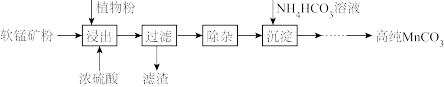
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是____ ,植物粉的作用是____ 。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是____ ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式____ 。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是____ ;该反应的化学方程式为____ ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____ 。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。_____________________________________

(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐1】氢气是一种理想的二次能源,在石油化工、冶金工业、治疗疾病、航空航天等方面有着广泛的应用。回答下列问题:
(1)已知氨分解反应 的焓变(
的焓变(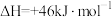 )和活化能
)和活化能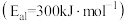 ,则合成氨反应
,则合成氨反应 的活化能
的活化能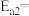
______  。
。
(2)698.4K时, 中各组分的“
中各组分的“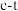 ”图像如图:
”图像如图:
正反应速率为 ,逆反应速率为
,逆反应速率为 ,其中
,其中 ,
,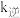 为速率常数,若
为速率常数,若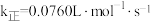 ,
,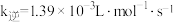 ,则A点时刻逆反应速率的计算式为
,则A点时刻逆反应速率的计算式为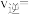
______  ,平衡常数K=
,平衡常数K=______ (保留一位小数)。
(3)在723K时,0.10mol (g)和0.20mol
(g)和0.20mol (g)在恒容密闭容器中发生反应:
(g)在恒容密闭容器中发生反应:
①

平衡后容器中的总压为50.66kPa,经分析知其中水蒸气的物质的量分数为10%,则 的转化率为
的转化率为______ 。继续向容器中加入过量CoO(s),又增加了如下两个平衡:
②

③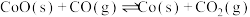

经分析,再次达到平衡后,容器中水蒸气的物质的量分数为30%,则
______  (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。
(4)对于反应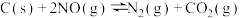 的反应体系,标准平衡常数
的反应体系,标准平衡常数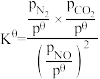 ,其中
,其中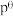 为标准压强
为标准压强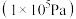 ,
, 、
、 和
和 为各组分的平衡分压,如:
为各组分的平衡分压,如: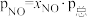 ,
, 为平衡总压,
为平衡总压, 为平衡系统中NO的物质的量分数。若NO的起始物质的量为1mol,假设反应在恒定温度和标准压强下进行,NO的平衡转化率为
为平衡系统中NO的物质的量分数。若NO的起始物质的量为1mol,假设反应在恒定温度和标准压强下进行,NO的平衡转化率为 ,则
,则
______ (用含 的最简式表示)。
的最简式表示)。
(1)已知氨分解反应
 的焓变(
的焓变(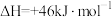 )和活化能
)和活化能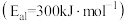 ,则合成氨反应
,则合成氨反应 的活化能
的活化能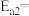
 。
。(2)698.4K时,
 中各组分的“
中各组分的“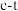 ”图像如图:
”图像如图:
正反应速率为
 ,逆反应速率为
,逆反应速率为 ,其中
,其中 ,
,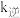 为速率常数,若
为速率常数,若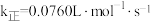 ,
,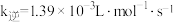 ,则A点时刻逆反应速率的计算式为
,则A点时刻逆反应速率的计算式为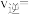
 ,平衡常数K=
,平衡常数K=(3)在723K时,0.10mol
 (g)和0.20mol
(g)和0.20mol (g)在恒容密闭容器中发生反应:
(g)在恒容密闭容器中发生反应:①


平衡后容器中的总压为50.66kPa,经分析知其中水蒸气的物质的量分数为10%,则
 的转化率为
的转化率为②


③
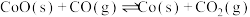

经分析,再次达到平衡后,容器中水蒸气的物质的量分数为30%,则

 (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。(4)对于反应
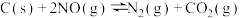 的反应体系,标准平衡常数
的反应体系,标准平衡常数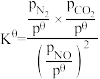 ,其中
,其中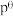 为标准压强
为标准压强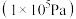 ,
, 、
、 和
和 为各组分的平衡分压,如:
为各组分的平衡分压,如: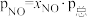 ,
, 为平衡总压,
为平衡总压, 为平衡系统中NO的物质的量分数。若NO的起始物质的量为1mol,假设反应在恒定温度和标准压强下进行,NO的平衡转化率为
为平衡系统中NO的物质的量分数。若NO的起始物质的量为1mol,假设反应在恒定温度和标准压强下进行,NO的平衡转化率为 ,则
,则
 的最简式表示)。
的最简式表示)。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐2】 、
、 是主要的空气污染源,需要经过处理才能排放。回答下列问题:
是主要的空气污染源,需要经过处理才能排放。回答下列问题:
(1)二氧化硫在 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。
热化学方程式为: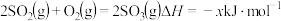 ,其催化机理如下:
,其催化机理如下:
第1步: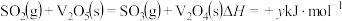
第2步: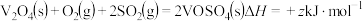
第3步:___________ 。(写热化学方程式,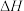 的值用x、y、z的代数式表示)。
的值用x、y、z的代数式表示)。
(2)燃煤发电厂常利用反应
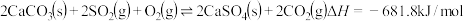 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少 的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
①0~20min内平均反应速率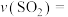
___________ 
②请写出平衡常数表达式K=___________ 。
(3) 的排放主要自于汽车尾气,有人利用反应
的排放主要自于汽车尾气,有人利用反应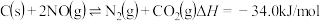 ,用活性炭对NO进行处理。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图甲所示:
,用活性炭对NO进行处理。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图甲所示:___________ ;在1100K时, 的体积分数为
的体积分数为___________ 。
(4)NO氧化反应: 分两步进行,其反应过程能量变化示意图如图乙。
分两步进行,其反应过程能量变化示意图如图乙。
查阅资料知:
 的反应历程分两步:
的反应历程分两步:
Ⅰ: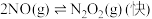 ,
,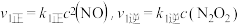
Ⅱ: ,
,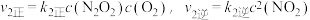
①决定NO氧化反应速率的步骤是___________ (填“Ⅰ”或“Ⅱ”)。
②升高温度绝大多数的化学反应速率增大,但是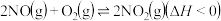 的速率却随温度的升高而减小,原因是
的速率却随温度的升高而减小,原因是___________ (填字母)
a、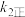 增大,
增大,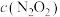 增大b、
增大b、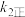 减小,
减小,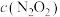 减小
减小
c、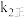 增大,
增大,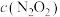 减小d、
减小d、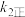 减小,
减小,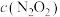 增大
增大
③由实验数据得到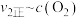 的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为
的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________ (填字母)。
 、
、 是主要的空气污染源,需要经过处理才能排放。回答下列问题:
是主要的空气污染源,需要经过处理才能排放。回答下列问题:(1)二氧化硫在
 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。热化学方程式为:
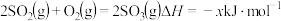 ,其催化机理如下:
,其催化机理如下:第1步:
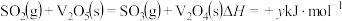
第2步:
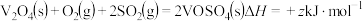
第3步:
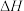 的值用x、y、z的代数式表示)。
的值用x、y、z的代数式表示)。(2)燃煤发电厂常利用反应
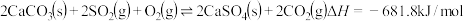 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少 的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:浓度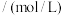 | 时间/min | |||||
| 0 | 10 | 20 | 30 | 40 | 50 | |
 | 1.00 | 0.79 | 0.60 | 0.56 | 0.56 | 0.56 |
 | 0 | 0.42 | 0.80 | 0.88 | 0.88 | 0.88 |
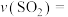

②请写出平衡常数表达式K=
(3)
 的排放主要自于汽车尾气,有人利用反应
的排放主要自于汽车尾气,有人利用反应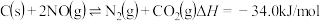 ,用活性炭对NO进行处理。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图甲所示:
,用活性炭对NO进行处理。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图甲所示: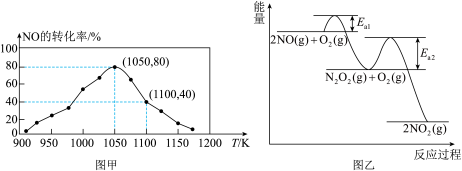
 的体积分数为
的体积分数为(4)NO氧化反应:
 分两步进行,其反应过程能量变化示意图如图乙。
分两步进行,其反应过程能量变化示意图如图乙。查阅资料知:
 的反应历程分两步:
的反应历程分两步:Ⅰ:
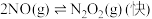 ,
,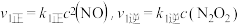
Ⅱ:
 ,
,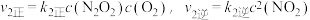
①决定NO氧化反应速率的步骤是
②升高温度绝大多数的化学反应速率增大,但是
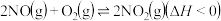 的速率却随温度的升高而减小,原因是
的速率却随温度的升高而减小,原因是a、
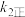 增大,
增大,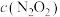 增大b、
增大b、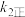 减小,
减小,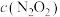 减小
减小c、
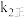 增大,
增大,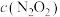 减小d、
减小d、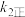 减小,
减小,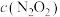 增大
增大③由实验数据得到
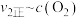 的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为
的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐3】(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气。其中生成NO的能量变化示意图如下:
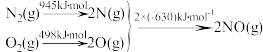
①反应的热化学方程式为__________________________________ 。
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K_________ 。

E.增大、减小、不变均有可能
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一 定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g) H2NCOONH4 (氨基甲酸铵) (l)
H2NCOONH4 (氨基甲酸铵) (l)
第二步:H2NCOONH4(l) H2O(g)+H2NCONH2(l)
H2O(g)+H2NCONH2(l)
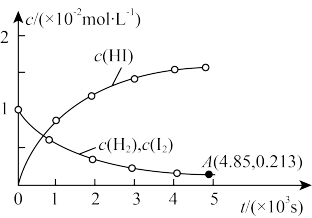
某实验小组模拟工业上合成尿素的条件,在一体积为500 L的密闭容器中投入4 mol氨和1 mol二氧化碳,验测得反应中各组分的物质的量随时间的变化如图所示:

①合成尿素总反应的快慢由第_____ 步反应决 定。
②反应进行到10 min时测得CO2的物质的量如 上图所示,则用CO2表示的第一步反应的速率v(CO2)=___ mol/(L·min)。
③由氨基甲酸铵和CO2曲线变化可得出关于浓度 变化和平衡状态的两条结论是:
a.______________________________________________________ ;
b.______________________________________________________ 。
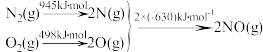
①反应的热化学方程式为
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K

| A.可能增大 |
| B.一定不变 |
| C.可能不变 |
| D.可能减小 |
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一 定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g)
 H2NCOONH4 (氨基甲酸铵) (l)
H2NCOONH4 (氨基甲酸铵) (l)第二步:H2NCOONH4(l)
 H2O(g)+H2NCONH2(l)
H2O(g)+H2NCONH2(l)某实验小组模拟工业上合成尿素的条件,在一体积为500 L的密闭容器中投入4 mol氨和1 mol二氧化碳,验测得反应中各组分的物质的量随时间的变化如图所示:

①合成尿素总反应的快慢由第
②反应进行到10 min时测得CO2的物质的量如 上图所示,则用CO2表示的第一步反应的速率v(CO2)=
③由氨基甲酸铵和CO2曲线变化可得出关于浓度 变化和平衡状态的两条结论是:
a.
b.
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐1】(1)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子只有H2O,根据题意回答下列问题。
①写出酸H2A的电离方程式:_____
②若溶液M由10 mL 2 mol∙L-1 NaHA 溶液与10 mL2 mol∙L-1 NaOH溶液混合而得,则溶液M的pH_______ (填“>”“<”或“=”)7,溶液M中各粒子的浓度关系正确的是____ (填序号)。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+2c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
D.c(A2-)+c(HA-)=1mol∙L-1
(2)实验室可用NaOH溶液吸收NO2,,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1 mol∙L-1的CH3COONa溶液,则两溶液中c( )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为____ (已知HNO2的电离常数Ka=7.1×10-4, CH3COOH的电离常数Ka=1.7×10-5)。可使溶液A和溶液B的 pH相等的方法是_____ (填序号)。
a.向溶液A中加适量水 b.向溶液A中加适量 NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2.吸收液(NaOH溶液)吸收SO2的过程中,pH随n( ):n(
):n( )的变化关系如下表:
)的变化关系如下表:
①由上表判断 NaHSO3溶液显_______ 性。
②当吸收液呈中性时,溶液中离子浓度的大小关系为_______
①写出酸H2A的电离方程式:
②若溶液M由10 mL 2 mol∙L-1 NaHA 溶液与10 mL2 mol∙L-1 NaOH溶液混合而得,则溶液M的pH
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+2c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
D.c(A2-)+c(HA-)=1mol∙L-1
(2)实验室可用NaOH溶液吸收NO2,,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1 mol∙L-1的CH3COONa溶液,则两溶液中c(
 )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为a.向溶液A中加适量水 b.向溶液A中加适量 NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2.吸收液(NaOH溶液)吸收SO2的过程中,pH随n(
 ):n(
):n( )的变化关系如下表:
)的变化关系如下表:n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度的大小关系为
您最近一年使用:0次
【推荐2】回答下列问题
(1)硫化氢( )、二氧化硫(
)、二氧化硫( )是有害气体,可用多种方法进行脱除。(已知25℃时,
)是有害气体,可用多种方法进行脱除。(已知25℃时, 的
的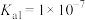 ,
,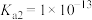 ,
, )
)
① 和
和 的VSEPR模型分别为
的VSEPR模型分别为______ 、______ 。
②室温下,若用足量的烧碱溶液吸收硫化氢气体,写出该反应的离子方程式______ ,计算25℃时,该反应的平衡常数为______ 。
③室温下,若在 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量 气体,此时溶液中的PH是
气体,此时溶液中的PH是______ 。
(2)通过电化学循环法可将 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: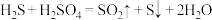 、
、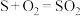

①电极a上发生反应的电极反应式为______ 。
②理论上1mol 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为______ 。
(3)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。已知该晶体的密度为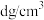 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,下列说法中正确的是______。
,下列说法中正确的是______。

(1)硫化氢(
 )、二氧化硫(
)、二氧化硫( )是有害气体,可用多种方法进行脱除。(已知25℃时,
)是有害气体,可用多种方法进行脱除。(已知25℃时, 的
的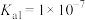 ,
,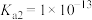 ,
, )
)①
 和
和 的VSEPR模型分别为
的VSEPR模型分别为②室温下,若用足量的烧碱溶液吸收硫化氢气体,写出该反应的离子方程式
③室温下,若在
 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量 气体,此时溶液中的PH是
气体,此时溶液中的PH是(2)通过电化学循环法可将
 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: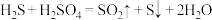 、
、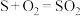

①电极a上发生反应的电极反应式为
②理论上1mol
 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为(3)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。已知该晶体的密度为
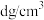 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,下列说法中正确的是______。
,下列说法中正确的是______。
A.该铁的氧化物化学式为 | B.距离 最近的 最近的 有6个 有6个 |
C.晶体中的 只能构成正四面体空隙 只能构成正四面体空隙 | D.晶胞的边长为 |
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
【推荐3】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g) CO(g)+3H2(g); △H= + 216.4kJ/mol
CO(g)+3H2(g); △H= + 216.4kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g); △H= -41.2kJ/mol
CO2(g)+H2(g); △H= -41.2kJ/mol
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g); △H=
CO2(g)+4H2(g); △H=_________ 。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。
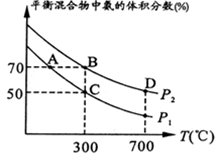
则P1_____ P2 (填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B点____ D点;C点H2的转化率为__________ ;
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO 反应生成N2H4的化学方程式:______________________________ ;
②已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O N2H5++OH- K1=1×10-a;
N2H5++OH- K1=1×10-a;
N2H5++H2O N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液中c(OH-)的范围为:_________________________ (用含a、b式子表示)。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)
 CO(g)+3H2(g); △H= + 216.4kJ/mol
CO(g)+3H2(g); △H= + 216.4kJ/molb.CO(g)+H2O(g)
 CO2(g)+H2(g); △H= -41.2kJ/mol
CO2(g)+H2(g); △H= -41.2kJ/mol则反应CH4(g)+2H2O(g)
 CO2(g)+4H2(g); △H=
CO2(g)+4H2(g); △H=(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。

则P1
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO 反应生成N2H4的化学方程式:
②已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O
 N2H5++OH- K1=1×10-a;
N2H5++OH- K1=1×10-a; N2H5++H2O
 N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液中c(OH-)的范围为:
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
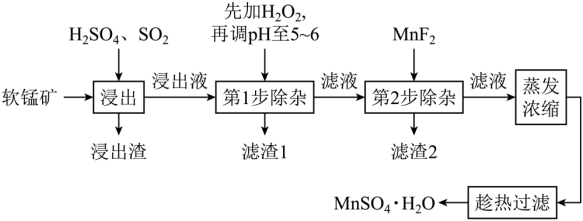
【推荐1】软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为___________ 。
(2)第1步除杂中加入H2O2的目的是___________ 。
(3)第1步除杂中形成滤渣1的主要成分为___________ (填化学式),调pH至5~6所加的试剂,可选择___________ (填以下试剂的序号字母)。
a.CaO b.MnCO3 c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式:___________ 。(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11)
(5)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是___________ (用离子方程式表示)。
(6)工艺流程中矿渣的预处理通常有酸浸、碱浸、焙烧等方式。黄铁矿渣焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是___________ (任答两点)。
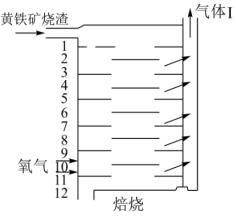

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为
(2)第1步除杂中加入H2O2的目的是
(3)第1步除杂中形成滤渣1的主要成分为
a.CaO b.MnCO3 c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式:
(5)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是
(6)工艺流程中矿渣的预处理通常有酸浸、碱浸、焙烧等方式。黄铁矿渣焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是

您最近一年使用:0次



