 、
、 是主要的空气污染源,需要经过处理才能排放。回答下列问题:
是主要的空气污染源,需要经过处理才能排放。回答下列问题:(1)二氧化硫在
 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。热化学方程式为:
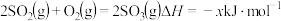 ,其催化机理如下:
,其催化机理如下:第1步:
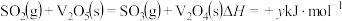
第2步:
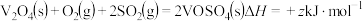
第3步:
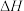 的值用x、y、z的代数式表示)。
的值用x、y、z的代数式表示)。(2)燃煤发电厂常利用反应
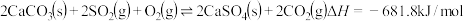 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少 的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:浓度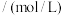 | 时间/min | |||||
| 0 | 10 | 20 | 30 | 40 | 50 | |
 | 1.00 | 0.79 | 0.60 | 0.56 | 0.56 | 0.56 |
 | 0 | 0.42 | 0.80 | 0.88 | 0.88 | 0.88 |
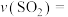
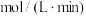
②请写出平衡常数表达式K=
(3)
 的排放主要自于汽车尾气,有人利用反应
的排放主要自于汽车尾气,有人利用反应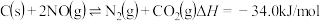 ,用活性炭对NO进行处理。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图甲所示:
,用活性炭对NO进行处理。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图甲所示: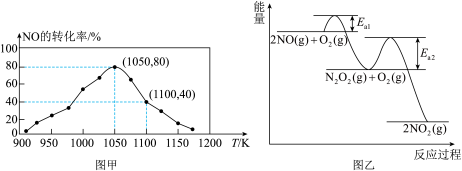
 的体积分数为
的体积分数为(4)NO氧化反应:
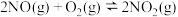 分两步进行,其反应过程能量变化示意图如图乙。
分两步进行,其反应过程能量变化示意图如图乙。查阅资料知:
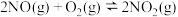 的反应历程分两步:
的反应历程分两步:Ⅰ:
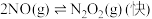 ,
,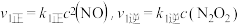
Ⅱ:
 ,
,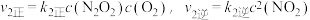
①决定NO氧化反应速率的步骤是
②升高温度绝大多数的化学反应速率增大,但是
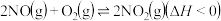 的速率却随温度的升高而减小,原因是
的速率却随温度的升高而减小,原因是a、
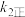 增大,
增大,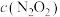 增大b、
增大b、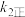 减小,
减小,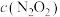 减小
减小c、
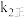 增大,
增大,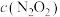 减小d、
减小d、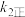 减小,
减小,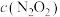 增大
增大③由实验数据得到
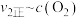 的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为
的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为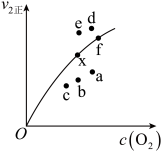
更新时间:2022-11-16 21:13:53
|
相似题推荐
【推荐1】我国科学家首次实现利用甲烷在温和条件下高选择性氧化制甲醇。
反应Ⅰ: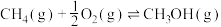

反应Ⅱ: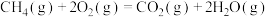
(1)已知:①
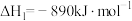
②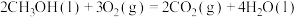
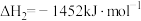
③
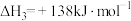
上述反应Ⅰ中的
___________  。
。
(2)在密闭容器中投入2mol 和1mol
和1mol ,起始投料量不变,在不同温度、压强下做平行实验,测得
,起始投料量不变,在不同温度、压强下做平行实验,测得 的平衡体积分数与温度、压强的关系如图所示:
的平衡体积分数与温度、压强的关系如图所示:

①由图可知,当 时,以反应
时,以反应___________ (填“Ⅰ”或“Ⅱ”)为主,理由是___________ ;
② 时,三条曲线几乎相连的原因可能是
时,三条曲线几乎相连的原因可能是___________ ;
③a、b、c由大到小排序为___________ 。
(3)在恒温的刚性(恒容)密闭容器中,分别按照(a) 、
、 的体积比为2:1以及(b)
的体积比为2:1以及(b) 、
、 、
、 (
( 的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性=
的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性= ]如表所示:
]如表所示:
①投料b能显著提高甲醇选择性的原因是___________ 。
②向上述刚性密闭容器中按照体积比2:1:8充入 、
、 和
和 ,在450K下达到平衡状态时,
,在450K下达到平衡状态时, 的转化率为50%,
的转化率为50%, 的选择性为90%,则副反应的压强平衡常数
的选择性为90%,则副反应的压强平衡常数
___________ (计算结果保留1位小数)。
(4)我国科学家研发新型催化剂,利用电催化法实现甲烷转化成甲醇,装置如图所示:

交换膜M的名称是___________ ;阳极的电极反应式为___________ 。
反应Ⅰ:
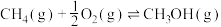

反应Ⅱ:
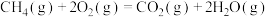
(1)已知:①

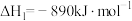
②
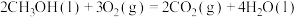
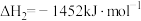
③

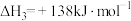
上述反应Ⅰ中的

 。
。(2)在密闭容器中投入2mol
 和1mol
和1mol ,起始投料量不变,在不同温度、压强下做平行实验,测得
,起始投料量不变,在不同温度、压强下做平行实验,测得 的平衡体积分数与温度、压强的关系如图所示:
的平衡体积分数与温度、压强的关系如图所示:
①由图可知,当
 时,以反应
时,以反应②
 时,三条曲线几乎相连的原因可能是
时,三条曲线几乎相连的原因可能是③a、b、c由大到小排序为
(3)在恒温的刚性(恒容)密闭容器中,分别按照(a)
 、
、 的体积比为2:1以及(b)
的体积比为2:1以及(b) 、
、 、
、 (
( 的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性=
的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性= ]如表所示:
]如表所示:| 投料方式 | a | b |
 的选择性/% 的选择性/% | 90 | 15 |
 的选择性/% 的选择性/% | 10 | 85 |
①投料b能显著提高甲醇选择性的原因是
②向上述刚性密闭容器中按照体积比2:1:8充入
 、
、 和
和 ,在450K下达到平衡状态时,
,在450K下达到平衡状态时, 的转化率为50%,
的转化率为50%, 的选择性为90%,则副反应的压强平衡常数
的选择性为90%,则副反应的压强平衡常数
(4)我国科学家研发新型催化剂,利用电催化法实现甲烷转化成甲醇,装置如图所示:

交换膜M的名称是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐2】研究氮氧化物等大气污染物对打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g),其反应历程分两步:
2NO2(g),其反应历程分两步:
①2NO(g) N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g) 2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
反应历程的能量变化如图:
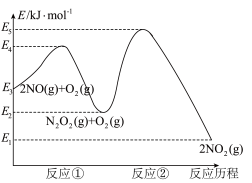
请回答下列问题:
(1)反应2NO(g)+O2(g) 2NO2(g)的ΔH
2NO2(g)的ΔH__ 0(填“>”、“<”或“=”)。
(2)决定2NO(g)+O2(g) 2NO2(g)反应速率是反应②,E4+E2
2NO2(g)反应速率是反应②,E4+E2__ E5+E3(填“>”、“<”或“=”)。
(3)一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___ 。
(4)T1℃下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如图所示。前5秒内O2的平均生成速率为___ ;T1℃下反应2NO(g)+O2(g) 2NO2(g)的化学平衡常数K=
2NO2(g)的化学平衡常数K=__ 。
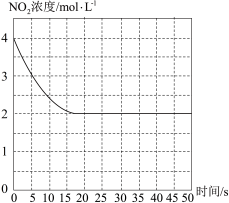
(5)对于(4)中的反应体系达平衡后,若降低温度,再次达平衡后,混合气体的平均相对分子质量___ (填“增大”、“减小”或“不变”);对于(4)中的反应体系达平衡后,若在恒温恒容条件下,追加NO2,再次达平衡后,NO2的体积分数___ (填“增大”、“减小”或“不变”)。
(6)对于(4)中的反应体系达平衡后(压强为P1),若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,P1︰P2 = 5︰8,则再次平衡时NO2的浓度为___ mol·L-1。(精确到小数点后两位)
 2NO2(g),其反应历程分两步:
2NO2(g),其反应历程分两步:①2NO(g)
 N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0②N2O2(g)+O2(g)
 2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0反应历程的能量变化如图:

请回答下列问题:
(1)反应2NO(g)+O2(g)
 2NO2(g)的ΔH
2NO2(g)的ΔH(2)决定2NO(g)+O2(g)
 2NO2(g)反应速率是反应②,E4+E2
2NO2(g)反应速率是反应②,E4+E2(3)一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=(4)T1℃下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如图所示。前5秒内O2的平均生成速率为
 2NO2(g)的化学平衡常数K=
2NO2(g)的化学平衡常数K=
(5)对于(4)中的反应体系达平衡后,若降低温度,再次达平衡后,混合气体的平均相对分子质量
(6)对于(4)中的反应体系达平衡后(压强为P1),若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,P1︰P2 = 5︰8,则再次平衡时NO2的浓度为
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
【推荐3】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1=-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为__________ 。
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1=-90kJ·mol-1K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2K2
已知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3=-41.1kJ·mol-1K3
H2O(l)=H2O(g) △H4=+44.0kJ·mol-1K4
则△H2=______ K2=_______ (用含K1、K3、K 4的代数式表示)
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________ 。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
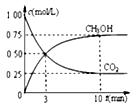
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________ (用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______ (填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为_____ 。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______ 。硝酸浓度不能过大,其原因是___________________________________________ 。
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1=-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1=-90kJ·mol-1K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2K2
已知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3=-41.1kJ·mol-1K3
H2O(l)=H2O(g) △H4=+44.0kJ·mol-1K4
则△H2=
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g)
 CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)①下列能说明该反应已达到平衡状态的是
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为

(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐1】有效利用二氧化碳对实现“碳中和”意义重大。
(1)现代工业技术可从空气或工业尾气中捕获 ,可作为
,可作为 捕获剂的有
捕获剂的有___________ 。
a. 溶液 b.氨水 c.
溶液 b.氨水 c. 溶液
溶液
(2)科研人员利用 催化剂,将
催化剂,将 与
与 合成
合成 ,主要反应的热化学方程式如下。
,主要反应的热化学方程式如下。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ: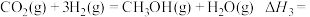
___________ 。
(3)某温度下,向容积为1 L的密闭容器中通入2mol CO2和10mol H2,发生反应Ⅰ、反应Ⅲ.10 min后体系达到平衡,此时CO2的转化率为20%,CH3OH的选择性为60%。
已知:CH3OH的选择性X=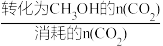 ×100%
×100%
①用CO2表示0~10min内平均反应速率υ(CO2)=___________
②反应Ⅲ的平衡常数K=___________ L2/mol2(写出计算式即可)。
(4)使用惰性电极电解 制取甲醇的反应装置如图所示:电极a接电源
制取甲醇的反应装置如图所示:电极a接电源___________ 极(填“正”或“负”);生成甲醇的电极反应式为___________ 。

(5) 可催化加氢生成
可催化加氢生成 ,其过程为:向
,其过程为:向 溶液中通入
溶液中通入 转化为
转化为 ,一定条件下再通入
,一定条件下再通入 可反应生成
可反应生成 ,进一步生产
,进一步生产 。
。 产率
产率 曲线见图。当温度高于
曲线见图。当温度高于 时,
时, 的产率下降,可能的原因是
的产率下降,可能的原因是___________ 。

(1)现代工业技术可从空气或工业尾气中捕获
 ,可作为
,可作为 捕获剂的有
捕获剂的有a.
 溶液 b.氨水 c.
溶液 b.氨水 c. 溶液
溶液(2)科研人员利用
 催化剂,将
催化剂,将 与
与 合成
合成 ,主要反应的热化学方程式如下。
,主要反应的热化学方程式如下。反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
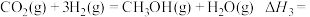
(3)某温度下,向容积为1 L的密闭容器中通入2mol CO2和10mol H2,发生反应Ⅰ、反应Ⅲ.10 min后体系达到平衡,此时CO2的转化率为20%,CH3OH的选择性为60%。
已知:CH3OH的选择性X=
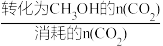 ×100%
×100%①用CO2表示0~10min内平均反应速率υ(CO2)=
②反应Ⅲ的平衡常数K=
(4)使用惰性电极电解
 制取甲醇的反应装置如图所示:电极a接电源
制取甲醇的反应装置如图所示:电极a接电源
(5)
 可催化加氢生成
可催化加氢生成 ,其过程为:向
,其过程为:向 溶液中通入
溶液中通入 转化为
转化为 ,一定条件下再通入
,一定条件下再通入 可反应生成
可反应生成 ,进一步生产
,进一步生产 。
。 产率
产率 曲线见图。当温度高于
曲线见图。当温度高于 时,
时, 的产率下降,可能的原因是
的产率下降,可能的原因是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐2】(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气。其中生成NO的能量变化示意图如下:
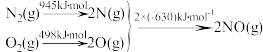
①反应的热化学方程式为__________________________________ 。
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K_________ 。

E.增大、减小、不变均有可能
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一 定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g) H2NCOONH4 (氨基甲酸铵) (l)
H2NCOONH4 (氨基甲酸铵) (l)
第二步:H2NCOONH4(l) H2O(g)+H2NCONH2(l)
H2O(g)+H2NCONH2(l)
某实验小组模拟工业上合成尿素的条件,在一体积为500 L的密闭容器中投入4 mol氨和1 mol二氧化碳,验测得反应中各组分的物质的量随时间的变化如图所示:

①合成尿素总反应的快慢由第_____ 步反应决 定。
②反应进行到10 min时测得CO2的物质的量如 上图所示,则用CO2表示的第一步反应的速率v(CO2)=___ mol/(L·min)。
③由氨基甲酸铵和CO2曲线变化可得出关于浓度 变化和平衡状态的两条结论是:
a.______________________________________________________ ;
b.______________________________________________________ 。
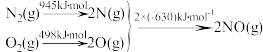
①反应的热化学方程式为
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K

| A.可能增大 |
| B.一定不变 |
| C.可能不变 |
| D.可能减小 |
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一 定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g)
 H2NCOONH4 (氨基甲酸铵) (l)
H2NCOONH4 (氨基甲酸铵) (l)第二步:H2NCOONH4(l)
 H2O(g)+H2NCONH2(l)
H2O(g)+H2NCONH2(l)某实验小组模拟工业上合成尿素的条件,在一体积为500 L的密闭容器中投入4 mol氨和1 mol二氧化碳,验测得反应中各组分的物质的量随时间的变化如图所示:

①合成尿素总反应的快慢由第
②反应进行到10 min时测得CO2的物质的量如 上图所示,则用CO2表示的第一步反应的速率v(CO2)=
③由氨基甲酸铵和CO2曲线变化可得出关于浓度 变化和平衡状态的两条结论是:
a.
b.
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐3】酯化反应可用通式表示为 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。
将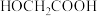 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:
二聚: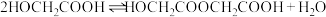
n聚: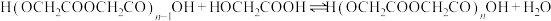
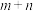 聚:
聚: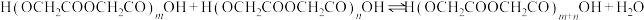 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。
Ⅰ.反应平衡体系分析
(1)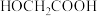 按系统命名法命名为
按系统命名法命名为______ 。
(2)定义反应程度 ,其中
,其中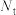 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,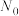 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则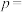
______ 。
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度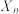 与平衡常数K的关系
与平衡常数K的关系
______ 。
(4)为了使平均聚合度增大,下列方法可行的是______ (填标号)。
A.及时移去 B.升高温度(
B.升高温度( )
)
C.提高 浓度 D.提高
浓度 D.提高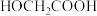 浓度
浓度
E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量 催化与不加入
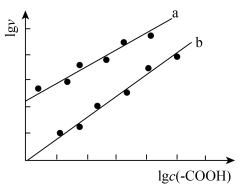
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为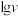 与
与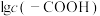 的关系]。
的关系]。
a、b两条曲线的理论斜率之比更接近______ 。 B.
B. C.
C.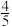 D.
D.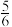
当温度升高时,b线斜率将______ (填“变大”、“变小”或“不变”)。
(6)加入少量 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度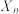 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中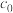 为反应初始时
为反应初始时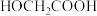 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
______ (用k、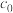 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。将
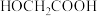 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:二聚:
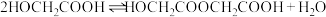
n聚:
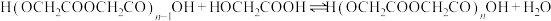
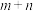 聚:
聚: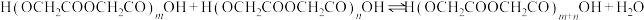 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。Ⅰ.反应平衡体系分析
(1)
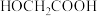 按系统命名法命名为
按系统命名法命名为(2)定义反应程度
 ,其中
,其中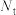 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,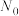 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则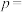
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度
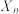 与平衡常数K的关系
与平衡常数K的关系
(4)为了使平均聚合度增大,下列方法可行的是
A.及时移去
 B.升高温度(
B.升高温度( )
)C.提高
 浓度 D.提高
浓度 D.提高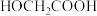 浓度
浓度E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量
 催化与不加入
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为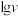 与
与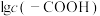 的关系]。
的关系]。a、b两条曲线的理论斜率之比更接近
 B.
B. C.
C.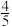 D.
D.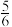
当温度升高时,b线斜率将
(6)加入少量
 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度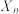 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中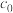 为反应初始时
为反应初始时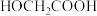 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
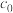 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐1】乙烯的产量是衡量一个国家的石油化工发展水平,研究工业制取乙烯有重要的意义。
(1)工业上用 氧化
氧化 制
制 是化工工业的一个新课题,相关主要化学反应有:
是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.

Ⅱ.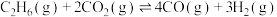
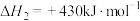
向一密闭容器中通入2
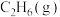 和3
和3
 ,乙烷的平衡转化率、乙烯的选择性(乙烯的选择性
,乙烷的平衡转化率、乙烯的选择性(乙烯的选择性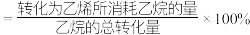 )与温度和压强的关系如下图所示。
)与温度和压强的关系如下图所示。
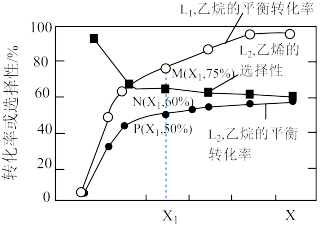
① 、
、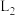 代表不同
代表不同___________ (填“温度”或“压强”);
②M、P两点正反应速率较大的是___________ (填“M”或“P”)点,理由是___________ 。
③在 和
和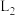 条件下,达到平衡时容器的体积为1L,平衡时
条件下,达到平衡时容器的体积为1L,平衡时 的物质的量分数为
的物质的量分数为___________ 。反应Ⅰ的平衡常数是___________  。
。
(2)工业生产中常用高选择性的YS-8810银催化剂催化乙烯氧化生产环氧乙烷,其反应机理如下:
ⅰ. 慢
慢
ⅱ.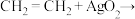
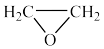
 快
快
ⅲ. 快
快
①增大 的浓度
的浓度___________ (填“不能”或“能”)显著提高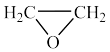 的生成速率。
的生成速率。
②一定条件下,对于反应:
 。起始状态Ⅰ中有
。起始状态Ⅰ中有 、
、 和
和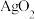 ,经下列过程达到各平衡状态:
,经下列过程达到各平衡状态:

已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是___________ (填字母)。
A.从Ⅰ到Ⅱ的过程
B.压强: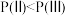
C.平衡常数: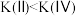
D.若体积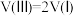 ,则
,则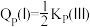
E.逆反应的速率: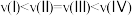
(1)工业上用
 氧化
氧化 制
制 是化工工业的一个新课题,相关主要化学反应有:
是化工工业的一个新课题,相关主要化学反应有:Ⅰ.


Ⅱ.
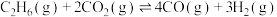
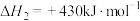
向一密闭容器中通入2

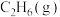 和3
和3
 ,乙烷的平衡转化率、乙烯的选择性(乙烯的选择性
,乙烷的平衡转化率、乙烯的选择性(乙烯的选择性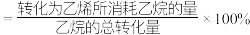 )与温度和压强的关系如下图所示。
)与温度和压强的关系如下图所示。
①
 、
、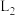 代表不同
代表不同②M、P两点正反应速率较大的是
③在
 和
和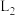 条件下,达到平衡时容器的体积为1L,平衡时
条件下,达到平衡时容器的体积为1L,平衡时 的物质的量分数为
的物质的量分数为 。
。(2)工业生产中常用高选择性的YS-8810银催化剂催化乙烯氧化生产环氧乙烷,其反应机理如下:
ⅰ.
 慢
慢ⅱ.
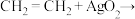

 快
快ⅲ.
 快
快①增大
 的浓度
的浓度 的生成速率。
的生成速率。②一定条件下,对于反应:

 。起始状态Ⅰ中有
。起始状态Ⅰ中有 、
、 和
和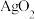 ,经下列过程达到各平衡状态:
,经下列过程达到各平衡状态:
已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是
A.从Ⅰ到Ⅱ的过程

B.压强:
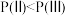
C.平衡常数:
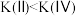
D.若体积
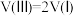 ,则
,则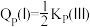
E.逆反应的速率:
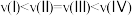
您最近一年使用:0次
【推荐2】低碳烯烃是基础有机化工原料,工业上可利用合成气直接或间接制取。主要反应方程式如下。
间接制取低碳烯烃:CO(g)+2H2(g) CH3OH(l) △H1=-116kJ•mol-1
CH3OH(l) △H1=-116kJ•mol-1
2CH3OH(l) C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
直接制取低碳烯烃:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H3
C2H4(g)+2H2O(g) △H3
回答下列问题:
(1)已知H2O(g) H2O(l) △H=-44kJ•mol-1,则△H3=
H2O(l) △H=-44kJ•mol-1,则△H3=______ kJ/mol。
(2)将N2、CO和H2以体积比为1:1:2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图1所示,则P1______ P2(填“>”“<”或“=”),M点的正反应速率______ N点的逆反应速率(填“>”“<”或“=”)。在500K,压强为P1的条件下,该反应的Kp=______ (列出计算式)。
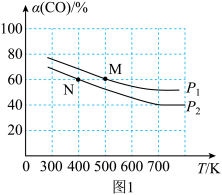
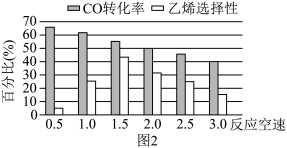
(3)已知反应空速是指一定条件下,单位时间单位体积(或质量)催化剂处理的气体量。在常压、450℃,n(CO):n(H2)为1:2的条件下,利用合成气直接制取乙烯。反应空速对CO转化率和乙烯选择性[选择性=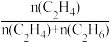 ×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是______ 。
(4)利用合成气制取低碳烯烃时,需使合成气吸附在催化剂表面的活性位点上。研究发现催化剂晶体的颗粒越小,催化效果越好,其理由是______ 。
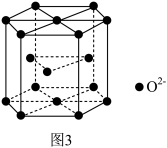
(5)Ga2O3是工业上利用合成气制低碳烯烃的催化剂,其晶体结构单元如图3所示(O2-之间紧密堆积,Ga3+位于O2-形成的空隙中且未画出),其中O2-半径为anm,晶体结构单元的高为bnm。已知阿伏加德罗常数的值为NA,则Ga2O3晶体的摩尔体积Vm=______ m3/mol。
间接制取低碳烯烃:CO(g)+2H2(g)
 CH3OH(l) △H1=-116kJ•mol-1
CH3OH(l) △H1=-116kJ•mol-12CH3OH(l)
 C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
C2H4(g)+2H2O(l) △H2=-35kJ•mol-1直接制取低碳烯烃:2CO(g)+4H2(g)
 C2H4(g)+2H2O(g) △H3
C2H4(g)+2H2O(g) △H3回答下列问题:
(1)已知H2O(g)
 H2O(l) △H=-44kJ•mol-1,则△H3=
H2O(l) △H=-44kJ•mol-1,则△H3=(2)将N2、CO和H2以体积比为1:1:2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图1所示,则P1

(3)已知反应空速是指一定条件下,单位时间单位体积(或质量)催化剂处理的气体量。在常压、450℃,n(CO):n(H2)为1:2的条件下,利用合成气直接制取乙烯。反应空速对CO转化率和乙烯选择性[选择性=
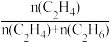 ×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
(4)利用合成气制取低碳烯烃时,需使合成气吸附在催化剂表面的活性位点上。研究发现催化剂晶体的颗粒越小,催化效果越好,其理由是
(5)Ga2O3是工业上利用合成气制低碳烯烃的催化剂,其晶体结构单元如图3所示(O2-之间紧密堆积,Ga3+位于O2-形成的空隙中且未画出),其中O2-半径为anm,晶体结构单元的高为bnm。已知阿伏加德罗常数的值为NA,则Ga2O3晶体的摩尔体积Vm=

您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐3】研究和深度开发氮氧化物、碳氧化物、硫及其化合物的应用对构建生态文明社会具有重要的意义。
Ⅰ.NO会加速臭氧层被破坏,其反应过程如图所示:

(1)NO的作用是____ 。
(2)已知:O3(g)+O(g) 2O2 ΔH=-143kJ·mol-l
2O2 ΔH=-143kJ·mol-l
反应1:O3+NO NO2+O2 ΔH1=-200.2kJ·mol-l
NO2+O2 ΔH1=-200.2kJ·mol-l
反应2:热化学方程式为____ 。
Ⅱ.已知反应:H2S(g)+CO(g) COS(g)+H2(g) ΔH<0。
COS(g)+H2(g) ΔH<0。
(3)COS(羰基硫)中心原子的杂化方式为____ ,写出COS(羰基硫)的电子式___ 。H2O中的H—O—H键角____ (填“>”、“=”或“<”)H2S中的H—S—H键角。
(4)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。
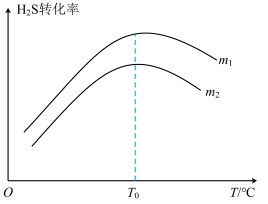
①m1____ m2.(填“>”、“<”或“=”)
②温度高于T0时,H2S转化率减小的可能原因为___ 。
A.反应停止了 B.催化剂活性降低 C.反应达到平衡 D.反应的ΔH变大
③240℃时,将等物质的量的H2S(g)与CO(g)充入密闭容器中,测得H2(g)的平衡体积分数为25%。则此时该反应的平衡常数K=___ 。
④在300℃、320℃时上述反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图所示。起始密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等。则300℃时ω[COS(g)]随时间变化的曲线为_____ ,320℃时ω[H2S(g)]随时间变化的曲线为____ 。

Ⅰ.NO会加速臭氧层被破坏,其反应过程如图所示:

(1)NO的作用是
(2)已知:O3(g)+O(g)
 2O2 ΔH=-143kJ·mol-l
2O2 ΔH=-143kJ·mol-l反应1:O3+NO
 NO2+O2 ΔH1=-200.2kJ·mol-l
NO2+O2 ΔH1=-200.2kJ·mol-l反应2:热化学方程式为
Ⅱ.已知反应:H2S(g)+CO(g)
 COS(g)+H2(g) ΔH<0。
COS(g)+H2(g) ΔH<0。(3)COS(羰基硫)中心原子的杂化方式为
(4)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。

①m1
②温度高于T0时,H2S转化率减小的可能原因为
A.反应停止了 B.催化剂活性降低 C.反应达到平衡 D.反应的ΔH变大
③240℃时,将等物质的量的H2S(g)与CO(g)充入密闭容器中,测得H2(g)的平衡体积分数为25%。则此时该反应的平衡常数K=
④在300℃、320℃时上述反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图所示。起始密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等。则300℃时ω[COS(g)]随时间变化的曲线为

您最近一年使用:0次




