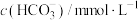低碳烯烃是基础有机化工原料,工业上可利用合成气直接或间接制取。主要反应方程式如下。
间接制取低碳烯烃:CO(g)+2H2(g) CH3OH(l) △H1=-116kJ•mol-1
CH3OH(l) △H1=-116kJ•mol-1
2CH3OH(l) C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
直接制取低碳烯烃:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H3
C2H4(g)+2H2O(g) △H3
回答下列问题:
(1)已知H2O(g) H2O(l) △H=-44kJ•mol-1,则△H3=
H2O(l) △H=-44kJ•mol-1,则△H3=______ kJ/mol。
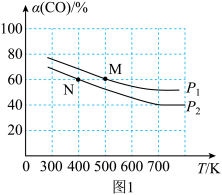
(2)将N2、CO和H2以体积比为1:1:2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图1所示,则P1______ P2(填“>”“<”或“=”),M点的正反应速率______ N点的逆反应速率(填“>”“<”或“=”)。在500K,压强为P1的条件下,该反应的Kp=______ (列出计算式)。
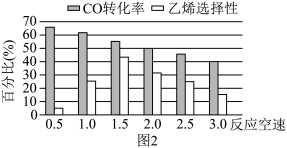
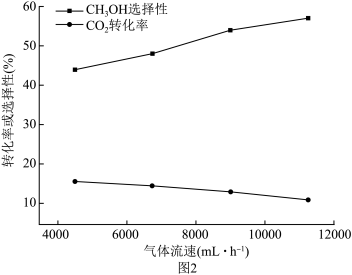
(3)已知反应空速是指一定条件下,单位时间单位体积(或质量)催化剂处理的气体量。在常压、450℃,n(CO):n(H2)为1:2的条件下,利用合成气直接制取乙烯。反应空速对CO转化率和乙烯选择性[选择性=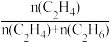 ×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是______ 。
(4)利用合成气制取低碳烯烃时,需使合成气吸附在催化剂表面的活性位点上。研究发现催化剂晶体的颗粒越小,催化效果越好,其理由是______ 。
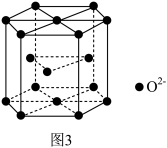
(5)Ga2O3是工业上利用合成气制低碳烯烃的催化剂,其晶体结构单元如图3所示(O2-之间紧密堆积,Ga3+位于O2-形成的空隙中且未画出),其中O2-半径为anm,晶体结构单元的高为bnm。已知阿伏加德罗常数的值为NA,则Ga2O3晶体的摩尔体积Vm=______ m3/mol。
间接制取低碳烯烃:CO(g)+2H2(g)
 CH3OH(l) △H1=-116kJ•mol-1
CH3OH(l) △H1=-116kJ•mol-12CH3OH(l)
 C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
C2H4(g)+2H2O(l) △H2=-35kJ•mol-1直接制取低碳烯烃:2CO(g)+4H2(g)
 C2H4(g)+2H2O(g) △H3
C2H4(g)+2H2O(g) △H3回答下列问题:
(1)已知H2O(g)
 H2O(l) △H=-44kJ•mol-1,则△H3=
H2O(l) △H=-44kJ•mol-1,则△H3=(2)将N2、CO和H2以体积比为1:1:2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图1所示,则P1

(3)已知反应空速是指一定条件下,单位时间单位体积(或质量)催化剂处理的气体量。在常压、450℃,n(CO):n(H2)为1:2的条件下,利用合成气直接制取乙烯。反应空速对CO转化率和乙烯选择性[选择性=
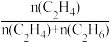 ×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
(4)利用合成气制取低碳烯烃时,需使合成气吸附在催化剂表面的活性位点上。研究发现催化剂晶体的颗粒越小,催化效果越好,其理由是
(5)Ga2O3是工业上利用合成气制低碳烯烃的催化剂,其晶体结构单元如图3所示(O2-之间紧密堆积,Ga3+位于O2-形成的空隙中且未画出),其中O2-半径为anm,晶体结构单元的高为bnm。已知阿伏加德罗常数的值为NA,则Ga2O3晶体的摩尔体积Vm=

更新时间:2023-05-29 12:30:33
|
相似题推荐
【推荐1】将 和
和 两种气体转化为合成气(
两种气体转化为合成气( 和CO),可以实现能量综合利用,对环境保护具有十分重要的意义。甲烷及二氧化碳重整涉及以下反应:
和CO),可以实现能量综合利用,对环境保护具有十分重要的意义。甲烷及二氧化碳重整涉及以下反应:
Ⅰ.

Ⅱ.
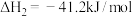
(1)反应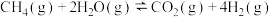

___________ 。(用 、
、 表示)
表示)
(2)密闭恒容条件下,反应Ⅱ达到平衡的标志是___________ 。
A.每消耗 的同时消耗
的同时消耗
B.CO的分压不再发生变化
C.气体平均分子量不再发生变化
D.气体密度不再发生变化
E.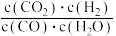 比值不再发生变化
比值不再发生变化
(3)一定温度下,维持压强 ,向一密闭容器中通入等物质的量的
,向一密闭容器中通入等物质的量的 和
和 发生反应。已知反应Ⅱ的速率方程可表示为
发生反应。已知反应Ⅱ的速率方程可表示为 ,
,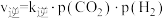 ,其中
,其中 、
、 分别为正、逆反应的速率常数,则以物质的分压表示的反应Ⅱ的平衡常数
分别为正、逆反应的速率常数,则以物质的分压表示的反应Ⅱ的平衡常数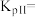
___________ (用 、
、 表示);另
表示);另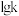 与
与 的关系如图所示,①、②、③、④四条直线中,表示反应Ⅱ
的关系如图所示,①、②、③、④四条直线中,表示反应Ⅱ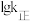 的是
的是___________ (填序号);达到平衡时,测得 的转化率为60%,且体系中
的转化率为60%,且体系中 ,以物质的分压表示的反应Ⅰ的平衡常数
,以物质的分压表示的反应Ⅰ的平衡常数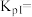
___________ 。(用含 的代数式表示)
的代数式表示)
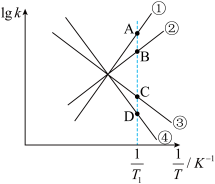
(4)日本政府于2023年8月24日下午一点启动福岛核污染废水排海,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料。核废料中+6价的铀[U(Ⅵ)]可以通过电化学还原法处理,U(Ⅵ)还原为U(Ⅳ)的电化学装置如图所示:

阴极发生的反应为: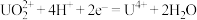
阴极区溶液中发生反应: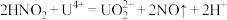 、
、
①阴极上发生的副反应为:___________ 。
②阴极区溶液中加入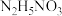 的目的是
的目的是___________ 。
③电还原处理+6价的铀[U(Ⅵ)]转移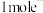 ,阴极区
,阴极区 减少
减少___________ mol。
 和
和 两种气体转化为合成气(
两种气体转化为合成气( 和CO),可以实现能量综合利用,对环境保护具有十分重要的意义。甲烷及二氧化碳重整涉及以下反应:
和CO),可以实现能量综合利用,对环境保护具有十分重要的意义。甲烷及二氧化碳重整涉及以下反应:Ⅰ.


Ⅱ.

(1)反应
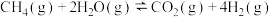

 、
、 表示)
表示)(2)密闭恒容条件下,反应Ⅱ达到平衡的标志是
A.每消耗
 的同时消耗
的同时消耗
B.CO的分压不再发生变化
C.气体平均分子量不再发生变化
D.气体密度不再发生变化
E.
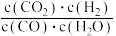 比值不再发生变化
比值不再发生变化(3)一定温度下,维持压强
 ,向一密闭容器中通入等物质的量的
,向一密闭容器中通入等物质的量的 和
和 发生反应。已知反应Ⅱ的速率方程可表示为
发生反应。已知反应Ⅱ的速率方程可表示为 ,
,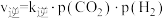 ,其中
,其中 、
、 分别为正、逆反应的速率常数,则以物质的分压表示的反应Ⅱ的平衡常数
分别为正、逆反应的速率常数,则以物质的分压表示的反应Ⅱ的平衡常数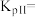
 、
、 表示);另
表示);另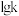 与
与 的关系如图所示,①、②、③、④四条直线中,表示反应Ⅱ
的关系如图所示,①、②、③、④四条直线中,表示反应Ⅱ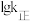 的是
的是 的转化率为60%,且体系中
的转化率为60%,且体系中 ,以物质的分压表示的反应Ⅰ的平衡常数
,以物质的分压表示的反应Ⅰ的平衡常数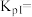
 的代数式表示)
的代数式表示)
(4)日本政府于2023年8月24日下午一点启动福岛核污染废水排海,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料。核废料中+6价的铀[U(Ⅵ)]可以通过电化学还原法处理,U(Ⅵ)还原为U(Ⅳ)的电化学装置如图所示:

阴极发生的反应为:
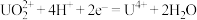
阴极区溶液中发生反应:
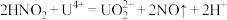 、
、
①阴极上发生的副反应为:
②阴极区溶液中加入
 的目的是
的目的是③电还原处理+6价的铀[U(Ⅵ)]转移
 ,阴极区
,阴极区 减少
减少
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐2】碳的化合物在工业上应用广泛。
I. 和乙烷反应制备乙烯。
和乙烷反应制备乙烯。
298K时,相关物质的相对能量如图,

(1) 与乙烷反应生成乙烯、CO和气态水的热化学方程式为
与乙烷反应生成乙烯、CO和气态水的热化学方程式为_______ 。
II. 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:
i.催化剂活化: (无活性)
(无活性) (有活性)
(有活性)
ii. 与在活化后的催化剂表面可逆的发生反应①:
与在活化后的催化剂表面可逆的发生反应①:
 ,其反应历程如图1。
,其反应历程如图1。
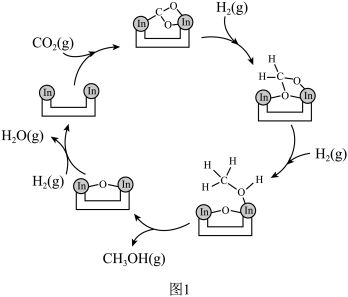
同时伴随反应②:
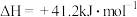
(2) 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。
已知: 选择性
选择性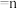 (生成
(生成 所消耗的
所消耗的 的量)
的量)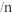 (发生转化的
(发生转化的 的量)。
的量)。 选择性随流速增大而升高的原因是
选择性随流速增大而升高的原因是_______ 。同时,流速加快可减少产物中 的积累,减少反应
的积累,减少反应_______ (用化学方程式表示)的发生,减少催化剂的失活,提高甲醇选择性。
(3)对于以上 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。
III.甲烷重整制合成气,主要反应如下:
i.

ii.

各反应平衡常数与温度的关系如图。
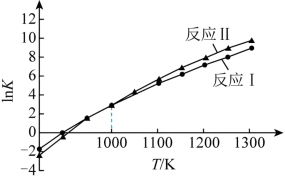
(4)①假设 、
、 不随温度变化,平衡常数与温度间存在的关系为:
不随温度变化,平衡常数与温度间存在的关系为: ,R为正常数。则
,R为正常数。则
_______ 0(填“>”或“<”);
_______  (填“>”或“<”)。
(填“>”或“<”)。
②通过调整投料比可调控平衡时合成气 的值。1000K,平衡时
的值。1000K,平衡时 ,则
,则
_______ ,应控制投料比
_______ 。
I.
 和乙烷反应制备乙烯。
和乙烷反应制备乙烯。298K时,相关物质的相对能量如图,

(1)
 与乙烷反应生成乙烯、CO和气态水的热化学方程式为
与乙烷反应生成乙烯、CO和气态水的热化学方程式为II.
 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:i.催化剂活化:
 (无活性)
(无活性) (有活性)
(有活性)ii.
 与在活化后的催化剂表面可逆的发生反应①:
与在活化后的催化剂表面可逆的发生反应①:
 ,其反应历程如图1。
,其反应历程如图1。
同时伴随反应②:

(2)
 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。
已知:
 选择性
选择性 (生成
(生成 所消耗的
所消耗的 的量)
的量) (发生转化的
(发生转化的 的量)。
的量)。 选择性随流速增大而升高的原因是
选择性随流速增大而升高的原因是 的积累,减少反应
的积累,减少反应(3)对于以上
 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。| A.碳的杂化方式没有发生改变 |
B.反应中经历了 、 、 键的形成和断裂 键的形成和断裂 |
C.加压可以提高 的平衡转化率 的平衡转化率 |
| D.升高温度可以提高甲醇在平衡时的选择性 |
III.甲烷重整制合成气,主要反应如下:
i.


ii.


各反应平衡常数与温度的关系如图。

(4)①假设
 、
、 不随温度变化,平衡常数与温度间存在的关系为:
不随温度变化,平衡常数与温度间存在的关系为: ,R为正常数。则
,R为正常数。则

 (填“>”或“<”)。
(填“>”或“<”)。②通过调整投料比可调控平衡时合成气
 的值。1000K,平衡时
的值。1000K,平衡时 ,则
,则

您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐3】2020年中国向世界宣布2030年前实现碳达峰,2060年前实现碳中和。转化和吸收CO2的研究成为更加迫切的任务。
(1)在催化剂作用下CO2和H2发生反应I:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H1。已知298K时,部分物质的相对能量如表所示(忽略△H随温度的变化)。
C2H4(g)+4H2O(g) △H1。已知298K时,部分物质的相对能量如表所示(忽略△H随温度的变化)。
则△H1=_____ kJ•mol-1,该反应能够自发进行的条件是_____ (填“较高温度”或“较低温度”)。
(2)在恒温恒容条件下,向密闭容器中充入CO2、H2,加入合适催化剂,发生反应I,下列情况表明反应I达到平衡状态的是_____ (填序号)。
(3)在一体积不变的密闭容器中投入0.4molCO2和1.2molH2,发生反应I,测得CO2的平衡转化率与温度、压强的关系如图所示;
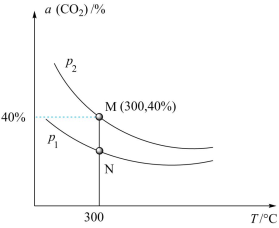
①随着温度升高,不同压强下,CO2的平衡转化率接近相等,原因是______ 。
②若反应平衡时M点(p2对应压强下)密闭容器的体积为2L,请列出计算N点条件下反应Ⅰ的平衡常数的计算式K=_____ (只列计算式)。
(4)CO2催化加H2还可能生成其他含碳化合物。研究发现,Fe、Co固体双催化剂的成分对相同时间内CO2转化率和产物选择性有重要作用,部分研究数据如表所示:
下列说法错误的是______ (填序号)。
(5)在一定条件下,选择合适的催化剂使CO2只发生转化为CO的反应:CO2(g)+H2(g) CO(g)+H2O(g) △H>0。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图所示:
CO(g)+H2O(g) △H>0。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图所示:
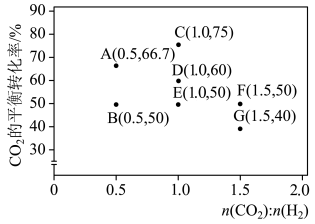
已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是_____ 点,计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到40%时, =
=_____ 。
(1)在催化剂作用下CO2和H2发生反应I:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H1。已知298K时,部分物质的相对能量如表所示(忽略△H随温度的变化)。
C2H4(g)+4H2O(g) △H1。已知298K时,部分物质的相对能量如表所示(忽略△H随温度的变化)。| 物质 | CO2(g) | H2O(l) | H2O(g) | H2(g) | C2H4(g) |
| 相对能量(kJ•mol-1) | -393 | -286 | -242 | 0 | 52 |
(2)在恒温恒容条件下,向密闭容器中充入CO2、H2,加入合适催化剂,发生反应I,下列情况表明反应I达到平衡状态的是
| A.C2H4的体积分数保持不变 | B.混合气体密度保持不变 |
| C.混合气体的平均摩尔质量保持不变 | D.混合气体中C2H4与H2O(g)的分压之比不变 |

①随着温度升高,不同压强下,CO2的平衡转化率接近相等,原因是
②若反应平衡时M点(p2对应压强下)密闭容器的体积为2L,请列出计算N点条件下反应Ⅰ的平衡常数的计算式K=
(4)CO2催化加H2还可能生成其他含碳化合物。研究发现,Fe、Co固体双催化剂的成分对相同时间内CO2转化率和产物选择性有重要作用,部分研究数据如表所示:
| 实验编号 | n(Fe):n(Co) | CO2转化率/% | CO选择性/% | CH4选择性/% | C2H4选择性/% | 反应后固体的成分 |
| 1 | 100∶0 | 1.1 | 100 | 0 | 0 | Fe和少量Fe3O4 |
| 2 | 50∶50 | 30.5 | 36.8 | 42.9 | 20.3 | Fe和Co |
| 3 | 0∶100 | 69.2 | 2.7 | 97.1 | 0.2 | Co |
| A.实验1中生成Fe3O4的化学方程式为3Fe+4CO2=Fe3O4+4CO |
| B.用该方法制备CH4时,最好选用金属Co作催化剂 |
| C.n(Fe):n(Co)对该制备过程影响很大 |
| D.若生成等物质的量的CH4和C2H4,转移的电子数比值为2∶1 |
 CO(g)+H2O(g) △H>0。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图所示:
CO(g)+H2O(g) △H>0。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图所示:
已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是
 =
=
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐1】甲酸是基本有机化工原料之一,广泛应用于农药、皮革、染料、医药和橡胶等工业。在较高温度或有催化剂存在下,它会分解成CO和 或
或 和
和 。
。
反应Ⅰ: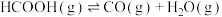

反应Ⅱ: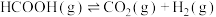
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的 =
=___________  。
。
(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。
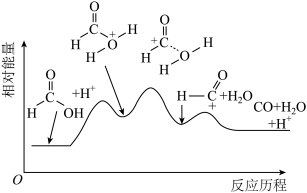
该反应的催化剂为___________ ,该反应历程中速率最慢步骤的化学方程式为___________ 。
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体, 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
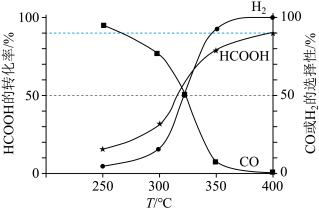
①400℃时,反应Ⅱ的平衡常数 =
=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×体积分数;结果保留小数点后1位)。
②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:___________ 。
(4)已知:25℃时, 的电离平衡常数
的电离平衡常数 ,
, ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。
①将100mL 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL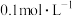 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:___________ 。
②25℃时,当溶液中 时,溶液中
时,溶液中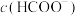 =
=___________  。
。
 或
或 和
和 。
。反应Ⅰ:
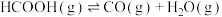

反应Ⅱ:
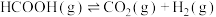
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的
 =
= 。
。(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。

该反应的催化剂为
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体,
 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
①400℃时,反应Ⅱ的平衡常数
 =
=②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:
(4)已知:25℃时,
 的电离平衡常数
的电离平衡常数 ,
, ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。①将100mL
 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL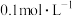 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:②25℃时,当溶液中
 时,溶液中
时,溶液中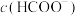 =
= 。
。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐2】某小组探秘人体血液中的运载氧平衡及酸碱平衡,回答下列问题:
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:
ⅰ.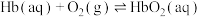

ⅱ.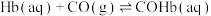

ⅱ.

ⅳ.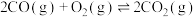

(1)
________ (用含a、b或c的代数式表示)。
(2) 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。
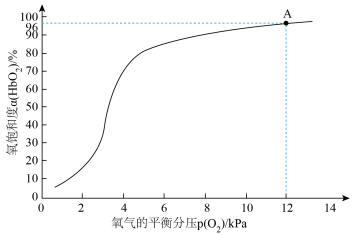
(3)36.5℃时,氧饱和度[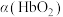 ,
,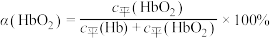 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
____________________ (写出计算过程;氧气的平衡浓度可用氧气的平衡分压代替)。
正常人体血液中主要含有 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
(4)37℃时 的水解常数
的水解常数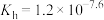 ,
,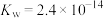 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式___________ ;请判断该同学血液的pH是否正常________ 。(填“是”或“否”)
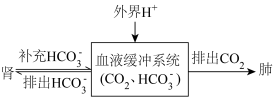
(5)人体酸碱平衡维持机制简要表达如下图: 会
会__________ (选填“增加”或“减少”)。
②对于重度代谢性酸中毒的病人应该采用什么治疗方法__________ 。(选填字母)
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5% 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合
 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:ⅰ.
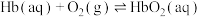

ⅱ.
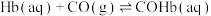

ⅱ.


ⅳ.
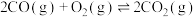

(1)

(2)
 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。A.当 不变时,反应达到平衡 不变时,反应达到平衡 | B.若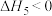 ,则该反应任意温度下能自发 ,则该反应任意温度下能自发 |
C.高氧条件下,血液中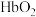 浓度增加 浓度增加 | D.人体代谢酸增加,该反应K值变大 |
(3)36.5℃时,氧饱和度[
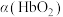 ,
,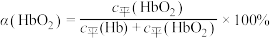 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
正常人体血液中主要含有
 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:项目名称 | 结果浓度 | 参考范围 | |
正常人 | 代谢性酸中毒病人 | ||
| 40 | 50 | 35~45 |
| 24.2 | 19 | 23.3~24.8 |
血液酸碱度(pH) | 7.40 | 7.21 | 7.35~7.45 |
(4)37℃时
 的水解常数
的水解常数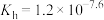 ,
,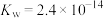 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式(5)人体酸碱平衡维持机制简要表达如下图:
 会
会②对于重度代谢性酸中毒的病人应该采用什么治疗方法
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5%
 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
您最近一年使用:0次
【推荐3】反应2NO(g)+O2(g) 2NO2(g)是制取硝酸、烟气脱硝中的重要反应。回答下列问题:
2NO2(g)是制取硝酸、烟气脱硝中的重要反应。回答下列问题:
(1)NO被氧化的机理如下:第一步:NO+O2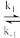 NO3,第二步:NO3+NO
NO3,第二步:NO3+NO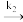 2NO2,其能量与反应过程的关系如图所示:
2NO2,其能量与反应过程的关系如图所示:
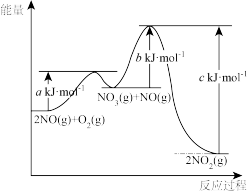
①2NO(g)+O2(g) = 2NO2(g)的ΔH___________ 0(填“>”或“<”)。图中第一步反应的逆反应的活化能为___________ kJ/mol(用含a、b、c、ΔH的代数式表示)。
②k1、k−1、k2为反应速率常数,若某反应包含多个基元反应(一步直接转化为产物的反应,如上述反应第一步与第二步均为基元反应),反应速率由最慢的一步基元反应决定,对于基元反应aA + bB=cC+dD,其速率方程为v(正)=kca(A)·cb(B)。上述第一步反应的平衡常数为___________ (用含如k1、k−1的代数式表示);写出反应2NO(g) +O2(g) 2NO2(g)的平衡速率方程:v(正)=
2NO2(g)的平衡速率方程:v(正)=___________ (用含k1、k−1、k2、c( NO)及c(O2)的代数式表示)。
(2)在恒压反应器中充入NO、O2,当O2分别过量6%、20%和100%时,NO的平衡转化率α分别如图所示(图中虚线)。
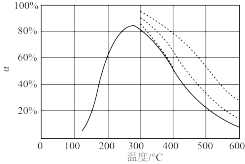
①该压强下,400℃、O2过量100%时,NO的平衡转化率α =___________
②图中实线为相同时间内NO的转化率随温度的变化曲线,实线左侧,随温度升高,NO的转化率逐渐增大,其原因是___________ 。
(3)若在恒压反应器中充入m mol NO和n mol O2,在温度T℃、压强p kPa条件下进行反应。平衡时,若NO的转化率为50%,则该条件下的平衡常数Kp=___________ kPa−1(以分压表示,分压=总压×物质的量分数)。
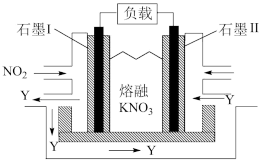
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如下图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。则正极反应方程式为___________ 。
 2NO2(g)是制取硝酸、烟气脱硝中的重要反应。回答下列问题:
2NO2(g)是制取硝酸、烟气脱硝中的重要反应。回答下列问题:(1)NO被氧化的机理如下:第一步:NO+O2
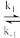 NO3,第二步:NO3+NO
NO3,第二步:NO3+NO 2NO2,其能量与反应过程的关系如图所示:
2NO2,其能量与反应过程的关系如图所示:
①2NO(g)+O2(g) = 2NO2(g)的ΔH
②k1、k−1、k2为反应速率常数,若某反应包含多个基元反应(一步直接转化为产物的反应,如上述反应第一步与第二步均为基元反应),反应速率由最慢的一步基元反应决定,对于基元反应aA + bB=cC+dD,其速率方程为v(正)=kca(A)·cb(B)。上述第一步反应的平衡常数为
 2NO2(g)的平衡速率方程:v(正)=
2NO2(g)的平衡速率方程:v(正)=(2)在恒压反应器中充入NO、O2,当O2分别过量6%、20%和100%时,NO的平衡转化率α分别如图所示(图中虚线)。

①该压强下,400℃、O2过量100%时,NO的平衡转化率α =
②图中实线为相同时间内NO的转化率随温度的变化曲线,实线左侧,随温度升高,NO的转化率逐渐增大,其原因是
(3)若在恒压反应器中充入m mol NO和n mol O2,在温度T℃、压强p kPa条件下进行反应。平衡时,若NO的转化率为50%,则该条件下的平衡常数Kp=
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如下图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。则正极反应方程式为

您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐1】研究和深度开发氮氧化物、碳氧化物、硫及其化合物的应用对构建生态文明社会具有重要的意义。
Ⅰ.NO会加速臭氧层被破坏,其反应过程如图所示:

(1)NO的作用是____ 。
(2)已知:O3(g)+O(g) 2O2 ΔH=-143kJ·mol-l
2O2 ΔH=-143kJ·mol-l
反应1:O3+NO NO2+O2 ΔH1=-200.2kJ·mol-l
NO2+O2 ΔH1=-200.2kJ·mol-l
反应2:热化学方程式为____ 。
Ⅱ.已知反应:H2S(g)+CO(g) COS(g)+H2(g) ΔH<0。
COS(g)+H2(g) ΔH<0。
(3)COS(羰基硫)中心原子的杂化方式为____ ,写出COS(羰基硫)的电子式___ 。H2O中的H—O—H键角____ (填“>”、“=”或“<”)H2S中的H—S—H键角。
(4)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。
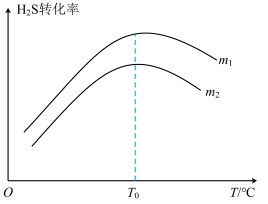
①m1____ m2.(填“>”、“<”或“=”)
②温度高于T0时,H2S转化率减小的可能原因为___ 。
A.反应停止了 B.催化剂活性降低 C.反应达到平衡 D.反应的ΔH变大
③240℃时,将等物质的量的H2S(g)与CO(g)充入密闭容器中,测得H2(g)的平衡体积分数为25%。则此时该反应的平衡常数K=___ 。
④在300℃、320℃时上述反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图所示。起始密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等。则300℃时ω[COS(g)]随时间变化的曲线为_____ ,320℃时ω[H2S(g)]随时间变化的曲线为____ 。

Ⅰ.NO会加速臭氧层被破坏,其反应过程如图所示:

(1)NO的作用是
(2)已知:O3(g)+O(g)
 2O2 ΔH=-143kJ·mol-l
2O2 ΔH=-143kJ·mol-l反应1:O3+NO
 NO2+O2 ΔH1=-200.2kJ·mol-l
NO2+O2 ΔH1=-200.2kJ·mol-l反应2:热化学方程式为
Ⅱ.已知反应:H2S(g)+CO(g)
 COS(g)+H2(g) ΔH<0。
COS(g)+H2(g) ΔH<0。(3)COS(羰基硫)中心原子的杂化方式为
(4)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。

①m1
②温度高于T0时,H2S转化率减小的可能原因为
A.反应停止了 B.催化剂活性降低 C.反应达到平衡 D.反应的ΔH变大
③240℃时,将等物质的量的H2S(g)与CO(g)充入密闭容器中,测得H2(g)的平衡体积分数为25%。则此时该反应的平衡常数K=
④在300℃、320℃时上述反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图所示。起始密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等。则300℃时ω[COS(g)]随时间变化的曲线为

您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐2】甲酸是基本有机化工原料之一,广泛应用于农药、皮革、染料、医药和橡胶等工业。在较高温度或有催化剂存在下,它会分解成CO和 或
或 和
和 。
。
反应Ⅰ: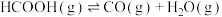

反应Ⅱ: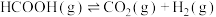
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的 =
=___________  。
。
(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。

该反应的催化剂为___________ ,该反应历程中速率最慢步骤的化学方程式为___________ 。
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体, 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。

①400℃时,反应Ⅱ的平衡常数 =
=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×体积分数;结果保留小数点后1位)。
②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:___________ 。
(4)已知:25℃时, 的电离平衡常数
的电离平衡常数 ,
, ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。
①将100mL 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL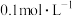 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:___________ 。
②25℃时,当溶液中 时,溶液中
时,溶液中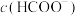 =
=___________  。
。
 或
或 和
和 。
。反应Ⅰ:
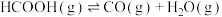

反应Ⅱ:
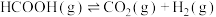
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的
 =
= 。
。(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。

该反应的催化剂为
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体,
 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
①400℃时,反应Ⅱ的平衡常数
 =
=②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:
(4)已知:25℃时,
 的电离平衡常数
的电离平衡常数 ,
, ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。①将100mL
 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL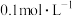 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:②25℃时,当溶液中
 时,溶液中
时,溶液中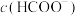 =
= 。
。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐3】甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。
已知涉及的反应如下:
反应Ⅰ:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1
CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1
反应Ⅱ:CO(g)+ H2O(g) CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
反应Ⅲ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1
CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1
回答下列问题:
(1)ΔH2=___________ kJ·mol-1。
(2)在360°C时,在固定容积的容器中充入一定量的CO进行上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随 变化的情况如图1所示。
变化的情况如图1所示。

①图中表示H2转化率、CH4产率变化的曲线分别是___________ 、___________ (填标号), A、C两点 的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是
的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是___________ 。
②一定温度下,向恒容容器内充入3mol H2和1molCO,初始压强为4p0,发生上述3个反应,达到平衡时CO的分压为p1,CO2的分压为p2,则CH4的选择性=___________ [CH4的选择性=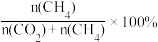 ,用p0,p1,p2表示,下同],反应Ⅱ的Kp=
,用p0,p1,p2表示,下同],反应Ⅱ的Kp=___________ (用分压表示,分压=总压×物质的量分数)。
(3)已知常温下,CaCO3的溶度积常数为Ksp,H2CO3的二级电离常数为Ka2。CaCO3溶于水除了沉淀溶解平衡,还存在碳酸根的水解(忽略二级水解)。则常温下,CaCO3的实际溶解度比理论值___________ (填“大”或者“小”)。若溶液pH已知,则钙离子的实际浓度为___________ mol/L[用含c(H+),Ksp,Ka2的式子表达]。
已知涉及的反应如下:
反应Ⅰ:CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1
CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1反应Ⅱ:CO(g)+ H2O(g)
 CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2反应Ⅲ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1
CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1回答下列问题:
(1)ΔH2=
(2)在360°C时,在固定容积的容器中充入一定量的CO进行上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随
 变化的情况如图1所示。
变化的情况如图1所示。
①图中表示H2转化率、CH4产率变化的曲线分别是
 的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是
的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是②一定温度下,向恒容容器内充入3mol H2和1molCO,初始压强为4p0,发生上述3个反应,达到平衡时CO的分压为p1,CO2的分压为p2,则CH4的选择性=
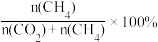 ,用p0,p1,p2表示,下同],反应Ⅱ的Kp=
,用p0,p1,p2表示,下同],反应Ⅱ的Kp=(3)已知常温下,CaCO3的溶度积常数为Ksp,H2CO3的二级电离常数为Ka2。CaCO3溶于水除了沉淀溶解平衡,还存在碳酸根的水解(忽略二级水解)。则常温下,CaCO3的实际溶解度比理论值
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
【推荐1】硼族元素可形成许多结构和性质特殊的化合物,回答下列问题:
(1)过硼酸钠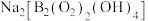 被用于洗衣粉中作增白剂,其阴离子结构如图所示
被用于洗衣粉中作增白剂,其阴离子结构如图所示 ,该阴离子组成元素中第一电离能最大的元素是
,该阴离子组成元素中第一电离能最大的元素是______ ,该物质可用于增白的原因是______ 。
(2)硼酸三甲酯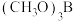 由硼酸
由硼酸 和甲醇互相反应而制得。熔沸点
和甲醇互相反应而制得。熔沸点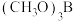
______  (填“>”或“<”或“=”),原因是
(填“>”或“<”或“=”),原因是______ 。比较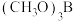 和
和 中
中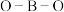 键角的大小顺序是
键角的大小顺序是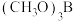
______  (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。
(3)氮化硼晶体有多种结构,六方相氮化硼结构与石墨相似,但不具有导电性。六方氮化硼中与B距离最近且相等的B有______ 个。
(4)科学家利用 和过量碳高温条件下合成一种非常坚硬的物质,其结构如图所示,该反应的化学方程式为
和过量碳高温条件下合成一种非常坚硬的物质,其结构如图所示,该反应的化学方程式为______ ,晶胞参数: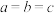 (单位nm),
(单位nm), 。若
。若 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为______  。
。
(1)过硼酸钠
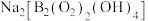 被用于洗衣粉中作增白剂,其阴离子结构如图所示
被用于洗衣粉中作增白剂,其阴离子结构如图所示 ,该阴离子组成元素中第一电离能最大的元素是
,该阴离子组成元素中第一电离能最大的元素是(2)硼酸三甲酯
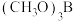 由硼酸
由硼酸 和甲醇互相反应而制得。熔沸点
和甲醇互相反应而制得。熔沸点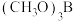
 (填“>”或“<”或“=”),原因是
(填“>”或“<”或“=”),原因是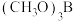 和
和 中
中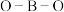 键角的大小顺序是
键角的大小顺序是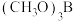
 (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。(3)氮化硼晶体有多种结构,六方相氮化硼结构与石墨相似,但不具有导电性。六方氮化硼中与B距离最近且相等的B有
(4)科学家利用
 和过量碳高温条件下合成一种非常坚硬的物质,其结构如图所示,该反应的化学方程式为
和过量碳高温条件下合成一种非常坚硬的物质,其结构如图所示,该反应的化学方程式为 (单位nm),
(单位nm), 。若
。若 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
解题方法
【推荐2】铁在工业中有重要作用,也是人体必需的微量元素。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式_______ 。
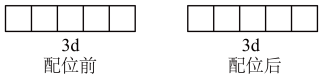
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为_______ ,配离子中Fe3+为d2sp3杂化,写出配位前后Fe3+3d轨道表示式_______ 。
(2)邻二氮菲的结构简式为 ,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
①中心离子的配位数为_______ ,配位原子的杂化方式为_______ 。
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因_______
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。
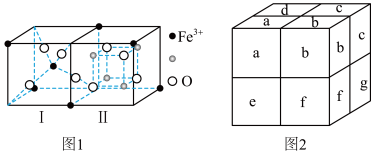
①Fe3O4晶胞中有_______ 个Fe离子, 代表
代表_______ 。
②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为_______ g/cm3。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为

(2)邻二氮菲的结构简式为
 ,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。①中心离子的配位数为
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。

①Fe3O4晶胞中有
 代表
代表②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
【推荐3】钴酸锂电池是一种应用广泛的二次电池,其主要以碳酸二乙酯、碳酸乙烯酯等为溶剂,以高氯酸锂(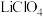 )、六氟磷酸锂(
)、六氟磷酸锂( )、四氟硼酸锂(
)、四氟硼酸锂(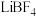 )等锂盐为溶质,并添加适当的添加剂所构成。
)等锂盐为溶质,并添加适当的添加剂所构成。
已知:ⅰ.钴酸锂摩尔质量为 。
。
ⅱ. 。
。
回答下列问题:
(1)钴酸锂晶胞结构示意图如图,其最简化学式是______ ,其钴离子的价电子排布图为_____ 。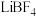 )中含有的化学键类型有
)中含有的化学键类型有_______ ,B原子的杂化类型是_______ 。
(3)高氯酸锂(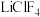 )中,
)中, 的空间构型是
的空间构型是_______ 。
(4)六氟磷酸锂 中Li、P、F的电负性由大到小的排序是
中Li、P、F的电负性由大到小的排序是___ ,其晶体类型为___ 。
(5)钴离子的配位数为_______ ,晶体的密度是_______  。(用含M、
。(用含M、 、a、b的代数式表示)
、a、b的代数式表示)
(6)钴酸锂电池充电时, 从正极材料中脱出,当
从正极材料中脱出,当 脱嵌率为
脱嵌率为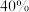 时,
时,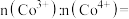
_______ 。当正极材料中的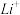 脱嵌率超过
脱嵌率超过 时,该晶体结构会发生相转变,导致
时,该晶体结构会发生相转变,导致 脱离晶格被氧化为氧气,严重影响钴酸锂的循环稳定性及电池安全性,需进行过充保护。
脱离晶格被氧化为氧气,严重影响钴酸锂的循环稳定性及电池安全性,需进行过充保护。
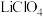 )、六氟磷酸锂(
)、六氟磷酸锂( )、四氟硼酸锂(
)、四氟硼酸锂(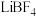 )等锂盐为溶质,并添加适当的添加剂所构成。
)等锂盐为溶质,并添加适当的添加剂所构成。已知:ⅰ.钴酸锂摩尔质量为
 。
。ⅱ.
 。
。回答下列问题:
(1)钴酸锂晶胞结构示意图如图,其最简化学式是

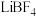 )中含有的化学键类型有
)中含有的化学键类型有(3)高氯酸锂(
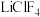 )中,
)中, 的空间构型是
的空间构型是(4)六氟磷酸锂
 中Li、P、F的电负性由大到小的排序是
中Li、P、F的电负性由大到小的排序是(5)钴离子的配位数为
 。(用含M、
。(用含M、 、a、b的代数式表示)
、a、b的代数式表示)(6)钴酸锂电池充电时,
 从正极材料中脱出,当
从正极材料中脱出,当 脱嵌率为
脱嵌率为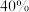 时,
时,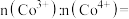
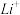 脱嵌率超过
脱嵌率超过 时,该晶体结构会发生相转变,导致
时,该晶体结构会发生相转变,导致 脱离晶格被氧化为氧气,严重影响钴酸锂的循环稳定性及电池安全性,需进行过充保护。
脱离晶格被氧化为氧气,严重影响钴酸锂的循环稳定性及电池安全性,需进行过充保护。
您最近一年使用:0次