2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1=-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为__________ 。
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1=-90kJ·mol-1K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2K2
已知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3=-41.1kJ·mol-1K3
H2O(l)=H2O(g) △H4=+44.0kJ·mol-1K4
则△H2=______ K2=_______ (用含K1、K3、K 4的代数式表示)
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________ 。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
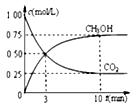
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________ (用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______ (填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为_____ 。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______ 。硝酸浓度不能过大,其原因是___________________________________________ 。
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1=-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1=-90kJ·mol-1K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2K2
已知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3=-41.1kJ·mol-1K3
H2O(l)=H2O(g) △H4=+44.0kJ·mol-1K4
则△H2=
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g)
 CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)①下列能说明该反应已达到平衡状态的是
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为

(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为
更新时间:2018-01-06 17:06:08
|
相似题推荐
解答题-原理综合题
|
困难
(0.15)
【推荐1】研发二氧化碳的碳捕集和碳利用技术是科学研究热点问题。
(1)常温常压下,一些常见物质的燃烧热如表所示:
已知:
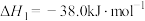
则

___________  ,该反应在
,该反应在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
(2) 催化加氢制取甲醇,反应如下:
催化加氢制取甲醇,反应如下:
主反应:

副反应:
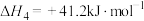
在一定条件下,向某1L恒容密闭容器中充入1mol 和a mol
和a mol 发生反应,起始总压强为21.2MPa.实验测得
发生反应,起始总压强为21.2MPa.实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度变化如图甲所示:
的选择性随温度变化如图甲所示:

已知: 的选择性
的选择性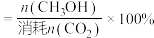 。图甲中表示平衡时
。图甲中表示平衡时 的选择性的曲线为
的选择性的曲线为___________ (填“X”或“Y”),温度高于280℃时,曲线Y随温度升高而升高的原因是___________ 。240℃时,反应20min容器内达到平衡状态,副反应的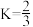 ,则初始充入
,则初始充入 的物质的量
的物质的量
___________ mol,平衡时容器内的总压强为___________ MPa。
(1)常温常压下,一些常见物质的燃烧热如表所示:
| 名称 | 氢气 | 甲烷 | 一氧化碳 | 甲醇 |
 /( /( ) ) | -285.8 | -890.3 | -283.0 | -726.5 |

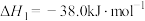
则


 ,该反应在
,该反应在(2)
 催化加氢制取甲醇,反应如下:
催化加氢制取甲醇,反应如下:主反应:


副反应:

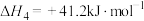
在一定条件下,向某1L恒容密闭容器中充入1mol
 和a mol
和a mol 发生反应,起始总压强为21.2MPa.实验测得
发生反应,起始总压强为21.2MPa.实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度变化如图甲所示:
的选择性随温度变化如图甲所示:
已知:
 的选择性
的选择性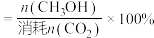 。图甲中表示平衡时
。图甲中表示平衡时 的选择性的曲线为
的选择性的曲线为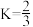 ,则初始充入
,则初始充入 的物质的量
的物质的量
您最近一年使用:0次
【推荐2】党的二十大报告中强调“实现碳达峰碳中和是一场广泛而深刻的经济社会系统性变革”。 的转化和利用是实现碳中和的有效途径。回答下列问题。
的转化和利用是实现碳中和的有效途径。回答下列问题。
I.利用 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
① ,
,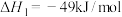
② ,
,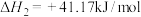
③ ,
,
(1)反应③中
___________ ,若要该反应自发进行,___________ (填“高温”或“低温”)更有利。
(2)在恒温,恒容密闭容器中,对于反应③,下列说法中能说明该反应达到化学平衡状态的是___________(填字母序号)。
(3)在催化剂作用下,按的 比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时
比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
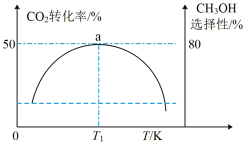
已知:甲醇的选择性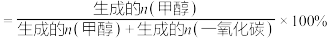
①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是___________ 。
② K时,若反应从开始到达到a点所用时间为5min,
K时,若反应从开始到达到a点所用时间为5min,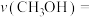
___________  ,反应②的
,反应②的
___________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数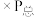 ,最终结果用分数表示)。
,最终结果用分数表示)。
II.
(4)水杨醛缩邻氨基苯酚(A)又被称为“锰试剂”,可与 形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是
形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是___________ (填“A”或“B”),原因是___________ 。
A.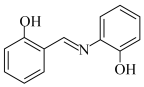 B.
B.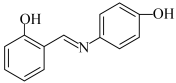
(5)吡啶(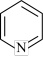 )具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。
)具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。
(6)2001年德国专家从硫酸铵中检出一种组成为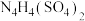 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以 和
和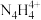 两种离子的形式存在。
两种离子的形式存在。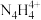 中N原子均为
中N原子均为 杂化,请写出
杂化,请写出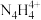 的结构式:
的结构式:___________ 。
 的转化和利用是实现碳中和的有效途径。回答下列问题。
的转化和利用是实现碳中和的有效途径。回答下列问题。I.利用
 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:①
 ,
,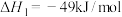
②
 ,
,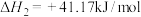
③
 ,
,
(1)反应③中

(2)在恒温,恒容密闭容器中,对于反应③,下列说法中能说明该反应达到化学平衡状态的是___________(填字母序号)。
| A.混合气体的平均相对分子质量不再变化 |
| B.混合气体的密度不再变化 |
C.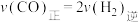 |
D.CO、 、 、 的物质的量之比为1∶2∶1 的物质的量之比为1∶2∶1 |
 比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时
比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
已知:甲醇的选择性
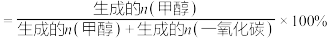
①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是
②
 K时,若反应从开始到达到a点所用时间为5min,
K时,若反应从开始到达到a点所用时间为5min,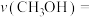
 ,反应②的
,反应②的
 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数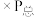 ,最终结果用分数表示)。
,最终结果用分数表示)。II.
(4)水杨醛缩邻氨基苯酚(A)又被称为“锰试剂”,可与
 形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是
形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是A.
 B.
B.
(5)吡啶(
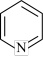 )具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。
)具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。A.吡啶中含有与苯类似的大π键 |
| B.吡啶中N原子的价层孤电子对占据2p轨道 |
C.3-甲基吡啶( )的碱性大于吡啶 )的碱性大于吡啶 |
| D.吡啶在水中的溶解度大于苯在水中的溶解度 |
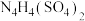 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以 和
和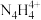 两种离子的形式存在。
两种离子的形式存在。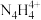 中N原子均为
中N原子均为 杂化,请写出
杂化,请写出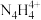 的结构式:
的结构式:
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐3】利用 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。
Ⅰ.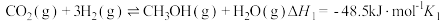
Ⅱ.
回答下列问题:
(1)已知反应Ⅲ的平衡常数 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式___________ 。
(2)一定条件下,向恒压密闭容器中以一定流速通入 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。 选择性的曲线是
选择性的曲线是___________ (填“ ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是___________ 。
②生成 的最佳条件是
的最佳条件是___________ (填标号)。


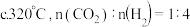

(3)一定温度下,向恒压密闭容器中通入 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为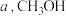 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数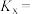
___________ ( 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。
(4)向压强恒为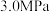 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气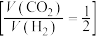 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是___________ 。
② 时,
时, 的平均反应速率
的平均反应速率
___________  。
。
③反应Ⅰ的速率方程可表示为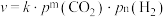 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,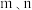 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则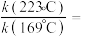
___________ 。
 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。Ⅰ.
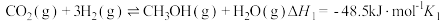
Ⅱ.

回答下列问题:
(1)已知反应Ⅲ的平衡常数
 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式(2)一定条件下,向恒压密闭容器中以一定流速通入
 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。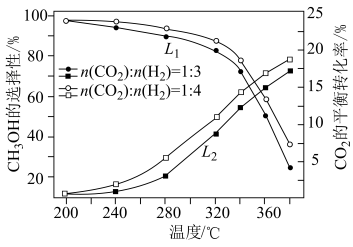
 选择性的曲线是
选择性的曲线是 ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是②生成
 的最佳条件是
的最佳条件是

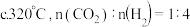

(3)一定温度下,向恒压密闭容器中通入
 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为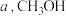 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数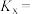
 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。(4)向压强恒为
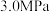 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气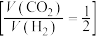 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是②
 时,
时, 的平均反应速率
的平均反应速率
 。
。③反应Ⅰ的速率方程可表示为
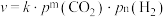 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,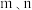 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则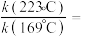
您最近一年使用:0次
【推荐1】当今世界多国相继规划了碳达峰、碳中和的时间节点,降低空气中二氧化碳含量成为研究热点。因此,研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一、请回答下列问题:
Ⅰ. 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )是综合利用
)是综合利用 的热点研究领域。制备苯乙烯涉及的主要反应如下:
的热点研究领域。制备苯乙烯涉及的主要反应如下:
i、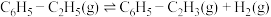

ii、

iii、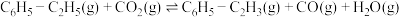
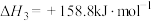
(1)
_____  。当反应达到平衡时,要提高
。当反应达到平衡时,要提高 的平衡产率,可采取的措施为
的平衡产率,可采取的措施为_____ (任写一种)。
(2)在某恒温恒容容器中发生 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )的反应,下列能说明反应达到平衡的是_____(填标号)。
)的反应,下列能说明反应达到平衡的是_____(填标号)。
(3)恒压0.1MPa下,将原料气配比改为下列三种情况:只有 、
、 :
: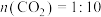 (对应曲线3)、
(对应曲线3)、 仅发生反应下i、ii,测得
仅发生反应下i、ii,测得 的平衡转化率与温度的变化关系如图1所示。
的平衡转化率与温度的变化关系如图1所示。
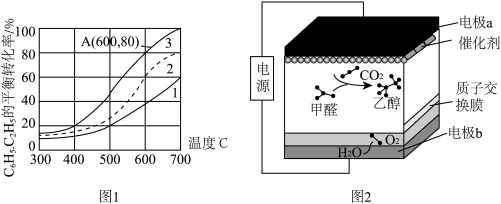
①图中表示原料气配比仅 的曲线是曲线
的曲线是曲线_____ (填“1”或“2”)。
②A点时, 的物质的量分数为0.01,该条件下反应i的
的物质的量分数为0.01,该条件下反应i的
_____ (分压=总压×物质的量分数)MPa.
Ⅱ.中科院化学所研究出了一种常温常压下通过电化学共还原 和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与
和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与 的高附加值转化,其工作原理如图2所示,总反应为
的高附加值转化,其工作原理如图2所示,总反应为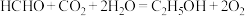 。
。
(4)电极b的电极反应式为_____ ,每生成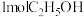 ,电路中转移的电子数为
,电路中转移的电子数为_____  。
。
Ⅰ.
 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )是综合利用
)是综合利用 的热点研究领域。制备苯乙烯涉及的主要反应如下:
的热点研究领域。制备苯乙烯涉及的主要反应如下:i、
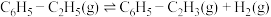

ii、


iii、
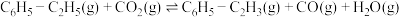
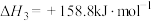
(1)

 。当反应达到平衡时,要提高
。当反应达到平衡时,要提高 的平衡产率,可采取的措施为
的平衡产率,可采取的措施为(2)在某恒温恒容容器中发生
 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )的反应,下列能说明反应达到平衡的是_____(填标号)。
)的反应,下列能说明反应达到平衡的是_____(填标号)。| A.容器内压强不再发生变化 |
| B.CO的百分含量不再发生变化 |
| C.容器内混合气体的密度不再发生变化 |
D.每消耗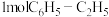 的同时生成 的同时生成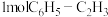 |
 、
、 :
: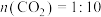 (对应曲线3)、
(对应曲线3)、 仅发生反应下i、ii,测得
仅发生反应下i、ii,测得 的平衡转化率与温度的变化关系如图1所示。
的平衡转化率与温度的变化关系如图1所示。
①图中表示原料气配比仅
 的曲线是曲线
的曲线是曲线②A点时,
 的物质的量分数为0.01,该条件下反应i的
的物质的量分数为0.01,该条件下反应i的
Ⅱ.中科院化学所研究出了一种常温常压下通过电化学共还原
 和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与
和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与 的高附加值转化,其工作原理如图2所示,总反应为
的高附加值转化,其工作原理如图2所示,总反应为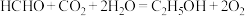 。
。(4)电极b的电极反应式为
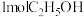 ,电路中转移的电子数为
,电路中转移的电子数为 。
。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐2】研究含碳和含氮物质的反应对生产、生活、科研等方面具有重要的意义。回答下列问题:
(1)已知:
ⅰ.
 kJ⋅mol
kJ⋅mol
ⅱ.
 kJ⋅mol
kJ⋅mol
ⅲ.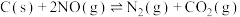
 kJ⋅mol
kJ⋅mol
则 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为___________ 。
(2)在保持T ℃、100 kPa条件下,向反应器中充入2 mol NO和1 mol 发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入
发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入___________ mol Ar作为稀释气(计算时不考虑其他反应)。
(3)一定条件下,向起始压强为90 kPa的2 L恒容密闭容器中通入2 mol NO和1 mol 的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,
的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,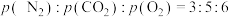 (p为气体分压,单位为kPa)。
(p为气体分压,单位为kPa)。
① 的平均反应速率
的平均反应速率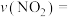
___________ mol⋅L ⋅min
⋅min 。
。
②下列说法正确的是___________ 。
A.将炭块粉碎可加快反应速率
B.平衡时充入Ar,反应ⅰ正向移动
C.混合气体的密度保持不变时,说明反应体系已达到平衡状态
③反应ⅰ的相对压力平衡常数
___________ [已知: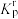 表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以
表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以 (
( kPa)]。
kPa)]。
(4)某科研小组以耐高温催化剂催化NO转化为 ,测得NO转化为
,测得NO转化为 的转化率随温度变化情况如图所示。则加入CO后,NO转化为
的转化率随温度变化情况如图所示。则加入CO后,NO转化为 的转化率增大的原因是
的转化率增大的原因是___________ 。
(1)已知:
ⅰ.

 kJ⋅mol
kJ⋅mol
ⅱ.

 kJ⋅mol
kJ⋅mol
ⅲ.
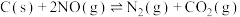
 kJ⋅mol
kJ⋅mol
则
 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)在保持T ℃、100 kPa条件下,向反应器中充入2 mol NO和1 mol
 发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入
发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入(3)一定条件下,向起始压强为90 kPa的2 L恒容密闭容器中通入2 mol NO和1 mol
 的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,
的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,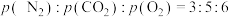 (p为气体分压,单位为kPa)。
(p为气体分压,单位为kPa)。①
 的平均反应速率
的平均反应速率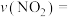
 ⋅min
⋅min 。
。②下列说法正确的是
A.将炭块粉碎可加快反应速率
B.平衡时充入Ar,反应ⅰ正向移动
C.混合气体的密度保持不变时,说明反应体系已达到平衡状态
③反应ⅰ的相对压力平衡常数

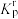 表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以
表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以 (
( kPa)]。
kPa)]。(4)某科研小组以耐高温催化剂催化NO转化为
 ,测得NO转化为
,测得NO转化为 的转化率随温度变化情况如图所示。则加入CO后,NO转化为
的转化率随温度变化情况如图所示。则加入CO后,NO转化为 的转化率增大的原因是
的转化率增大的原因是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐3】2020年中国向世界宣布2030年前实现碳达峰,2060年前实现碳中和。转化和吸收CO2的研究成为更加迫切的任务。
(1)在催化剂作用下CO2和H2发生反应I:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H1。已知298K时,部分物质的相对能量如表所示(忽略△H随温度的变化)。
C2H4(g)+4H2O(g) △H1。已知298K时,部分物质的相对能量如表所示(忽略△H随温度的变化)。
则△H1=_____ kJ•mol-1,该反应能够自发进行的条件是_____ (填“较高温度”或“较低温度”)。
(2)在恒温恒容条件下,向密闭容器中充入CO2、H2,加入合适催化剂,发生反应I,下列情况表明反应I达到平衡状态的是_____ (填序号)。
(3)在一体积不变的密闭容器中投入0.4molCO2和1.2molH2,发生反应I,测得CO2的平衡转化率与温度、压强的关系如图所示;
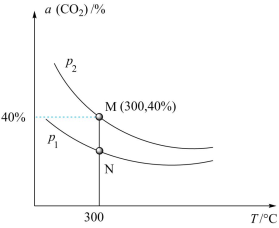
①随着温度升高,不同压强下,CO2的平衡转化率接近相等,原因是______ 。
②若反应平衡时M点(p2对应压强下)密闭容器的体积为2L,请列出计算N点条件下反应Ⅰ的平衡常数的计算式K=_____ (只列计算式)。
(4)CO2催化加H2还可能生成其他含碳化合物。研究发现,Fe、Co固体双催化剂的成分对相同时间内CO2转化率和产物选择性有重要作用,部分研究数据如表所示:
下列说法错误的是______ (填序号)。
(5)在一定条件下,选择合适的催化剂使CO2只发生转化为CO的反应:CO2(g)+H2(g) CO(g)+H2O(g) △H>0。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图所示:
CO(g)+H2O(g) △H>0。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图所示:
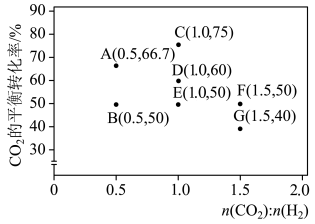
已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是_____ 点,计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到40%时, =
=_____ 。
(1)在催化剂作用下CO2和H2发生反应I:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H1。已知298K时,部分物质的相对能量如表所示(忽略△H随温度的变化)。
C2H4(g)+4H2O(g) △H1。已知298K时,部分物质的相对能量如表所示(忽略△H随温度的变化)。| 物质 | CO2(g) | H2O(l) | H2O(g) | H2(g) | C2H4(g) |
| 相对能量(kJ•mol-1) | -393 | -286 | -242 | 0 | 52 |
(2)在恒温恒容条件下,向密闭容器中充入CO2、H2,加入合适催化剂,发生反应I,下列情况表明反应I达到平衡状态的是
| A.C2H4的体积分数保持不变 | B.混合气体密度保持不变 |
| C.混合气体的平均摩尔质量保持不变 | D.混合气体中C2H4与H2O(g)的分压之比不变 |

①随着温度升高,不同压强下,CO2的平衡转化率接近相等,原因是
②若反应平衡时M点(p2对应压强下)密闭容器的体积为2L,请列出计算N点条件下反应Ⅰ的平衡常数的计算式K=
(4)CO2催化加H2还可能生成其他含碳化合物。研究发现,Fe、Co固体双催化剂的成分对相同时间内CO2转化率和产物选择性有重要作用,部分研究数据如表所示:
| 实验编号 | n(Fe):n(Co) | CO2转化率/% | CO选择性/% | CH4选择性/% | C2H4选择性/% | 反应后固体的成分 |
| 1 | 100∶0 | 1.1 | 100 | 0 | 0 | Fe和少量Fe3O4 |
| 2 | 50∶50 | 30.5 | 36.8 | 42.9 | 20.3 | Fe和Co |
| 3 | 0∶100 | 69.2 | 2.7 | 97.1 | 0.2 | Co |
| A.实验1中生成Fe3O4的化学方程式为3Fe+4CO2=Fe3O4+4CO |
| B.用该方法制备CH4时,最好选用金属Co作催化剂 |
| C.n(Fe):n(Co)对该制备过程影响很大 |
| D.若生成等物质的量的CH4和C2H4,转移的电子数比值为2∶1 |
 CO(g)+H2O(g) △H>0。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图所示:
CO(g)+H2O(g) △H>0。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图所示:
已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是
 =
=
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐1】汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:
已知:碳的燃烧热为393.5 kJ/mol




则:
(1)

_______ kJ/mol。
(2)将CO和NO按 投入一恒温密闭容器,反应达平衡时,体系的总压强为a Pa、
投入一恒温密闭容器,反应达平衡时,体系的总压强为a Pa、 的体积分数为20%,该温度下反应的平衡常数
的体积分数为20%,该温度下反应的平衡常数
_______ (用平衡分压代替平衡浓度计算)。
(3)催化剂性能决定了尾气处理效果。将NO和CO以一定的流速通过两种不同的催化剂(Ⅰ、Ⅱ)进行反应,测量逸出气体中NO含量,可测算尾气脱氮率。相同时间内,脱氮率随温度变化曲线如图所示。
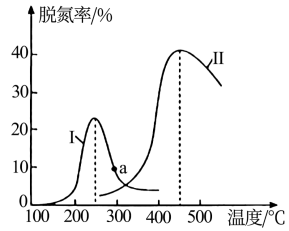
①曲线上a点的脱氮率_______ (填“>”、“<”或“=”)对应温度下的平衡脱氮率。
②催化剂Ⅱ条件下,450℃后,脱氮率随温度升高而下降的原因可能是_______ 。
(4)使用甲醇汽油能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应: ,到达平衡时,测得CO、
,到达平衡时,测得CO、 、
、 分别为1 mol、1 mol、1 mol,此时容器的体积为3 L,现往容器中继续通入3 mol CO,则v(正)
分别为1 mol、1 mol、1 mol,此时容器的体积为3 L,现往容器中继续通入3 mol CO,则v(正)_______ v(逆) (填“>”、“<”或“=”),判断的理由_______ 。
(5)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为: 。已知一定条件下,该反应中CO的平衡转化率随温度、投料比
。已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图:
的变化曲线如图:

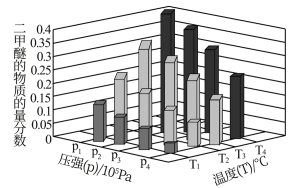
①a、b、c按从小到大的顺序排序为_______ 。
②某温度下,将2.0 mol 和4.0 mol
和4.0 mol  充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中二甲醚
充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中二甲醚 的物质的量分数变化情况如上图所示,在不同温度和压强下
的物质的量分数变化情况如上图所示,在不同温度和压强下 的平衡转化率最小的是
的平衡转化率最小的是_______ ;
A. 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_______ 。
A.混合气体的平均摩尔质量变小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.
E.混合气体的密度减小 F.氢气的转化率减小

已知:碳的燃烧热为393.5 kJ/mol




则:
(1)


(2)将CO和NO按
 投入一恒温密闭容器,反应达平衡时,体系的总压强为a Pa、
投入一恒温密闭容器,反应达平衡时,体系的总压强为a Pa、 的体积分数为20%,该温度下反应的平衡常数
的体积分数为20%,该温度下反应的平衡常数
(3)催化剂性能决定了尾气处理效果。将NO和CO以一定的流速通过两种不同的催化剂(Ⅰ、Ⅱ)进行反应,测量逸出气体中NO含量,可测算尾气脱氮率。相同时间内,脱氮率随温度变化曲线如图所示。

①曲线上a点的脱氮率
②催化剂Ⅱ条件下,450℃后,脱氮率随温度升高而下降的原因可能是
(4)使用甲醇汽油能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:
 ,到达平衡时,测得CO、
,到达平衡时,测得CO、 、
、 分别为1 mol、1 mol、1 mol,此时容器的体积为3 L,现往容器中继续通入3 mol CO,则v(正)
分别为1 mol、1 mol、1 mol,此时容器的体积为3 L,现往容器中继续通入3 mol CO,则v(正)(5)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
 。已知一定条件下,该反应中CO的平衡转化率随温度、投料比
。已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图:
的变化曲线如图:

①a、b、c按从小到大的顺序排序为
②某温度下,将2.0 mol
 和4.0 mol
和4.0 mol  充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中二甲醚
充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中二甲醚 的物质的量分数变化情况如上图所示,在不同温度和压强下
的物质的量分数变化情况如上图所示,在不同温度和压强下 的平衡转化率最小的是
的平衡转化率最小的是A.
 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
A.混合气体的平均摩尔质量变小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.

E.混合气体的密度减小 F.氢气的转化率减小
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐2】丙烯是重要的有机化工原料之一,丙烷直接脱氢制丙烯 是一条绿色生产丙烯的途径。
是一条绿色生产丙烯的途径。
主反应: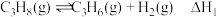
副反应: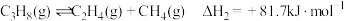
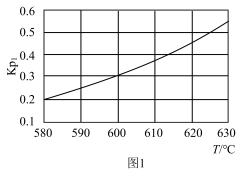
(1) 恒压下,主反应的
恒压下,主反应的 随温度变化如图1所示,
随温度变化如图1所示,
_______ 0(填”、“<”或=”),判断的理由是_______ 。
(2) 恒压下,
恒压下,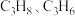 在不同温度下的平衡体积分数如图2所示,图中表示
在不同温度下的平衡体积分数如图2所示,图中表示 的体积分数的曲线为
的体积分数的曲线为_______ (填“a”或“b”), 时,
时, 的体积分数为
的体积分数为_______ 。

(3)下列关于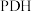 工艺说法正确的是
工艺说法正确的是
(4)丙烷氧化脱氢制丙烯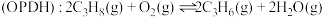
 ,相比
,相比 ,该途径生产丙烯的好处是
,该途径生产丙烯的好处是_______ 。
(5)用下图所示装置电解二氧化碳酸性溶液也可制得丙烯。
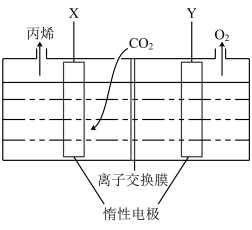
①Y极与电源_______ (填“正”或“负”)极相连。
②X极的电极反应式为_______ 。
③理论上,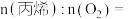
_______ 。
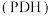 是一条绿色生产丙烯的途径。
是一条绿色生产丙烯的途径。主反应:
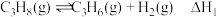
副反应:
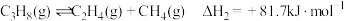
(1)
 恒压下,主反应的
恒压下,主反应的 随温度变化如图1所示,
随温度变化如图1所示,

(2)
 恒压下,
恒压下,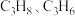 在不同温度下的平衡体积分数如图2所示,图中表示
在不同温度下的平衡体积分数如图2所示,图中表示 的体积分数的曲线为
的体积分数的曲线为 时,
时, 的体积分数为
的体积分数为
(3)下列关于
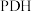 工艺说法正确的是
工艺说法正确的是A. 的物质的量分数不再改变,反应体系已达平衡 的物质的量分数不再改变,反应体系已达平衡 |
| B.采用合适的催化剂能提高主反应的平衡转化率,促使丙烯的产率提高 |
C.反应达到平衡后,增加压强,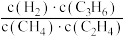 不变 不变 |
D.升高温度,生成 的速率加快,生成其他副产物的速率减慢 的速率加快,生成其他副产物的速率减慢 |
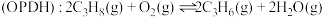
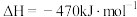 ,相比
,相比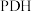 ,该途径生产丙烯的好处是
,该途径生产丙烯的好处是(5)用下图所示装置电解二氧化碳酸性溶液也可制得丙烯。

①Y极与电源
②X极的电极反应式为
③理论上,
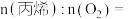
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐3】向某恒容密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1阶段的 c(B)变化未画出]。
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1阶段的 c(B)变化未画出]。
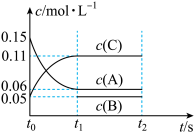
(1)若 t1=15 s,用 A 的浓度变化表示 t0~t1阶段的平均反应速率为_______ mol·L-1·s-1,t1时A的转化率为_______ 。
(2)由图可知t0时,加入B的物质的量为____ mol,若在t1时,将容器体积变为1 L,则此时c(A)=___ mol/L
(3)若在相同体积的容器中,加入0.14 mol B和0.3 mol C,在相同的条件下发生反应,达平衡后A的物质的量浓度为_____ mol/L。
(4)若在同条件,同体积容器中加入a mol A、0.08 mol B和0.18 mol C,平衡后A的物质的量浓度与(3)相同,则a=____
 B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1阶段的 c(B)变化未画出]。
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1阶段的 c(B)变化未画出]。
(1)若 t1=15 s,用 A 的浓度变化表示 t0~t1阶段的平均反应速率为
(2)由图可知t0时,加入B的物质的量为
(3)若在相同体积的容器中,加入0.14 mol B和0.3 mol C,在相同的条件下发生反应,达平衡后A的物质的量浓度为
(4)若在同条件,同体积容器中加入a mol A、0.08 mol B和0.18 mol C,平衡后A的物质的量浓度与(3)相同,则a=
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐1】实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为______________ ;该操作将I2还原为I-的目的是_____________ 。

(2)操作X的名称为___________ 。
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如右图所示)。实验控制在较低温度下进行的原因是_____________ ;锥形瓶里盛放的溶液为____________ 。
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。

①阳极的电极反应式为_________________ 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中还原剂与氧化剂的物质的量之比为___________________ 。

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为

(2)操作X的名称为
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如右图所示)。实验控制在较低温度下进行的原因是
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。

①阳极的电极反应式为
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中还原剂与氧化剂的物质的量之比为
您最近一年使用:0次



