名校
1 . 如图是元素周期表的一部分,A~J代表对应的元素,回答下列问题:
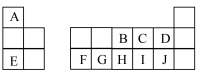
(1)F的元素符号为___________ ,元素C在周期表中的位置为___________ 。
(2)A、D和E三种元素的离子半径由大到小的顺序是___________ (用离子符号表示)。
(3)图中对应元素最高价氧化物的水化物中,碱性最强的是___________ (填化学式)。
(4)A、B和J三种元素形成常见化合物所含化学键的类型是___________ 。
(5)下列说法错误的是___________ (填标号)。
a.单质的熔点:
b.简单氢化物的沸点:
c.氧化物对应水化物的酸性:
(6)元素F的单质与元素E的最高价氧化物对应水化物反应的离子方程式为___________ 。

(1)F的元素符号为
(2)A、D和E三种元素的离子半径由大到小的顺序是
(3)图中对应元素最高价氧化物的水化物中,碱性最强的是
(4)A、B和J三种元素形成常见化合物所含化学键的类型是
(5)下列说法错误的是
a.单质的熔点:

b.简单氢化物的沸点:

c.氧化物对应水化物的酸性:

(6)元素F的单质与元素E的最高价氧化物对应水化物反应的离子方程式为
您最近一年使用:0次
2023-09-12更新
|
453次组卷
|
2卷引用:安徽省六安市城南中学2023年普通高中化学学业水平合格性考试化学模拟试卷
2 . 乙酸乙酯是一种有水果香味的油状液体,实验室通常用乙酸与乙醇在浓硫酸存在并加热的条件下反应生成乙酸乙酯。请回答:
(1)工业上常用乙烯水化法制备乙醇,乙烯的结构简式为____________ 。
(2)制备乙酸乙酯的化学方程式为__________________________ ,该反应的类型是_______ 反应。
(3)乙醇俗称酒精,是一种重要无污染的燃料和化工原料,乙醇的官能团为__________ (写名称)。
(1)工业上常用乙烯水化法制备乙醇,乙烯的结构简式为
(2)制备乙酸乙酯的化学方程式为
(3)乙醇俗称酒精,是一种重要无污染的燃料和化工原料,乙醇的官能团为
您最近一年使用:0次
名校
解题方法
3 . 下表为元素周期表的一部分,请回答下列问题:
(1)元素③在元素周期表中的位置是_____________________ 。
(2)元素④和⑤的最高价氧化物对应水化物酸性较强的是____________ (填化学式),元素①和④中,原子半径较大的是__________ (填元素符号)。
(3)元素②的氢氧化物能溶于元素①的氢氧化物所形成的的溶液中,离子方程式为:______________________________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
(1)元素③在元素周期表中的位置是
(2)元素④和⑤的最高价氧化物对应水化物酸性较强的是
(3)元素②的氢氧化物能溶于元素①的氢氧化物所形成的的溶液中,离子方程式为:
您最近一年使用:0次
名校
4 . 下表为元素周期表的一部分,请参照①∼ ⑥在表中的位置,用化学用语回答下列问题。

(1)元素①的原子结构示意图为_____
(2)元素②、③形成离子的半径_____ >_____ 。
(3)元素⑤、⑥形成的气态氢化物稳定性__________ >___________ 。
(4)元素④的最高价氧化物的水化物与元素③的最高价氧化物的水化物稀溶液反应的离子方程式为_____ 。

(1)元素①的原子结构示意图为
(2)元素②、③形成离子的半径
(3)元素⑤、⑥形成的气态氢化物稳定性
(4)元素④的最高价氧化物的水化物与元素③的最高价氧化物的水化物稀溶液反应的离子方程式为
您最近一年使用:0次
名校
5 . 已知纯水能发生微弱的电离,其电离方程式可表示为:2H2O H3O++OH-(H3O+通常简写为H+)。
H3O++OH-(H3O+通常简写为H+)。
在水中发生的反应举例:
NaOH+HCl==NaCl+H2O,
Na2O+2HCl==2NaCl+H2O。
(1)液态氨(NH3)与纯水相似,其电离方程式可表示为_________________ 。
(2)写出下列物质在液态氨中发生反应的化学方程式:
①NaNH2+NH4Cl—_______________ ;
②K3N+(NH4)2SO4—_____________ 。
 H3O++OH-(H3O+通常简写为H+)。
H3O++OH-(H3O+通常简写为H+)。在水中发生的反应举例:
NaOH+HCl==NaCl+H2O,
Na2O+2HCl==2NaCl+H2O。
(1)液态氨(NH3)与纯水相似,其电离方程式可表示为
(2)写出下列物质在液态氨中发生反应的化学方程式:
①NaNH2+NH4Cl—
②K3N+(NH4)2SO4—
您最近一年使用:0次
6 . 卤族元素是典型的非金属元素,卤素单质及其化合物在工农业生产和生活中都有重要的用途。
(1)同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最大的是________ 。
(2)不同卤素原子之间可形成卤素互化物,如IBr、BrI3、BrF5、IF,等。卤素互化物中的化学键类型是______ (填标号)。
(3)BeCl2的分子空间构型为__________ ;BF3分子中B-F键的键角为_____________ 。
(4)CCl4分子中的C原子和NF3分子中的N原子的杂化方式是否相同?____________ 。如果相同,则其杂化方式为 ___________ ;如果不相同,则其杂化方式分别为 ______________ 。(后两个空只能填一个,若两空都填,则不给分)
(5)HF的相对分子质量小于HCl,但其沸点却高于HCl,其原因是________________
(6)由F、Mg、K三种元素形成的某种晶体的晶胞结构如下图所示,晶胞边长为anm,该晶体的化学式为_________________________ ;列式计算该晶体的密度(g.cm-3)
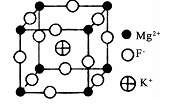
(1)同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最大的是
(2)不同卤素原子之间可形成卤素互化物,如IBr、BrI3、BrF5、IF,等。卤素互化物中的化学键类型是
| A.极性键 | B.非极性键 | C.离子键 | D.σ键 |
(3)BeCl2的分子空间构型为
(4)CCl4分子中的C原子和NF3分子中的N原子的杂化方式是否相同?
(5)HF的相对分子质量小于HCl,但其沸点却高于HCl,其原因是
(6)由F、Mg、K三种元素形成的某种晶体的晶胞结构如下图所示,晶胞边长为anm,该晶体的化学式为

您最近一年使用:0次
7 . 2015年9月20日“长征六号”运载火箭成功将20颗微小卫星送入太空,创造了中国航天一箭多星的新纪录。“长征六号”运载火箭采用无毒环保的过氧化氢一煤油为推进剂。
(1)石油经过________ 可获得汽油、煤油、柴油、重油等,通过将重油_______ 可获得更多的汽油、煤油等轻质油。
(2)煤油中的主要组成元素是________ (填元素符号)。
(3)在H2O2水溶液中加入少量MnO2粉末时迅速产生大量气泡,该气体能使带火星的木条复燃,该反应中,还原产物是____________ (填化学式),每产生1mol气体时转移电子的物质的量为__________ 。
(4)H2O2不稳定,下列各表为在不同条件下1h内H2O2的分解率(均以质量分数为30%的H2O2溶液开始实验):
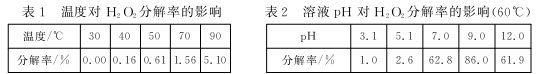
①在60℃、pH=3.1条件下,H2O2的分解速率为__________ mol/(L·min)(已知30%的H2O2溶液的密度为1.11 g/cm3,反应过程中溶液体积变化忽略不计,计算结果保留两位有效数字)。
②结合表中的规律,推测H2O2在下列条件下分解速率依次增大的顺序为_____________ (填标号)。
a.30℃、pH =13.0,H2O2溶液的质量分数为30%
b.70℃、pH=9.0,H2O2溶液的质量分数为30%
c.70℃、pH =13.0,H2O2溶液的质量分数为30%
(1)石油经过
(2)煤油中的主要组成元素是
(3)在H2O2水溶液中加入少量MnO2粉末时迅速产生大量气泡,该气体能使带火星的木条复燃,该反应中,还原产物是
(4)H2O2不稳定,下列各表为在不同条件下1h内H2O2的分解率(均以质量分数为30%的H2O2溶液开始实验):

①在60℃、pH=3.1条件下,H2O2的分解速率为
②结合表中的规律,推测H2O2在下列条件下分解速率依次增大的顺序为
a.30℃、pH =13.0,H2O2溶液的质量分数为30%
b.70℃、pH=9.0,H2O2溶液的质量分数为30%
c.70℃、pH =13.0,H2O2溶液的质量分数为30%
您最近一年使用:0次
8 . 硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯。从该回收料中回收硒的工艺流程如下图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2):
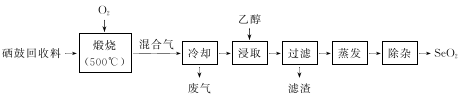
部分物质的物理性质如下表:
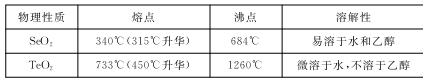
回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第_________ 周期,第______ 族;H2 SeO4的酸性比H2SO4的酸性 ______________ (填“强”或“弱”)。
(2)实验中往往需将硒鼓回收料粉碎,其目的是_________
(3)乙醇浸取后过滤所得滤渣的主要成分是_____________ 。蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是______________________ 。
(4)以SO2为还原剂可将SeO2还原为单质硒,写出反应的化学方程式:________________________

部分物质的物理性质如下表:

回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第
(2)实验中往往需将硒鼓回收料粉碎,其目的是
(3)乙醇浸取后过滤所得滤渣的主要成分是
(4)以SO2为还原剂可将SeO2还原为单质硒,写出反应的化学方程式:
您最近一年使用:0次
2010高二·安徽铜陵·学业考试
9 . 化学式为 C2H6O 的有机物能与钠反应,它的名称是_________ ;俗名是______________ 。
您最近一年使用:0次
2010高二·安徽铜陵·学业考试
解题方法
10 . (1)配平下列化学方程式(将系数填在横线上),并写出还原剂。
___ NH3+___ O2= ___ N2+ ___ H2O,该反应中的还原剂是_______ 。
⑵铁和稀硝酸反应,若反应后铁无剩余,则生成的盐可能是__________ 或____________ 或_________ ;若反应后硝酸有剩余,则生成的盐是___________ ;该反应的化学方程式为:_______________ 。
⑵铁和稀硝酸反应,若反应后铁无剩余,则生成的盐可能是
您最近一年使用:0次



