13-14高一·全国·课时练习
1 . 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2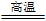 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________ (填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________ (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是_____________________________________________________ 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为________ 。证明炉渣中含有FeO的实验现象为_______________________ 。
(1)冶炼铜的反应为8CuFeS2+21O2
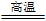 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为
您最近一年使用:0次
2018-06-27更新
|
224次组卷
|
4卷引用:【全国市级联考】贵州省毕节市2017-2018学年高一毕业学业达标模拟考试化学试题
【全国市级联考】贵州省毕节市2017-2018学年高一毕业学业达标模拟考试化学试题(已下线)2014年高一化学人教版必修二 4-1-1金属矿物的开发利用练习卷苏教版高中化学必修2专题四《化学科学与人类文明》测试卷苏教版高一化学必修2专题4《化学科学与人类文明》测试卷
解题方法
2 . 根据1~20号元素原子的核外电子排布的特点,确定元素的种类。
(1)最外层电子数等于次外层电子数的一半的元素是____________ 。
(2)最外层电子数等于次外层电子数的元素是____________ 。
(3)最外层电子数等于次外层电子数的2倍的元素是____________ 。
(4)最外层电子数等于次外层电子数的3倍的元素是____________ 。
(5)最外层电子数等于次外层电子数的4倍的元素是____________ 。
(6)最外层电子数等于电子层数的元素是__________ 。
(7)最外层有1个电子的元素是____________ 。
(8)最外层有2个电子的元素是____________ 。
(9)内层电子数之和是最外层电子数2倍的元素是____________ 。
(10)电子总数为最外层电子数2倍的元素是____________ 。
(1)最外层电子数等于次外层电子数的一半的元素是
(2)最外层电子数等于次外层电子数的元素是
(3)最外层电子数等于次外层电子数的2倍的元素是
(4)最外层电子数等于次外层电子数的3倍的元素是
(5)最外层电子数等于次外层电子数的4倍的元素是
(6)最外层电子数等于电子层数的元素是
(7)最外层有1个电子的元素是
(8)最外层有2个电子的元素是
(9)内层电子数之和是最外层电子数2倍的元素是
(10)电子总数为最外层电子数2倍的元素是
您最近一年使用:0次
3 . 粗铜精炼后的阳极泥含有Cu、Au(金)、Pb和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
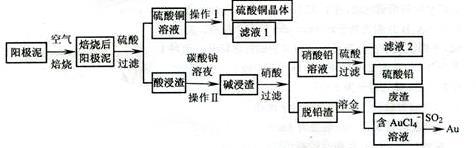
(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有:______________ 和Cu-2e一=Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是______ ,焙烧后的阳极泥中除含金、PbSO4外,还有______________ (填化学式)。
(3)操作I的主要步骤为_____________ 过滤、洗涤、干燥,操作II的名称是____________________ 。
(4)写出用SO2还原AuCl4一的离子方程式______________________ 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液l并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法_____________________ 。
(6)已知常温时,Ksp(PbCO3)=l.46×l0-13,Ksp(PbSO4)= 1.82×l0-8,用离子方程式表示加入碳酸钠溶液的作用____________________________ 。

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有:
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是
(3)操作I的主要步骤为
(4)写出用SO2还原AuCl4一的离子方程式
(5)为了减少废液排放、充分利用有用资源,工业上将滤液l并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法
(6)已知常温时,Ksp(PbCO3)=l.46×l0-13,Ksp(PbSO4)= 1.82×l0-8,用离子方程式表示加入碳酸钠溶液的作用
您最近一年使用:0次
2016-12-09更新
|
116次组卷
|
2卷引用:2016届贵州省遵义市高三上学期第一次联考化学试卷
4 . 铁及其化合物与生产、生活关系密切,请回答下列问题:
(1)印刷电路板是有高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。请你写出该反应的离子方程式:__ __。
(2)工业上可用废铁屑制铁红(Fe2O3),生产中首先用废铁屑与HNO3反应制Fe(NO3)2。写出稀HNO3与过量Fe反应的离子方程式:___ _;从“绿色化学”思想看制备Fe(NO3)2应用浓HNO3还是稀HNO3?并说明理由:_________________________
(3)高铁酸盐(FeO42-)是一种新型净水剂,既能净水又能杀菌。请运用所学知识推测高铁酸盐(FeO42-)能用于自来水杀菌消毒的原因: 。制备它的一种方法是用Fe2(SO4)3和NaClO在强碱性溶液中反应,写出反应的离子方程式:__ 。
(4)在一定体积的含有Al3+、Fe3+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应),产生沉淀的物质的量与所加溶液的体积的关系如图所示

①写出(a+10)到(a+20)过程中反应的离子方程式:___________________
②NaOH和Na2SO4的混合溶液中c(NaOH) c(Na2SO4)(填>、<或=)
③上述含Al3+、Fe3+、Ba2+的混合溶液中n(Al3+)= mol
(1)印刷电路板是有高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。请你写出该反应的离子方程式:__ __。
(2)工业上可用废铁屑制铁红(Fe2O3),生产中首先用废铁屑与HNO3反应制Fe(NO3)2。写出稀HNO3与过量Fe反应的离子方程式:___ _;从“绿色化学”思想看制备Fe(NO3)2应用浓HNO3还是稀HNO3?并说明理由:_________________________
(3)高铁酸盐(FeO42-)是一种新型净水剂,既能净水又能杀菌。请运用所学知识推测高铁酸盐(FeO42-)能用于自来水杀菌消毒的原因: 。制备它的一种方法是用Fe2(SO4)3和NaClO在强碱性溶液中反应,写出反应的离子方程式:__ 。
(4)在一定体积的含有Al3+、Fe3+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应),产生沉淀的物质的量与所加溶液的体积的关系如图所示

①写出(a+10)到(a+20)过程中反应的离子方程式:___________________
②NaOH和Na2SO4的混合溶液中c(NaOH) c(Na2SO4)(填>、<或=)
③上述含Al3+、Fe3+、Ba2+的混合溶液中n(Al3+)= mol
您最近一年使用:0次
5 . 【物质结构与性质】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材 料。回答下列问题:
(1)基态铜原子的电子排布式为__________ ;已知高温下CuO—→Cu2O+O2,试从铜原子价层电子结构变化角度解释这一反应发生的原因:__________________________ 。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为___________ ,若“Si-H”中键合电子偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为__________________ 。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3.NH3,BF3.NH3中B原子的杂化轨道类型为_______________ ,B与N之间形成 _____________ 键。
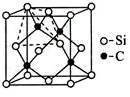
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为_________ ,在SiC中,每个C原子周围最近的C原子数目为___________ ,若晶胞的边长为a pm,则金刚砂的密度为_______ 。
(1)基态铜原子的电子排布式为
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3.NH3,BF3.NH3中B原子的杂化轨道类型为
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为

您最近一年使用:0次
6 . 在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:
X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
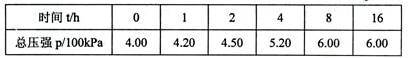
回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H_______ 0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是________________ 。
A.缩小容器容积
B.及时分离出Y、Z
C.使用合理的催化剂
D.升高体系温度
(3)计算平衡时X的转化率为__________ ,该温度下反应的平衡常数值为:______________ 。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__________ mol,n(X)=_______ mol,反应物X的转化率a(X)的表达式为_____________ 。
X(g)
 Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是
A.缩小容器容积
B.及时分离出Y、Z
C.使用合理的催化剂
D.升高体系温度
(3)计算平衡时X的转化率为
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=
您最近一年使用:0次
2016-12-09更新
|
260次组卷
|
3卷引用:2016届贵州省遵义市高三上学期第一次联考化学试卷
12-13高二下·甘肃兰州·期末
7 . 化合物A(C12H16O3)经碱性水解、酸化后得到B和C(C8H8O2)。C的核磁共振氢谱表明含有苯环,且苯环上有2种氢原子。B经过下列反应后得到G,G由碳、氢、氧三种元素组成,相对分子质量为172,元素分析表明,含碳55.8 %,含氢7.0 %,核磁共振氢谱显示只有一个峰。
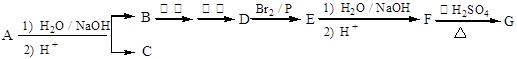
已知:
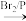
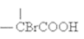
请回答下列问题:
(1)写出G的分子式:_______ 。
(2)写出A的结构简式:_______ 。
(3)写出F→G反应的化学方程式:_______ ,该反应属于_______ (填反应类型)。
(4)写出满足下列条件的C的所有同分异构体:_______ 。
①是苯的对位二取代化合物;
②能与FeCl3溶液发生显色反应;
③不考虑烯醇(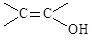 )结构。
)结构。
(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式(仅要求写出1种):_______ 。
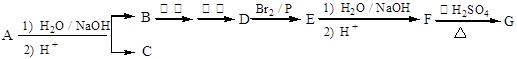
已知:

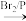
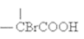
请回答下列问题:
(1)写出G的分子式:
(2)写出A的结构简式:
(3)写出F→G反应的化学方程式:
(4)写出满足下列条件的C的所有同分异构体:
①是苯的对位二取代化合物;
②能与FeCl3溶液发生显色反应;
③不考虑烯醇(
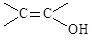 )结构。
)结构。(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式(仅要求写出1种):
您最近一年使用:0次
2016-12-08更新
|
807次组卷
|
3卷引用:2016届贵州省遵义市高三上学期第一次联考化学试卷



