1 . 向8 gCuO粉末中加入100 g稀H2SO4恰好完全反应。
(1)生成CuSO4的质量___________ 。
(2)稀H2SO4中溶质的质量分数___________ 。
(1)生成CuSO4的质量
(2)稀H2SO4中溶质的质量分数
您最近一年使用:0次
2 . 根据下列装置,回答问题:___________ 。
(2)实验室常用___________ (填药品名称)来制取二氧化碳气体,发生反应的化学方程式为___________ ;其发生装置可用A或B,与A装置相比,B装置的优点是___________ 。
(3)若用C装置加热高锰酸钾制取氧气,发生反应的化学方程式为___________ 。
(4)若用活泼金属单质和稀盐酸反应制取纯净、干燥的H2,请从这些装置中选择并连接成一套组合装置,按照气流从左到右的流向,写出所选装置接口的连接顺序:b→___________ 。
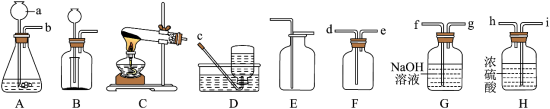
(2)实验室常用
(3)若用C装置加热高锰酸钾制取氧气,发生反应的化学方程式为
(4)若用活泼金属单质和稀盐酸反应制取纯净、干燥的H2,请从这些装置中选择并连接成一套组合装置,按照气流从左到右的流向,写出所选装置接口的连接顺序:b→
您最近一年使用:0次
3 . 根据所学知识填空:
(1)甲烷、乙醇都是生活中常用的燃料。植物的残体在隔绝空气的情况下就会产生甲烷;而乙醇主要靠人类利用高粱、玉米和薯类发酵等方法制造。据报道,科学家已经找到利用甲烷与其他物质反应制造乙醇的新途径。
①甲烷和乙醇都属于___________ (填“混合物”或“化合物”);
②乙醇的化学式为___________ ;
③乙醇完全燃烧的化学方程式为___________ 。
(2)许多家庭做饭用罐装的“煤气”作燃料,罐中所装的是液化石油气,它是石油化工的一种产品。石油属于___________ 能源(填“可再生”或“不可再生”); 若厨房失火时,要移走“煤气罐”,这是利用了___________ 原理灭火。
(3)当今社会,随着汽车用量的急剧增加,能源和环保问题日趋严峻,研究以太阳能、氢能等新型能源为动力的汽车迫在眉睫。氢燃料汽车使用过程中发生反应的化学方程式为___________ 。
(1)甲烷、乙醇都是生活中常用的燃料。植物的残体在隔绝空气的情况下就会产生甲烷;而乙醇主要靠人类利用高粱、玉米和薯类发酵等方法制造。据报道,科学家已经找到利用甲烷与其他物质反应制造乙醇的新途径。
①甲烷和乙醇都属于
②乙醇的化学式为
③乙醇完全燃烧的化学方程式为
(2)许多家庭做饭用罐装的“煤气”作燃料,罐中所装的是液化石油气,它是石油化工的一种产品。石油属于
(3)当今社会,随着汽车用量的急剧增加,能源和环保问题日趋严峻,研究以太阳能、氢能等新型能源为动力的汽车迫在眉睫。氢燃料汽车使用过程中发生反应的化学方程式为
您最近一年使用:0次
4 . 卤素化合物在生产生活中应用广泛,回答下列问题
(1)研究表明 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: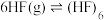 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是____________ ;在测定 相对分子质量的实验中,
相对分子质量的实验中,____________ (填“低压”或“高压”)有利于测定的准确性.
(2) 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为__________ ;产物中的另一种气体可以起到的作用是________________ .
(3) 与
与 以共价键形成
以共价键形成 ,其中
,其中________ 显负电性, 与水反应的方程式是
与水反应的方程式是____________ .
(4)利用 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: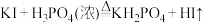 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:________ (“强酸性”“强氧化性”“高沸点”).
(1)研究表明
 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: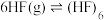 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是 相对分子质量的实验中,
相对分子质量的实验中,(2)
 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为(3)
 与
与 以共价键形成
以共价键形成 ,其中
,其中 与水反应的方程式是
与水反应的方程式是(4)利用
 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:
您最近一年使用:0次
解题方法
5 . 钛白粉(纳米级TiO2)广泛用作功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料,是白色颜料中着色力最强的一种,具有优良的遮盖力和着色牢度,适用于不透明的白色制品。以钛铁矿(主要成分为FeTiO3、MgO)为原料制备高纯度钛白粉,同时得到绿矾的工艺流程如图1。
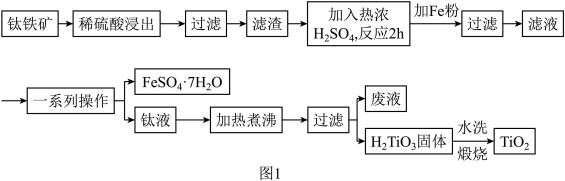
已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)稀硫酸浸出的目的是___________ 。
(2)图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是___________ 和___________ ,原因为___________ 。

(3)若用浓硫酸浸出后Ti元素的存在形式为 ,则浓硫酸与FeTiO3反应的化学方程式为
,则浓硫酸与FeTiO3反应的化学方程式为___________ 。
(4)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是___________ ,过滤时用到的玻璃仪器有玻璃棒、___________ 。
(5)将钛液加热煮沸的目的是___________ 。
(6)若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为___________ kg。

已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)稀硫酸浸出的目的是
(2)图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是

(3)若用浓硫酸浸出后Ti元素的存在形式为
 ,则浓硫酸与FeTiO3反应的化学方程式为
,则浓硫酸与FeTiO3反应的化学方程式为(4)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是
(5)将钛液加热煮沸的目的是
(6)若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为
您最近一年使用:0次
6 . CO2的资源化利用和转化技术的研究对实现碳达峰和碳中和有重要意义。
(1)在席夫碱(含“−RC=N−”有机物)修饰的纳米金催化剂上,CO2直接催化加氢生成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。

该历程中起决速步骤的化学方程式是___________ 。
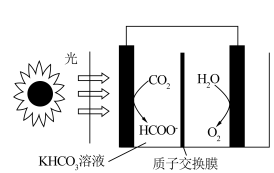
(2)我国科学家以Si/Bi材料作光电阴极。CO2饱和的0.5 mol ·L-1的KHCO3溶液作电解液(pH =7.4) ,将CO2转化为HCOO-,原理如图所示。根据图示,写出光电阴极的电极反应式:___________ 。
(3)CO2与H2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:CO2(g) +3H2(g) CH3OH(g) +H2O(g) ΔH1
CH3OH(g) +H2O(g) ΔH1
反应2:CO2(g) +H2(g) CO(g) +H2O(g) ΔH2
CO(g) +H2O(g) ΔH2
①已知:在一定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。下表为几种物质在298 K的标准摩尔生成焓:
则ΔH1 = ___________ 。
②若起始按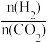 =3投料,测得CO2的平衡转化率(X - CO2)和CH3OH的选择性(S – CH3OH)随温度、压强的变化如图所示[已知:S –CH3OH =
=3投料,测得CO2的平衡转化率(X - CO2)和CH3OH的选择性(S – CH3OH)随温度、压强的变化如图所示[已知:S –CH3OH =
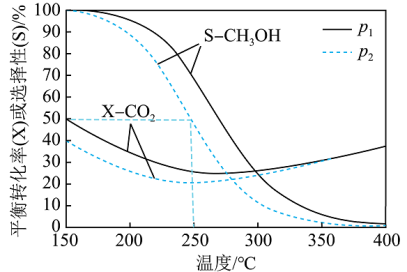
i.p1___________ (填 “>”或“<”)p2。
ii.温度高于350°C后,在压强p1和p2下,CO2的平衡转化率几乎交于一点的原因是________ 。
iii.250 °C时反应2的压强平衡常数Kp=___________ ( 结果保留2位有效数字)。
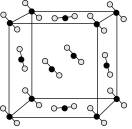
(4)一定条件下,CO2可形成干冰,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有___________ 个。若晶胞参数是a nm,干冰的密度为ρg· cm-3,则阿伏加德罗常数为___________ (用含a 、ρ的代数式表示)。
(1)在席夫碱(含“−RC=N−”有机物)修饰的纳米金催化剂上,CO2直接催化加氢生成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。

该历程中起决速步骤的化学方程式是
(2)我国科学家以Si/Bi材料作光电阴极。CO2饱和的0.5 mol ·L-1的KHCO3溶液作电解液(pH =7.4) ,将CO2转化为HCOO-,原理如图所示。根据图示,写出光电阴极的电极反应式:

(3)CO2与H2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) ΔH1
CH3OH(g) +H2O(g) ΔH1反应2:CO2(g) +H2(g)
 CO(g) +H2O(g) ΔH2
CO(g) +H2O(g) ΔH2①已知:在一定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。下表为几种物质在298 K的标准摩尔生成焓:
| 物质 | CO2(g) | CH3OH(g) | H2O(g) | H2(g) |
| 标准摩尔生成焓/(kJ ·mol -1) | −393.51 | −201.17 | −241. 82 | 0 |
②若起始按
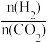 =3投料,测得CO2的平衡转化率(X - CO2)和CH3OH的选择性(S – CH3OH)随温度、压强的变化如图所示[已知:S –CH3OH =
=3投料,测得CO2的平衡转化率(X - CO2)和CH3OH的选择性(S – CH3OH)随温度、压强的变化如图所示[已知:S –CH3OH =

i.p1
ii.温度高于350°C后,在压强p1和p2下,CO2的平衡转化率几乎交于一点的原因是
iii.250 °C时反应2的压强平衡常数Kp=
(4)一定条件下,CO2可形成干冰,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有

您最近一年使用:0次
名校
7 . 胆矾(CuSO4·5H2O)又名蓝矾,是化学工业、医药领域中的常见物质。某实验小组利用有色金属加工企业的废材制得粗胆矾晶体。
(1)制得的粗晶体中可能含有Fe2(SO4)3、FeCl3 杂质,选用下列试剂,确定所含杂质。可选试剂有:蒸馏水、稀硫酸、氨水、Ba(NO3)2 溶液、BaCl2 溶液、AgNO3 溶液。请补充以下实验步骤:
①取一定量样品,加入蒸馏水、稀硫酸,固体溶解,得到蓝色透明溶液;
②取少量①所得溶液,滴加_______ 至过量,先析出沉淀,后沉淀部分溶解,过滤得深蓝色溶液,滤渣为红褐色;
③另取少量①所得溶液,加入足量的_______ 溶液,出现白色沉淀;
④取③中所得上层清液,加入_______ 溶液,无明显现象。
实验结论:粗胆矾晶体中含有Fe2(SO4)3,不含FeCl3。
(2)CuSO4·5H2O的含量测定:
①称取1.250g产品配成100 mL溶液,取25.00 mL溶液于锥形瓶中,加入足量NaF溶液后,再滴加KI溶液至不再产生CuI沉淀;
②以淀粉溶液作为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定,平行滴定3次。已知:Fe3++6F-=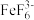 ;I2+2Na2S2O3=2NaI+Na2S4O6
;I2+2Na2S2O3=2NaI+Na2S4O6
请回答:步骤①中,加入足量NaF溶液的可能原因是_______ ,若不加NaF溶液,可导致最终的测量值_______ (填 “偏大”“偏小”或“无影响”)。滴加KI溶液生成沉淀的离子方程式为_______ ; 若Na2S2O3标准溶液的平均用量为10.00 mL,则产品中胆矾的质量分数为_______ 。
(1)制得的粗晶体中可能含有Fe2(SO4)3、FeCl3 杂质,选用下列试剂,确定所含杂质。可选试剂有:蒸馏水、稀硫酸、氨水、Ba(NO3)2 溶液、BaCl2 溶液、AgNO3 溶液。请补充以下实验步骤:
①取一定量样品,加入蒸馏水、稀硫酸,固体溶解,得到蓝色透明溶液;
②取少量①所得溶液,滴加
③另取少量①所得溶液,加入足量的
④取③中所得上层清液,加入
实验结论:粗胆矾晶体中含有Fe2(SO4)3,不含FeCl3。
(2)CuSO4·5H2O的含量测定:
①称取1.250g产品配成100 mL溶液,取25.00 mL溶液于锥形瓶中,加入足量NaF溶液后,再滴加KI溶液至不再产生CuI沉淀;
②以淀粉溶液作为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定,平行滴定3次。已知:Fe3++6F-=
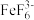 ;I2+2Na2S2O3=2NaI+Na2S4O6
;I2+2Na2S2O3=2NaI+Na2S4O6请回答:步骤①中,加入足量NaF溶液的可能原因是
您最近一年使用:0次
8 . 高炉炼铁是重要的工业过程,冶炼过程中涉及如下反应:
①FeO(s)+CO(g) Fe(s)+CO2(g) ΔH1 =-11kJ/mol
Fe(s)+CO2(g) ΔH1 =-11kJ/mol
②FeO(s)+C(s) Fe(s)+CO(g) ΔH2=+161.5kJ/mol
Fe(s)+CO(g) ΔH2=+161.5kJ/mol
③C(s)+CO2(g) 2CO(g)
2CO(g)
(1)反应③的ΔH=___________ kJ/mol。
(2)在恒温恒容密闭容器中投入足量石墨与CO2进行反应③,可判定其达到平衡的条件有___________(填序号)。
(3)反应②的压力平衡常数表达式Kp2=___________ 。
(4)恒容密闭容器中加入足量C、FeO,进行上述反应。改变温度,测得平衡时容器总压的对数lg(p总/kPa)、各气体的物质的量分数x(CO)、x(CO2)的变化如图所示:
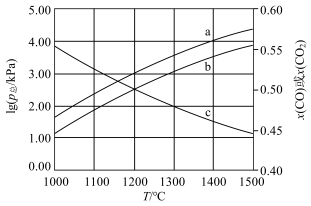
①x( CO)对应的曲线是___________ (填序号),判断依据是___________ 。
②在1200℃下进行上述反应,平衡时CO2分压为___________ kPa,反应①在此温度下的压力平衡常数Kp1 =___________ 。
(5)高炉炼铁过程中会生成“渗碳体”Fe3C (相对分子质量为M),晶胞为长方体 (如图),晶胞参数为a pm, b pm, c pm,阿伏加德罗常数为NA,则其密度为___________ g/cm3(用含M、a、b、c、NA的式子表示)。

①FeO(s)+CO(g)
 Fe(s)+CO2(g) ΔH1 =-11kJ/mol
Fe(s)+CO2(g) ΔH1 =-11kJ/mol②FeO(s)+C(s)
 Fe(s)+CO(g) ΔH2=+161.5kJ/mol
Fe(s)+CO(g) ΔH2=+161.5kJ/mol③C(s)+CO2(g)
 2CO(g)
2CO(g)(1)反应③的ΔH=
(2)在恒温恒容密闭容器中投入足量石墨与CO2进行反应③,可判定其达到平衡的条件有___________(填序号)。
| A.容器总压保持不变 |
| B.石墨断开3mol碳碳σ键的同时,CO断开2mol碳氧三键 |
| C.CO的体积分数保持不变 |
D.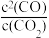 保持不变 保持不变 |
(4)恒容密闭容器中加入足量C、FeO,进行上述反应。改变温度,测得平衡时容器总压的对数lg(p总/kPa)、各气体的物质的量分数x(CO)、x(CO2)的变化如图所示:

①x( CO)对应的曲线是
②在1200℃下进行上述反应,平衡时CO2分压为
(5)高炉炼铁过程中会生成“渗碳体”Fe3C (相对分子质量为M),晶胞为长方体 (如图),晶胞参数为a pm, b pm, c pm,阿伏加德罗常数为NA,则其密度为

您最近一年使用:0次
解题方法
9 . 我国力争2030年前实现碳达峰,2060 年前实现碳中和。CO2 的综合利用是实现碳中和的措施之一。
Ⅰ. CO2和CH4在催化剂表面可以合成CH3COOH,该反应的历程和相对能量的变化情况如下图所示(*指微粒吸附在催化剂表面,H*指H吸附在催化剂载体上的氧原子上,TS表示过渡态):
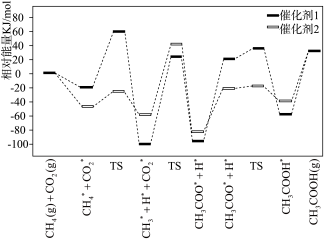
(1)决定该过程的总反应速率的基元反应方程式为___________ 。
(2)下列说法正确的有___________ 。
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b. CH3COOH* 比CH3COOH(g)能量高
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
Ⅱ. CO2和 H2在一定条件下也可以合成甲醇,该过程存在副反应ii。
反应i: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1
CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1
反应ii: CO2(g) + H2(g CO(g)+ H2O(g) ΔH2
CO(g)+ H2O(g) ΔH2
(3)有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH2=___________ kJ·mol-1

(4)恒温恒容条件下,仅发生反应ii,反应达到平衡的标志是___________ 。
a. CO的分压不再发生变化
b.气体平均相对分子质量不再发生变化
c. 气体密度不再发生变化
d.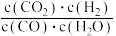 比值不再发生变化
比值不再发生变化
(5)在5.0MPa,将n(CO2) : n(H2)=5 : 16的混合气体在催化剂作用下进行反应。体系中气体平衡组成比例(CO和CH3OH在含碳产物中物质的量百分数)及CO2的转化率随温度的变化如图所示。
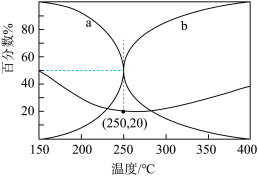
①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是___________ (填“a”或“b”)。
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是___________ 。
③250℃时反应i: CO2(g)+3H2(g) CH3OH(g)+H2O(g)的 Kp=
CH3OH(g)+H2O(g)的 Kp=___________ (MPa)-2(用最简分数表示)。
Ⅰ. CO2和CH4在催化剂表面可以合成CH3COOH,该反应的历程和相对能量的变化情况如下图所示(*指微粒吸附在催化剂表面,H*指H吸附在催化剂载体上的氧原子上,TS表示过渡态):

(1)决定该过程的总反应速率的基元反应方程式为
(2)下列说法正确的有
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b. CH3COOH* 比CH3COOH(g)能量高
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
Ⅱ. CO2和 H2在一定条件下也可以合成甲醇,该过程存在副反应ii。
反应i: CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1
CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1反应ii: CO2(g) + H2(g
 CO(g)+ H2O(g) ΔH2
CO(g)+ H2O(g) ΔH2(3)有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH2=

(4)恒温恒容条件下,仅发生反应ii,反应达到平衡的标志是
a. CO的分压不再发生变化
b.气体平均相对分子质量不再发生变化
c. 气体密度不再发生变化
d.
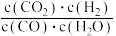 比值不再发生变化
比值不再发生变化(5)在5.0MPa,将n(CO2) : n(H2)=5 : 16的混合气体在催化剂作用下进行反应。体系中气体平衡组成比例(CO和CH3OH在含碳产物中物质的量百分数)及CO2的转化率随温度的变化如图所示。

①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是
③250℃时反应i: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的 Kp=
CH3OH(g)+H2O(g)的 Kp=
您最近一年使用:0次
10 . 自然界中存在如下氮的转化:
i.2NO2(g)+2OH-(aq)= (aq)+NO2(aq)+H2O(1)
(aq)+NO2(aq)+H2O(1)
ii.N2(g)+3H2(g)=2NH3(g)
(1) 的空间结构为
的空间结构为_______ 。
(2)ZnO是氮的氧化物的重要吸附剂,已知ZnO晶胞参数为cpm,则该晶胞中,O2-能够构成_______ 个最小正八面体,O2-与Zn2+核间最短距离为_______ pm。

(3)反应ii正反应的活化能为335kJ/mol,逆反应的活化能为427kJ/mol,则反应ii的ΔH=_______ 。
(4)一定条件下,在2L的刚性容器中充入1mol N2(g)、3mol H2(g)发生反应ii至平衡,下列图示表述正确的有_______
(5)反应ii,若起始时n(N2):n(H2)=1:3,在不同条件下达到平衡,设平衡时NH3的体积分数为x(NH3),实验测得400℃下,x(NH3)~p及5 ×103Pa下,x(NH3)~t存在如图曲线关系。
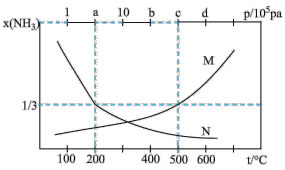
①图中对应等压过程的曲线是_______ (填“M”或“N”),判断依据是_______ 。
②x= 时,N2的转化率为
时,N2的转化率为_______ ,此时反应条件为_______ 或_______ 。
i.2NO2(g)+2OH-(aq)=
 (aq)+NO2(aq)+H2O(1)
(aq)+NO2(aq)+H2O(1) ii.N2(g)+3H2(g)=2NH3(g)
(1)
 的空间结构为
的空间结构为(2)ZnO是氮的氧化物的重要吸附剂,已知ZnO晶胞参数为cpm,则该晶胞中,O2-能够构成

(3)反应ii正反应的活化能为335kJ/mol,逆反应的活化能为427kJ/mol,则反应ii的ΔH=
(4)一定条件下,在2L的刚性容器中充入1mol N2(g)、3mol H2(g)发生反应ii至平衡,下列图示表述正确的有_______
A.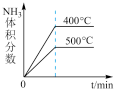 | B.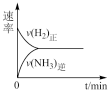 | C. | D. |

①图中对应等压过程的曲线是
②x=
 时,N2的转化率为
时,N2的转化率为
您最近一年使用:0次



