名校
1 . 三氯化氮是一种黄色油状液体,可用于漂白和杀菌。已知: 熔点为-40℃,沸点为70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用
熔点为-40℃,沸点为70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用 和
和 溶液反应制取
溶液反应制取 ,所用仪器如图所示(忽略部分夹持装置):
,所用仪器如图所示(忽略部分夹持装置):

回答下列问题:
(1)图D中仪器名称为_______ ;药品X为_______ ;A中反应的离子方程式为_______ ;根据气流方向,各仪器的连接顺序为_______ (用各接口字母表示,各接口所需橡胶塞已省略)。
(2)待观察到_______ 的现象,用止水夹夹住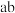 间的橡胶管,控制水浴加热的温度范围为
间的橡胶管,控制水浴加热的温度范围为_______ ,将产品 蒸出。
蒸出。
(3)纯度测定: 的制取是可逆反应,根据反应
的制取是可逆反应,根据反应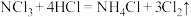 ,利用间接碘量法测定氯气的量即可测定
,利用间接碘量法测定氯气的量即可测定 的纯度。
的纯度。
实验步骤:
ⅰ.准确称量C中的产物0.5g置于三颈烧瓶中,加入10 足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ.将混合气通入200 0.1
0.1
 溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取25.00 吸收液,加入淀粉指示剂,用0.1
吸收液,加入淀粉指示剂,用0.1
 标准液进行滴定,滴定至终点时消耗
标准液进行滴定,滴定至终点时消耗 溶液18.00
溶液18.00 。(已知:反应原理为
。(已知:反应原理为 )
)
①确定滴定终点的现象为_______ 。
② 的纯度为
的纯度为_______ 。(保留三位有效数字)
 熔点为-40℃,沸点为70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用
熔点为-40℃,沸点为70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用 和
和 溶液反应制取
溶液反应制取 ,所用仪器如图所示(忽略部分夹持装置):
,所用仪器如图所示(忽略部分夹持装置):
回答下列问题:
(1)图D中仪器名称为
(2)待观察到
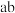 间的橡胶管,控制水浴加热的温度范围为
间的橡胶管,控制水浴加热的温度范围为 蒸出。
蒸出。(3)纯度测定:
 的制取是可逆反应,根据反应
的制取是可逆反应,根据反应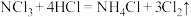 ,利用间接碘量法测定氯气的量即可测定
,利用间接碘量法测定氯气的量即可测定 的纯度。
的纯度。实验步骤:
ⅰ.准确称量C中的产物0.5g置于三颈烧瓶中,加入10
 足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;ⅱ.将混合气通入200
 0.1
0.1
 溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);ⅲ.量取25.00
 吸收液,加入淀粉指示剂,用0.1
吸收液,加入淀粉指示剂,用0.1
 标准液进行滴定,滴定至终点时消耗
标准液进行滴定,滴定至终点时消耗 溶液18.00
溶液18.00 。(已知:反应原理为
。(已知:反应原理为 )
)①确定滴定终点的现象为
②
 的纯度为
的纯度为
您最近一年使用:0次
解题方法
2 . 分类是认识和研究物质及其变化的一种常用的科学方法。
(1)下列物质:①纯 ;②硝酸钾溶液;③铜;④二氧化碳;⑤
;②硝酸钾溶液;③铜;④二氧化碳;⑤ 固体;⑥
固体;⑥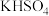 固体;⑦蔗糖;⑧熔融KCl;⑨氨水。其中能导电的是
固体;⑦蔗糖;⑧熔融KCl;⑨氨水。其中能导电的是___________ (填序号,下同),属于电解质的是___________ 。
(2) 胶体呈红褐色,具有良好的净水效果,写出饱和
胶体呈红褐色,具有良好的净水效果,写出饱和 溶液制备
溶液制备 胶体的化学方程式
胶体的化学方程式___________ 。
(3)硫酸酸化条件下,高锰酸钾可与草酸( )溶液发生反应,写出其化学方程式,并用单线桥法标出电子转移的方向和数目:
)溶液发生反应,写出其化学方程式,并用单线桥法标出电子转移的方向和数目:___________ 。
(4)在同温、同压下,实验测得CO、 和
和 三种气体的混合气体的密度是
三种气体的混合气体的密度是 的14.5倍,则混合气体中氧气的体积分数为
的14.5倍,则混合气体中氧气的体积分数为___________ 。
(5)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(式中 为阿伏加德罗常数的值)___________(填序号)。
为阿伏加德罗常数的值)___________(填序号)。
(1)下列物质:①纯
 ;②硝酸钾溶液;③铜;④二氧化碳;⑤
;②硝酸钾溶液;③铜;④二氧化碳;⑤ 固体;⑥
固体;⑥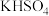 固体;⑦蔗糖;⑧熔融KCl;⑨氨水。其中能导电的是
固体;⑦蔗糖;⑧熔融KCl;⑨氨水。其中能导电的是(2)
 胶体呈红褐色,具有良好的净水效果,写出饱和
胶体呈红褐色,具有良好的净水效果,写出饱和 溶液制备
溶液制备 胶体的化学方程式
胶体的化学方程式(3)硫酸酸化条件下,高锰酸钾可与草酸(
 )溶液发生反应,写出其化学方程式,并用单线桥法标出电子转移的方向和数目:
)溶液发生反应,写出其化学方程式,并用单线桥法标出电子转移的方向和数目:(4)在同温、同压下,实验测得CO、
 和
和 三种气体的混合气体的密度是
三种气体的混合气体的密度是 的14.5倍,则混合气体中氧气的体积分数为
的14.5倍,则混合气体中氧气的体积分数为(5)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(式中
 为阿伏加德罗常数的值)___________(填序号)。
为阿伏加德罗常数的值)___________(填序号)。A.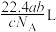 | B.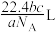 | C.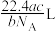 | D.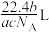 |
您最近一年使用:0次
3 . 利用氮的化合物的同时,有效治理和减少污染是我们面临的重要课题。
(1)NH3和N2H4是氮元素的两种重要的氢化物。下图为实验室模拟尿素法制备水合肼(N2H4·H2O)的流程图:

已知:①N2H4·H2O易溶于水,具有强还原性,易被氧化成N2。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成N2H4·H2O。
回答下列问题:
①结合NH3分子的结构和性质,解释NH3常用作制冷剂的原因为___________ 。
②吸收塔内发生反应的离子方程式为___________ 。
③写出反应器1中生成水合肼反应的化学方程式为___________ 。
④反应器1要控制NaClO溶液的用量,其主要目的是___________ 。
(2)科学家发现可以利用细胞中三种酶处理废水中含氮粒子,反应过程如图所示。
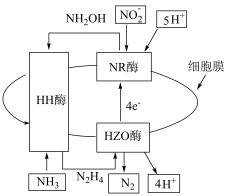
①反应过程中所涉及N2H4和 两种粒子,其中H-N-H与O-N-O相比键角较大的粒子为
两种粒子,其中H-N-H与O-N-O相比键角较大的粒子为___________ 。
②用电离方程式表述NH2OH的水溶液显碱性的原因___________ 。
(3)盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质与NH4Cl类似。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示(不考虑溶液体积的变化)。

①图2中N离子的电子式为___________ 。
②电池工作时,每消耗2.24L NO (标准状况),左室溶液质量增加___________ g。
(1)NH3和N2H4是氮元素的两种重要的氢化物。下图为实验室模拟尿素法制备水合肼(N2H4·H2O)的流程图:

已知:①N2H4·H2O易溶于水,具有强还原性,易被氧化成N2。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成N2H4·H2O。
回答下列问题:
①结合NH3分子的结构和性质,解释NH3常用作制冷剂的原因为
②吸收塔内发生反应的离子方程式为
③写出反应器1中生成水合肼反应的化学方程式为
④反应器1要控制NaClO溶液的用量,其主要目的是
(2)科学家发现可以利用细胞中三种酶处理废水中含氮粒子,反应过程如图所示。

①反应过程中所涉及N2H4和
 两种粒子,其中H-N-H与O-N-O相比键角较大的粒子为
两种粒子,其中H-N-H与O-N-O相比键角较大的粒子为②用电离方程式表述NH2OH的水溶液显碱性的原因
(3)盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质与NH4Cl类似。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示(不考虑溶液体积的变化)。

①图2中N离子的电子式为
②电池工作时,每消耗2.24L NO (标准状况),左室溶液质量增加
您最近一年使用:0次
解题方法
4 . 铜及其化合物在生产、生活中有着广泛的应用。回答下列问题:
(1)纳米铜是性能优异的超导材料,工业上以辉铜矿(主要成分为 )为原料制备纳米铜粉,
)为原料制备纳米铜粉, 中铜元素的化合价为
中铜元素的化合价为_______ 价。
(2)无水 常用于检验物质中是否含有水,吸水后会形成
常用于检验物质中是否含有水,吸水后会形成_______ 色晶体,俗称_______ 。
(3) 的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的CuO,化学方程式为
的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的CuO,化学方程式为_______ 。
(4) 常用作媒染剂、杀虫剂等。Cu与稀盐酸在持续通入空气的条件下反应生成
常用作媒染剂、杀虫剂等。Cu与稀盐酸在持续通入空气的条件下反应生成 ,
, 对该反应有催化作用,其催化原理如图所示。
对该反应有催化作用,其催化原理如图所示。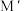 的化学式为
的化学式为_______ 。

(5)CuCl广泛应用于化工和印染等行业。在高于300℃,HCl气流中热分解 可以制备CuCl,其中HCl的作用是
可以制备CuCl,其中HCl的作用是_______ 。
(1)纳米铜是性能优异的超导材料,工业上以辉铜矿(主要成分为
 )为原料制备纳米铜粉,
)为原料制备纳米铜粉, 中铜元素的化合价为
中铜元素的化合价为(2)无水
 常用于检验物质中是否含有水,吸水后会形成
常用于检验物质中是否含有水,吸水后会形成(3)
 的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的CuO,化学方程式为
的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的CuO,化学方程式为(4)
 常用作媒染剂、杀虫剂等。Cu与稀盐酸在持续通入空气的条件下反应生成
常用作媒染剂、杀虫剂等。Cu与稀盐酸在持续通入空气的条件下反应生成 ,
, 对该反应有催化作用,其催化原理如图所示。
对该反应有催化作用,其催化原理如图所示。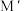 的化学式为
的化学式为
(5)CuCl广泛应用于化工和印染等行业。在高于300℃,HCl气流中热分解
 可以制备CuCl,其中HCl的作用是
可以制备CuCl,其中HCl的作用是
您最近一年使用:0次
名校
解题方法
5 . 工业废水中过量的氨氮( 和
和 )会导致水体富营养化,其氨氮总量的检测和去除备受关注。
)会导致水体富营养化,其氨氮总量的检测和去除备受关注。
(1)氨氮总量检测
利用氨气传感器检测水体中氨氮含量的示意图:
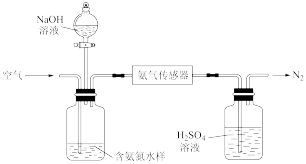
若利用氨气传感器将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为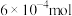 ,则水样中氨氮(以氨气计)含量为
,则水样中氨氮(以氨气计)含量为___________ mg/L。
(2) 氧化法处理氨氮废水
氧化法处理氨氮废水
①写出酸性条件下 氧化
氧化 为氮气的离子反应方程式
为氮气的离子反应方程式___________ 。
②为研究空气对 氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是
氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是___________ (填字母)。
a. 的氧化性比
的氧化性比 弱 b.
弱 b. 氧化氨氮速率比
氧化氨氮速率比 慢 c.空气中的
慢 c.空气中的 进入溶液中
进入溶液中
(3)传统的生物脱氮机理认为:脱氮过程一般包括氨化[将含氮有机物转化为氨氮( 、
、 )、硝化和反硝化三个过程。
)、硝化和反硝化三个过程。
①硝化过程:废水中的氨氮( 、
、 )在硝化菌(好氧自养型微生物)的作用下被转化为
)在硝化菌(好氧自养型微生物)的作用下被转化为 和
和 的过程。其中硝化过程的主要反应原理有:
的过程。其中硝化过程的主要反应原理有:
反应1
反应2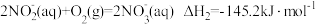
反应3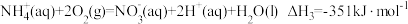
则x=___________ 。
②反硝化过程:若在缺氧环境和反硝化菌的作用下,向某含 的酸性废水中加入适量的甲醇,能实现“反硝化”过程,并产生两种对环境无污染的气体;写出该过程的离子反应方程式:
的酸性废水中加入适量的甲醇,能实现“反硝化”过程,并产生两种对环境无污染的气体;写出该过程的离子反应方程式:___________ 。
(4)新型生物脱氮工艺可将硝化过程中的产物控制在 阶段,防止生成
阶段,防止生成 ,该工艺的优点
,该工艺的优点___________ 。
 和
和 )会导致水体富营养化,其氨氮总量的检测和去除备受关注。
)会导致水体富营养化,其氨氮总量的检测和去除备受关注。(1)氨氮总量检测
利用氨气传感器检测水体中氨氮含量的示意图:

若利用氨气传感器将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为
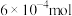 ,则水样中氨氮(以氨气计)含量为
,则水样中氨氮(以氨气计)含量为(2)
 氧化法处理氨氮废水
氧化法处理氨氮废水①写出酸性条件下
 氧化
氧化 为氮气的离子反应方程式
为氮气的离子反应方程式②为研究空气对
 氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是
氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是a.
 的氧化性比
的氧化性比 弱 b.
弱 b. 氧化氨氮速率比
氧化氨氮速率比 慢 c.空气中的
慢 c.空气中的 进入溶液中
进入溶液中(3)传统的生物脱氮机理认为:脱氮过程一般包括氨化[将含氮有机物转化为氨氮(
 、
、 )、硝化和反硝化三个过程。
)、硝化和反硝化三个过程。①硝化过程:废水中的氨氮(
 、
、 )在硝化菌(好氧自养型微生物)的作用下被转化为
)在硝化菌(好氧自养型微生物)的作用下被转化为 和
和 的过程。其中硝化过程的主要反应原理有:
的过程。其中硝化过程的主要反应原理有:反应1

反应2
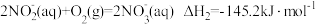
反应3
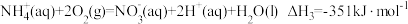
则x=
②反硝化过程:若在缺氧环境和反硝化菌的作用下,向某含
 的酸性废水中加入适量的甲醇,能实现“反硝化”过程,并产生两种对环境无污染的气体;写出该过程的离子反应方程式:
的酸性废水中加入适量的甲醇,能实现“反硝化”过程,并产生两种对环境无污染的气体;写出该过程的离子反应方程式:(4)新型生物脱氮工艺可将硝化过程中的产物控制在
 阶段,防止生成
阶段,防止生成 ,该工艺的优点
,该工艺的优点
您最近一年使用:0次
名校
解题方法
6 . 光刻技术需要利用深紫激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟代硼铍酸钾晶体 KBBF(KBe2BO3F2),实验室可用 BeO、KBF4和 B2O3 在 700℃左右灼烧获得氟代硼铍酸钾晶体(晶胞如下图所示,其中 K 原子已经给出,氧原子略去),并放出 BF3气体。回答下列问题:
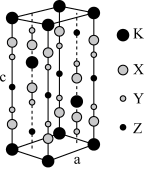
(1)基态钾原子的核外电子排布式为___________ ,能量最高的电子的电子云轮廓图形状为___________ 。
(2)BF3的空间构型为___________ ,与其互为等电子体的阴离子为___________ (填一种即可)。
(3)氟代硼铍酸钾晶体 KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为___________ 。
(4)KBF4中心 B 原子的杂化方式为___________ 杂化。
(5) 三卤化硼的性质如下:
BF3、BCl3、BBr3、BI3的沸点逐渐升高的原因是:___________ 。
(6)指出图中代表硼原子的字母为___________ ,该KBBF晶体的晶胞参数分别为a pm 和 c pm,α=β=γ=90°,则晶体密度为___________ g·cm-3(M 代表 KBBF 的摩尔质量,NA表示阿伏加德罗常数的值,列出计算式)。

(1)基态钾原子的核外电子排布式为
(2)BF3的空间构型为
(3)氟代硼铍酸钾晶体 KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为
(4)KBF4中心 B 原子的杂化方式为
(5) 三卤化硼的性质如下:
| BF3 | BCl3 | BBr3 | BI3 | |
| 熔点/℃ | -127. | | -107 | -46 | 49.9 |
| 沸点/℃ | -99 | 12.5 | 91.3 | 210. |
BF3、BCl3、BBr3、BI3的沸点逐渐升高的原因是:
(6)指出图中代表硼原子的字母为
您最近一年使用:0次
名校
解题方法
7 . CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。请回答下列问题:
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
(1)达到平衡时,反应a,b对比:CO2的体积分数φ(a)_______ φ(b)(填“>”、“<”或“=”))。
(2)下列能说明反应a达到平衡状态的是_______ (填字母)。
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
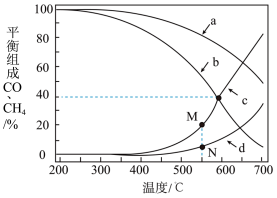
(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_______ 和_______ 。M点平衡组成含量高于N点的原因是_______ 。
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为_______ 。
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
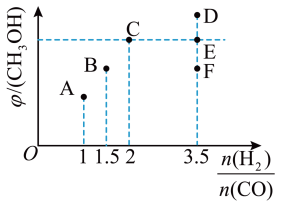
(5)当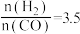 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的_______ (填“D”、“E”或“F”)点。
(6) =
=_______ 时,CH3OH的体积分数最大。
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
| CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应a(恒温恒容) | 1 | 3 | 0 | 0 |
| 反应b(绝热恒容) | 0 | 0 | 1 | 1 |
(2)下列能说明反应a达到平衡状态的是
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。

(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。

(5)当
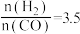 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的(6)
 =
=
您最近一年使用:0次
2021-03-04更新
|
822次组卷
|
4卷引用:吉林省延边州2021届高三下学期教学质量检测(2月底) 理综化学试题
吉林省延边州2021届高三下学期教学质量检测(2月底) 理综化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测江苏省扬州中学2021-2022学年高二上学期期中考试化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)
11-12高三·山东泰安·阶段练习
8 . 某学生欲配制6.0mol/L的H2SO4 1000 mL,实验室有三种不同浓度的硫酸:
①480mL 0.5mol/L 的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______ mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______ mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸____ mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._________________________________________________________________________________________________________________________________
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________ (填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意____________________________________________________________________ 。
①480mL 0.5mol/L 的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为
(2)配制该硫酸溶液应选用容量瓶的规格为
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?
(5)进行操作C前还需注意
您最近一年使用:0次
2020-09-21更新
|
1179次组卷
|
19卷引用:2017届吉林省实验中学高三上第二次模拟化学试卷
2017届吉林省实验中学高三上第二次模拟化学试卷(已下线)2013届山东省泰安市宁阳二中高三第一次月考化学试卷(已下线)2013届山东省泰安市宁阳二中高三第一次月考化学试卷(已下线)2014届福建省厦门外国语学校高三上学期第一次月考化学试卷(已下线)2013届福建省厦门双十中学高三上学期期中考试化学试卷2013—2014福建省闽侯一中高三上学期10月月考化学试卷2016届内蒙古巴彦淖尔市第一中学高三上学期9月月考化学试卷2015-2016学年江西省上高二中高一上第一次月考化学试卷2016届河北省邯郸市广平一中高三上10月月考化学试卷2016-2017学年河北省邯郸一中高一上入学考试化学试卷2017届四川省绵阳市丰谷中学高三上学期第一次月考化学试卷黑龙江省哈尔滨市师大附中2016-2017学年高一10月月考化学卷河南省开封市兰考县第三高级中学2017-2018学年高一上学期期末考试化学试卷(已下线)学科网2019年高考化学一轮复习讲练测1.2 物质的量浓度 测山东省济宁市鱼台县第一中学2019-2020学年高一上学期期中考试化学试题2019-2020学年高一上学期期末复习《新题速递·化学》12月(考点06-11)(已下线)期末模拟卷(二)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00149】(已下线)1.3.4 一定的物质的量浓度溶液的配制-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
解题方法
9 . 某溶液中可能含有下列阴离子:SO42-、SO32-、CO32-、Cl-。
(1)当溶液中存在大量H+时,溶液中不能大量存在的离子是_____________ 。
(2)当溶液中存在大量的Ba2+时,溶液中能大量存在的离子是_____________ 。
(3)当溶液中同时存在大量_____ 和_____ 离子时,上述阴离子都不能大量不存在。
(1)当溶液中存在大量H+时,溶液中不能大量存在的离子是
(2)当溶液中存在大量的Ba2+时,溶液中能大量存在的离子是
(3)当溶液中同时存在大量
您最近一年使用:0次
10 . (一)硫及其化合物在生产、生中有广泛应用。
(1)硫原子最外层有_________ 种不同运动状态的电子,能量最高的电子其电子云形状是________ 。
(2)硫与同主族的短周期元素相比,形成气态氢化物稳定性的大小为_________ ,从化学键角度解释其原 因____________ 。
(3)棉织物用氯气漂白后,加入 Na2S2O3 除去余氯,反应中___________ 被氧化;若反应中生成 0.2 mol SO42-则转移电子________ mol。
(4)同温同浓度的 Na2SO3、(NH4)2SO3、NaHSO3 三种溶液中c(SO32-)最大的是___________ 。
(5)经测定 NaHSO3 溶液中 c(H2SO3)<c(SO32-),则 NaHSO3溶液呈_____ (填“酸或碱”)性,请结合相关方程式解释原因_______________ 。
(1)硫原子最外层有
(2)硫与同主族的短周期元素相比,形成气态氢化物稳定性的大小为
(3)棉织物用氯气漂白后,加入 Na2S2O3 除去余氯,反应中
(4)同温同浓度的 Na2SO3、(NH4)2SO3、NaHSO3 三种溶液中c(SO32-)最大的是
(5)经测定 NaHSO3 溶液中 c(H2SO3)<c(SO32-),则 NaHSO3溶液呈
您最近一年使用:0次
2019-12-31更新
|
128次组卷
|
2卷引用:吉林省白山市抚松县第六中学2021-2022学年高三考前模拟化学试题



