1 . 根据短周期元素的性质回答下列问题。
I. 有较强的配位能力,许多金属离子都可以与
有较强的配位能力,许多金属离子都可以与 形成稳定的配合。反应
形成稳定的配合。反应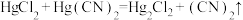 用于制备
用于制备 。
。
(1)上述反应的氧化剂是_______ 。
(2)写出 的结构简式
的结构简式_______ , 的空间构型是
的空间构型是_______ ;1mol 分子中
分子中 键为
键为_______ mol。
(3) 被称为拟卤素,性质与卤素相似,写出
被称为拟卤素,性质与卤素相似,写出 与氢氧化钠溶液反应的离子方程式
与氢氧化钠溶液反应的离子方程式_______ 。
(4)基态N价层电子排布式为_______ 。
Ⅱ.氟化镁( )晶胞是长方体,其结构如图所示
)晶胞是长方体,其结构如图所示 晶胞示意图中○表示
晶胞示意图中○表示_______ (填离子符号)。
(6)结合离子结构示意图,解释离子半径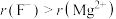 的原因
的原因_______ 。
(7) 晶胞中有
晶胞中有_______ 个 ;
;_______ 个 。
。
I.
 有较强的配位能力,许多金属离子都可以与
有较强的配位能力,许多金属离子都可以与 形成稳定的配合。反应
形成稳定的配合。反应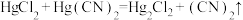 用于制备
用于制备 。
。(1)上述反应的氧化剂是
(2)写出
 的结构简式
的结构简式 的空间构型是
的空间构型是 分子中
分子中 键为
键为(3)
 被称为拟卤素,性质与卤素相似,写出
被称为拟卤素,性质与卤素相似,写出 与氢氧化钠溶液反应的离子方程式
与氢氧化钠溶液反应的离子方程式(4)基态N价层电子排布式为
Ⅱ.氟化镁(
 )晶胞是长方体,其结构如图所示
)晶胞是长方体,其结构如图所示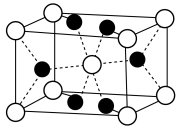
 晶胞示意图中○表示
晶胞示意图中○表示(6)结合离子结构示意图,解释离子半径
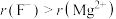 的原因
的原因(7)
 晶胞中有
晶胞中有 ;
; 。
。
您最近一年使用:0次
2 . 工业烟气中常含有 (NO、
(NO、 )。用NaClO溶液中将
)。用NaClO溶液中将 转化为
转化为 ,再将含
,再将含 溶液进行电化学环保处理。按要求回答下列问题。
溶液进行电化学环保处理。按要求回答下列问题。
(1) 在大气中会形成酸雨,以NO为例,从氧化还原反应角度分析,过程中表现出的性质是
在大气中会形成酸雨,以NO为例,从氧化还原反应角度分析,过程中表现出的性质是___________ 。
(2)向NaClO溶液中加入硫酸,研究初始pH对 脱除率的影响,结果如下。
脱除率的影响,结果如下。
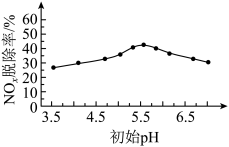
已知: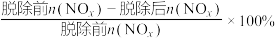
①不用盐酸调节NaClO溶液初始pH的原因是___________ 。
②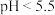 时NaClO溶液脱除NOₓ的反应为可逆反应,以NO为例,写出该反应的离子方程式:
时NaClO溶液脱除NOₓ的反应为可逆反应,以NO为例,写出该反应的离子方程式:___________ 。
③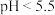 时,分析
时,分析 脱除率随溶液初始pH升高而增大的可能原因:
脱除率随溶液初始pH升高而增大的可能原因:___________ 。
(3)将上述 脱除后产生的含
脱除后产生的含 溶液,用铁碳微电池法在弱酸性条件下进行电化学环保处理,其工作原理及装置如图所示。
溶液,用铁碳微电池法在弱酸性条件下进行电化学环保处理,其工作原理及装置如图所示。
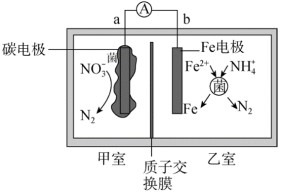
①电池工作时的负极为___________ 。
②碳电极上的电极反应式为___________ 。
③若甲室处理37.2g ,则乙室可生成
,则乙室可生成___________ mol 。
。
 (NO、
(NO、 )。用NaClO溶液中将
)。用NaClO溶液中将 转化为
转化为 ,再将含
,再将含 溶液进行电化学环保处理。按要求回答下列问题。
溶液进行电化学环保处理。按要求回答下列问题。(1)
 在大气中会形成酸雨,以NO为例,从氧化还原反应角度分析,过程中表现出的性质是
在大气中会形成酸雨,以NO为例,从氧化还原反应角度分析,过程中表现出的性质是(2)向NaClO溶液中加入硫酸,研究初始pH对
 脱除率的影响,结果如下。
脱除率的影响,结果如下。
已知:
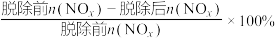
①不用盐酸调节NaClO溶液初始pH的原因是
②
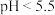 时NaClO溶液脱除NOₓ的反应为可逆反应,以NO为例,写出该反应的离子方程式:
时NaClO溶液脱除NOₓ的反应为可逆反应,以NO为例,写出该反应的离子方程式:③
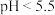 时,分析
时,分析 脱除率随溶液初始pH升高而增大的可能原因:
脱除率随溶液初始pH升高而增大的可能原因:(3)将上述
 脱除后产生的含
脱除后产生的含 溶液,用铁碳微电池法在弱酸性条件下进行电化学环保处理,其工作原理及装置如图所示。
溶液,用铁碳微电池法在弱酸性条件下进行电化学环保处理,其工作原理及装置如图所示。
①电池工作时的负极为
②碳电极上的电极反应式为
③若甲室处理37.2g
 ,则乙室可生成
,则乙室可生成 。
。
您最近一年使用:0次
3 . 石油产品中含者H2S及COS等多种有机硫化物,石油化工催生出多种脱硫技术,请回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g) S2(g)+2H2(g) ΔH1=+180kJ·mol-1
S2(g)+2H2(g) ΔH1=+180kJ·mol-1
②CH4(g)+S2(g) CS2(g)+2H2(g) ΔH2=+81kJ·mol-1
CS2(g)+2H2(g) ΔH2=+81kJ·mol-1
计算反应③:CH4(g)+2H2S(g) CS2(g)+4H2(g) ΔH3=
CS2(g)+4H2(g) ΔH3=___________ kJ·mol-1
(2)工业生产中应用:COS的水解反应为COS(g) + H2O(g) CO2 (g)+ H2S(g) ΔH<0。用活性α-Al2O3作催化剂,在恒温恒容密闭容器中COS(g)的平衡转化率随不同投料比[
CO2 (g)+ H2S(g) ΔH<0。用活性α-Al2O3作催化剂,在恒温恒容密闭容器中COS(g)的平衡转化率随不同投料比[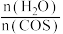 ]的转化关系如图甲所示。
]的转化关系如图甲所示。

① 向起始容器中投入一定量反应物,一定可以判断反应到达平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.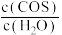 保持不变
保持不变
C.该反应化学平衡常数保持不变 D.υ逆(COS)= υ正(H2S)
② 根据图甲和图乙判断该反应的最佳条件为:投料比[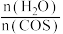 ]
]___________ ;温度___________

③ 当温度升高到一定值后,发现相同时间内COS(g)的水解转化率降低,猜测可能的原因是___________ ;___________ 。(写出两条)
(3)我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除,如图所示,则阳极区发生的总反应为___________ 。

(4)可以用K2CO3溶液吸收H2S,其原理:K2CO3+ H2S KHS +KHCO3,该反应的平衡常数为
KHS +KHCO3,该反应的平衡常数为___________ 。( 已知H2CO3的Ka1=4.2×10-7 ,Ka2=5.6×10-11 ;H2S的Ka1=5.6×10-8 ,Ka2=1.2×10-15)
(1)已知下列反应的热化学方程式:
①2H2S(g)
 S2(g)+2H2(g) ΔH1=+180kJ·mol-1
S2(g)+2H2(g) ΔH1=+180kJ·mol-1②CH4(g)+S2(g)
 CS2(g)+2H2(g) ΔH2=+81kJ·mol-1
CS2(g)+2H2(g) ΔH2=+81kJ·mol-1计算反应③:CH4(g)+2H2S(g)
 CS2(g)+4H2(g) ΔH3=
CS2(g)+4H2(g) ΔH3=(2)工业生产中应用:COS的水解反应为COS(g) + H2O(g)
 CO2 (g)+ H2S(g) ΔH<0。用活性α-Al2O3作催化剂,在恒温恒容密闭容器中COS(g)的平衡转化率随不同投料比[
CO2 (g)+ H2S(g) ΔH<0。用活性α-Al2O3作催化剂,在恒温恒容密闭容器中COS(g)的平衡转化率随不同投料比[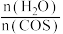 ]的转化关系如图甲所示。
]的转化关系如图甲所示。
① 向起始容器中投入一定量反应物,一定可以判断反应到达平衡状态的是
A.容器中气体密度不变 B.
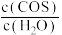 保持不变
保持不变C.该反应化学平衡常数保持不变 D.υ逆(COS)= υ正(H2S)
② 根据图甲和图乙判断该反应的最佳条件为:投料比[
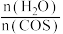 ]
]
③ 当温度升高到一定值后,发现相同时间内COS(g)的水解转化率降低,猜测可能的原因是
(3)我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除,如图所示,则阳极区发生的总反应为

(4)可以用K2CO3溶液吸收H2S,其原理:K2CO3+ H2S
 KHS +KHCO3,该反应的平衡常数为
KHS +KHCO3,该反应的平衡常数为
您最近一年使用:0次
4 . 硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。回答下列问题:
Ⅰ、工业生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:

(1)上述流程中“碱浸”后,物质A必须经过___________ (填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为___________ 。
(2)上述流程中采用稀碱液比用热水更好,理由是___________ 。
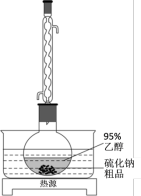
Ⅱ、工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。
(3)溶解回流装置如图所示,回流前无需加入沸石,其原因是___________ 。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的 。若气雾上升过高,可采取的措施是
。若气雾上升过高,可采取的措施是___________ 。
(4)回流时间不宜过长,原因是___________ 。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为___________ (填标号)。
a.①②③ b.③①② c.②①③ d.①③②
(5)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是___________ 。过滤除去的杂质为___________ 。若滤纸上析出大量晶体,则可能的原因是___________ 。
Ⅲ、应用
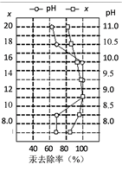
(6)皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是___________ 、___________ 。
(7)某毛纺厂废水中含0.001mol·L-1的硫化钠,与纸张漂白后的废水(含0.002mol·L-1NaClO)按1∶2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有___________ 。
Ⅰ、工业生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:

(1)上述流程中“碱浸”后,物质A必须经过
(2)上述流程中采用稀碱液比用热水更好,理由是

Ⅱ、工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。
(3)溶解回流装置如图所示,回流前无需加入沸石,其原因是
 。若气雾上升过高,可采取的措施是
。若气雾上升过高,可采取的措施是(4)回流时间不宜过长,原因是
a.①②③ b.③①② c.②①③ d.①③②
(5)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是
Ⅲ、应用
(6)皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是

(7)某毛纺厂废水中含0.001mol·L-1的硫化钠,与纸张漂白后的废水(含0.002mol·L-1NaClO)按1∶2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有
您最近一年使用:0次
5 . 元素周期表中,铍(Be)与铝处于对角线的位置,它们的性质相似。试回答:
(1)Be元素在元素周期表中的位置:___________ ,有关Be性质的推断不正确的是___________ (填序号)。
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时, 溶液的
溶液的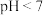
(2)已知: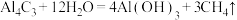 ,写出
,写出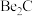 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为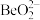 ):
):___________
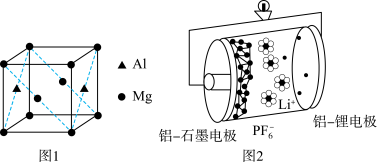
(3)基态铝原子的价电子排布式为___________ ,镁铝合金经过高温淬火获得一种储钠材料,用___________ 法测定其晶胞结构如图1所示,图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___________ ,该立方晶胞的晶胞的密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为___________ pm。(列出计算式,可不化简)。
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为: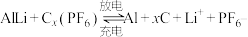 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为___________ ,充电时,应将铝-石墨电极与外接电源的___________ 极相连。
(1)Be元素在元素周期表中的位置:
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时,
 溶液的
溶液的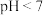
(2)已知:
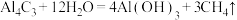 ,写出
,写出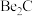 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为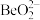 ):
):(3)基态铝原子的价电子排布式为
 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为:
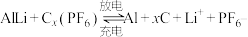 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为
您最近一年使用:0次
解题方法
6 . Na、Mg、Fe、Cu是四种重要的金属元素。回答下列问题:
(1)基态Mg原子的价层电子轨道表示式为__________________ 。
(2) 的电子式为
的电子式为____________ 。
(3)在钢铁厂的生产中,炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水,请用化学方程式解释原因:__________________ 。
(4)检验 溶液中是否残留
溶液中是否残留 的试剂是
的试剂是__________________ 。
(5)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为 ,加入
,加入 的目的是
的目的是____________ 。
(6)采用空气和Na为原料可直接制备 。空气与熔融金属Na反应前,需依次通过
。空气与熔融金属Na反应前,需依次通过____________ 、____________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(7)天然碱的主要成分为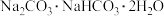 ,2 mol
,2 mol 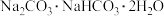 经充分加热得到
经充分加热得到 的质量为
的质量为______ g。
(8)一个 晶胞(如图)中,Cu原子的数目为
晶胞(如图)中,Cu原子的数目为______ 。
(1)基态Mg原子的价层电子轨道表示式为
(2)
 的电子式为
的电子式为(3)在钢铁厂的生产中,炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水,请用化学方程式解释原因:
(4)检验
 溶液中是否残留
溶液中是否残留 的试剂是
的试剂是(5)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为
 ,加入
,加入 的目的是
的目的是(6)采用空气和Na为原料可直接制备
 。空气与熔融金属Na反应前,需依次通过
。空气与熔融金属Na反应前,需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(7)天然碱的主要成分为
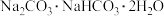 ,2 mol
,2 mol 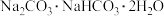 经充分加热得到
经充分加热得到 的质量为
的质量为(8)一个
 晶胞(如图)中,Cu原子的数目为
晶胞(如图)中,Cu原子的数目为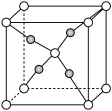
您最近一年使用:0次
2023-02-20更新
|
561次组卷
|
4卷引用:天津市八校2024届高三下学期联合模拟考试化学试题(二)
天津市八校2024届高三下学期联合模拟考试化学试题(二)天津市南开区2022~2023 学年高三上学期阶段性质量监测 (二) 化学试题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(结构与性质)(已下线)结构与性质
名校
7 . 请回答:
(1)Na2O2的电子式_____ 。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由:_____ 。
(3)Al(OH)3的电离方程式_____ 。
(4)Na、Mg、Al基态原子第一电离能的大小顺序_____ ,原因:_____ 。
(5)NaAlH4是重要的还原剂,它与水发生反应的化学方程式:_____ 。
(6)金属铝的工业制法,写出相关化学方程式_____ 。
(7)用离子方程式表示泡沫灭火器的反应原理____ 。
(8)烧碱的工业制法,写出相关化学方程式_____ 。
(9)Fe2+的价电子的电子排布图_____ 。
(10)NaCl晶体的晶胞中Na+的配位数为_____ 。
(11)用离子方程式表示使用铁氰化钾检验Fe2+_____ 。
(1)Na2O2的电子式
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由:
(3)Al(OH)3的电离方程式
(4)Na、Mg、Al基态原子第一电离能的大小顺序
(5)NaAlH4是重要的还原剂,它与水发生反应的化学方程式:
(6)金属铝的工业制法,写出相关化学方程式
(7)用离子方程式表示泡沫灭火器的反应原理
(8)烧碱的工业制法,写出相关化学方程式
(9)Fe2+的价电子的电子排布图
(10)NaCl晶体的晶胞中Na+的配位数为
(11)用离子方程式表示使用铁氰化钾检验Fe2+
您最近一年使用:0次
8 . 氮氧化物的有效去除和资源的充分利用是当今社会的重要研究课题。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) ΔH1 = -907.0 kJ•mol-1
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g) 5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为
5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为_______ kJ•mol-1 (用含E逆的代数式表示)。
(2)已知:①2NO(g)+2ICl(g) 2NOCl (g)+I2(g)
2NOCl (g)+I2(g)
②2NOCl(g) 2NO(g)+Cl2(g)
2NO(g)+Cl2(g)
③I2(g)+Cl2(g) 2ICl(g)
2ICl(g)
若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为_______ mol•L-1(用含 a、b、V 的代数式表示,下同),反应③的平衡常数为_______ 。
(3)某化工厂排出的尾气(含 CO、N2O)治理的方法为在密闭容器中发生如下反应:CO(g)+N2O(g) CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:_______ 。
(4)已知4CO(g) +2NO2(g) 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行,为探究温度及不同催化剂对该反应的影响,保持其它初始条件不变重复实验,在相同时间内测得 N2产率与温度的关系如图所示。在催化剂乙作用下,图中 M 点对应的速率(对应温度400℃)v正_______ (填“>”、“<” 或“=”) v逆,温度高于400℃,N2产率降低的原因可能是_______ 。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) ΔH1 = -907.0 kJ•mol-1
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g)
 5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为
5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为(2)已知:①2NO(g)+2ICl(g)
 2NOCl (g)+I2(g)
2NOCl (g)+I2(g) ②2NOCl(g)
 2NO(g)+Cl2(g)
2NO(g)+Cl2(g)③I2(g)+Cl2(g)
 2ICl(g)
2ICl(g)若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为
(3)某化工厂排出的尾气(含 CO、N2O)治理的方法为在密闭容器中发生如下反应:CO(g)+N2O(g)
 CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
(4)已知4CO(g) +2NO2(g)
 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
您最近一年使用:0次
2022-05-12更新
|
857次组卷
|
5卷引用:天津市和平区2022届高三第二次质量调查化学试题
天津市和平区2022届高三第二次质量调查化学试题湖南省邵东市第三中学2021-2022学年高三下学期5月月考化学试题湖南省祁东县育贤中学2022-2023学年高二上学期第一次月考化学试题(已下线)专题06 化学反应的方向及调控【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)2024届广西桂林市高三下学期4月月考化学试卷
名校
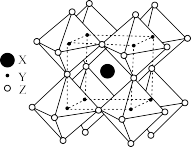
9 . 近日,我国研究人员利用硫氰酸甲基铵{[CH3NH3]+[SCN]-}气相辅助生长技术,成功制得稳定的钙钛矿型甲脒铅碘(FAPbI3)。请回答下列问题:
(1)基态S原子的价电子排布图为___________ 。
(2)甲脒(FA)的结构简式为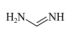
①其组成元素的电负性由小到大的排序为___________ ,其中碳原子的杂化方式为___________ 。
②甲脒比丙烷的熔点更高的原因是___________ 。
(3)FAPbI3的晶体结构单元如图所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为___________ 。
(1)基态S原子的价电子排布图为
(2)甲脒(FA)的结构简式为

①其组成元素的电负性由小到大的排序为
②甲脒比丙烷的熔点更高的原因是
(3)FAPbI3的晶体结构单元如图所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为

您最近一年使用:0次
2021-10-13更新
|
610次组卷
|
5卷引用:天津市五校2023届高三一模联考化学试题
天津市五校2023届高三一模联考化学试题天津市西青区杨柳青第一中学2021--2022 学年高三上学期第一次阶段检测化学试题福建省宁化第一中学2021-2022学年高三上学期第二次阶段考试化学试题(已下线)第19讲元素周期律与元素周期表(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
10 . 氮的化合物种类繁多,性质也各不相同。请回答下列问题:
(1)已知:
①SO3(g)+NO(g)=NO2(g)+SO2(g) ∆H1=+41.8kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) ∆H2=-196.6kJ·mol-1
则2NO2(g)=2NO(g)+O2(g)的∆H=_______ 。
(2)NO作为主要空气污染物,其主要来源是汽车尾气,研究人员用活性炭对汽车尾气中的NO进行吸附,并发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ∆H<0.在恒压密闭容器中加入足量活性炭和一定量NO气体,反应相同时间时,测得NO的转化率α(NO)随温度的变化如图所示:
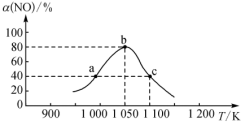
图中a、b、c三点中,达到平衡的点是_______ ;温度为1100K时,N2的平衡体积分数为_______ 。
(3)现代技术用氨气将汽车尾气中的NOx还原为N2和H2O,反应原理是NO(g)+NO2(g)+2NH3(g) 3H2O(g)+2N2(g) ∆H<0。
3H2O(g)+2N2(g) ∆H<0。
①实际生产中NO(g)+NO2(g)+2NH3(g) 3H2O(g)+2N2(g)的反应温度不宜过高的原因是
3H2O(g)+2N2(g)的反应温度不宜过高的原因是_______ 。
②500℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,8min时反应达到平衡,此时NH3的转化率为40%,体系压强为p0MPa,则0~8min内用N2表示的平均反应速率v(N2)=_______ mol·L-1·min-1,500℃时该反应的平衡常数Kp=_______ MPa(用含p0的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(1)已知:
①SO3(g)+NO(g)=NO2(g)+SO2(g) ∆H1=+41.8kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) ∆H2=-196.6kJ·mol-1
则2NO2(g)=2NO(g)+O2(g)的∆H=
(2)NO作为主要空气污染物,其主要来源是汽车尾气,研究人员用活性炭对汽车尾气中的NO进行吸附,并发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ∆H<0.在恒压密闭容器中加入足量活性炭和一定量NO气体,反应相同时间时,测得NO的转化率α(NO)随温度的变化如图所示:

图中a、b、c三点中,达到平衡的点是
(3)现代技术用氨气将汽车尾气中的NOx还原为N2和H2O,反应原理是NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g) ∆H<0。
3H2O(g)+2N2(g) ∆H<0。①实际生产中NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g)的反应温度不宜过高的原因是
3H2O(g)+2N2(g)的反应温度不宜过高的原因是②500℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,8min时反应达到平衡,此时NH3的转化率为40%,体系压强为p0MPa,则0~8min内用N2表示的平均反应速率v(N2)=
您最近一年使用:0次
2021-07-13更新
|
3547次组卷
|
8卷引用:2021年天津高考化学试题变式题13-16



