1 . 以乙烯为原料,可以制备乙酸乙酯

(1)③的反应类型是___________ ,乙醇分子中官能团的名称是 ___________ 。
(2)写出反应①的化学方程式___________ 。
(3)利用图示装置制取乙酸乙酯。写出生成乙酸乙酯的化学方程式:___________ 。

(1)③的反应类型是
(2)写出反应①的化学方程式
(3)利用图示装置制取乙酸乙酯。写出生成乙酸乙酯的化学方程式:
您最近一年使用:0次
名校
2 . 回答下列问题:
(1)在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
①计算20~40s内用N2O4表示的平均反应速率为___ mol·L-1·s-1。
②反应进行至100s后将反应混合物的温度降低,混合气体的颜色___ (填“变浅”“变深”或“不变”)。
③要增大该反应的K值,可采取的措施有___ (填序号)。
A.增大N2O4起始浓度B.向混合气体中通入NO2
C.使用高效催化剂D.升高温度
(2)已知2A2(g)+B2(g) 2C(g)ΔH=-akJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-akJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
①a___ (填“>”“=”或“<”)b。
②若将反应温度升高到700℃,该反应的平衡常数将___ (填“增大”“减小”或“不变”)。
③若在原来的容器中,只加入2molC,500℃时充分反应达到平衡后,C的浓度___ (填“>”“=”或“<”)wmol·L-1.
④能说明该反应已经达到平衡状态的是___ 。
a.v(C)=2v(B2)b.容器内压强保持不变
c.v逆(A2)=2v正(B2)d.容器内气体的密度保持不变
⑤使该反应的反应速率增大,且平衡向正反应方向移动的操作是___ 。
a.及时分离出C气体b.适当升高温度
c.增大B2的浓度d.选择高效的催化剂
(1)在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4
 2NO2ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间/s 物质n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②反应进行至100s后将反应混合物的温度降低,混合气体的颜色
③要增大该反应的K值,可采取的措施有
A.增大N2O4起始浓度B.向混合气体中通入NO2
C.使用高效催化剂D.升高温度
(2)已知2A2(g)+B2(g)
 2C(g)ΔH=-akJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-akJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。①a
②若将反应温度升高到700℃,该反应的平衡常数将
③若在原来的容器中,只加入2molC,500℃时充分反应达到平衡后,C的浓度
④能说明该反应已经达到平衡状态的是
a.v(C)=2v(B2)b.容器内压强保持不变
c.v逆(A2)=2v正(B2)d.容器内气体的密度保持不变
⑤使该反应的反应速率增大,且平衡向正反应方向移动的操作是
a.及时分离出C气体b.适当升高温度
c.增大B2的浓度d.选择高效的催化剂
您最近一年使用:0次
2021-09-07更新
|
590次组卷
|
4卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题(已下线)专题22 化学平衡 化学平衡常数(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练西藏拉萨中学2021-2022学年高二上学期第一次月考理综化学试题内蒙古乌兰察布市部分学校2021-2022学年高二上学期期中联考化学试题
3 . A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如图反应关系:
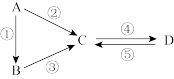
(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式:___ 。
(2)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素位于同一主族,且溶液均显碱性。写出反应②的化学方程式:___ 。
(3)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式:___ 。
(4)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式:___ 。

(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式:
(2)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素位于同一主族,且溶液均显碱性。写出反应②的化学方程式:
(3)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式:
(4)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式:
您最近一年使用:0次
4 . 甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1
②CO2(g)+H2(g) CO(g)+H2O(g)△H2
CO(g)+H2O(g)△H2
③CH3OH(g) CO(g)+2H2(g)△H3
CO(g)+2H2(g)△H3
回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:
由此计算△H2=___ kJ∙mol−1。已知△H1=−63 kJ∙mol−1,则△H3=___ kJ∙mol−1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。
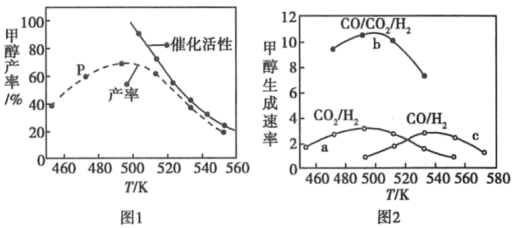
①温度为470K时,图中P点___ (填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是___ 。
②提高甲醇产率的措施是___ 。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。当温度为490K时,根据曲线a、c,判断合成甲醇的反应机理是___ (填“I”或“II”)。
Ⅰ.CO2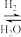 CO
CO CH3OH
CH3OH
Ⅱ.CO CO2
CO2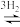 CH3OH+H2O
CH3OH+H2O
(4)490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,并结合反应①、②分析原因___ 。
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1②CO2(g)+H2(g)
 CO(g)+H2O(g)△H2
CO(g)+H2O(g)△H2③CH3OH(g)
 CO(g)+2H2(g)△H3
CO(g)+2H2(g)△H3回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:
| 化学键 | H—H | C=O | C≡O | H—O |
| E/( kJ∙mol−1) | 436 | 803 | 1076 | 465 |
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。

①温度为470K时,图中P点
②提高甲醇产率的措施是
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。当温度为490K时,根据曲线a、c,判断合成甲醇的反应机理是
Ⅰ.CO2
 CO
CO CH3OH
CH3OHⅡ.CO
 CO2
CO2 CH3OH+H2O
CH3OH+H2O(4)490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,并结合反应①、②分析原因
您最近一年使用:0次
2021-08-25更新
|
1583次组卷
|
5卷引用:甘肃省2019届高三一诊理综化学试题
甘肃省2019届高三一诊理综化学试题(已下线)化学预测卷(八)-预测卷(浙江专版)福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题(已下线)2021年高考全国甲卷化学试题变式题(已下线)章末培优2 专题2 化学反应速率与化学平衡-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)
名校
5 . Ⅰ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
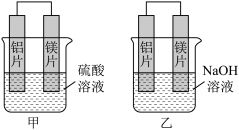
(1)写出甲中正极的电极反应式:____ 。
(2)乙中负极为__ ,总反应的离子方程式:___ 。
(3)由此实验得出的下列结论中,正确的有____ 。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
Ⅱ.化学电池在通信、交通及日常生活中有着广泛的应用。目前常用的镍镉(NiCd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____ (填字母序号)。
①放电时Cd作正极 ②放电时Ni元素被还原
③充电时化学能转变为电能 ④放电时化学能转变为电能
Ⅲ.氢气和氧气可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式(当电解质溶液为NaOH(aq)或KOH(aq)时)两种。试回答下列问题:
(1)酸式电池的电极反应:正极_____ ;
(2)碱式电池的电极反应:负极_______ 。

(1)写出甲中正极的电极反应式:
(2)乙中负极为
(3)由此实验得出的下列结论中,正确的有
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
Ⅱ.化学电池在通信、交通及日常生活中有着广泛的应用。目前常用的镍镉(NiCd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O
 2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是①放电时Cd作正极 ②放电时Ni元素被还原
③充电时化学能转变为电能 ④放电时化学能转变为电能
Ⅲ.氢气和氧气可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式(当电解质溶液为NaOH(aq)或KOH(aq)时)两种。试回答下列问题:
(1)酸式电池的电极反应:正极
(2)碱式电池的电极反应:负极
您最近一年使用:0次
2019-06-10更新
|
561次组卷
|
4卷引用:甘肃省天水市武山县2023届高三上学期二模化学试题
2019·甘肃兰州·一模
6 . 根据下列信息,结合有关物质结构的知识回答:
(1)已知M是短周期金属元素,M的部分电离能如下表所示:

则M基态原子的电子排布式为___________ ,该金属晶体的堆积方式为六方最密堆积,配位数为___________ 。
(2)已知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且三种离子晶体的晶格能数据如下表所示:

则KC1、CaO、TiN三种离子晶体熔点由高到低的顺序为___________ ,原因是___________ 。
(3)根据下图回答:
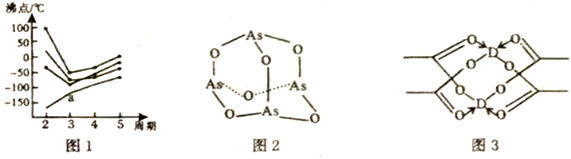
①如图1所示,每条折线表示周期表ⅣA~ⅦA中的某一主族元素的简单氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的物质是___________ (填化学式)。判断依据是___________ 。
②As4O6的分子结构如图2所示,则该化合物中As的杂化方式是___________ ,与AsO43-互为等电子体的微粒是___________ (写出一种即可)。
③D的醋酸盐晶体局部结构如图3所示,该晶体中含有的化学键类型有___________ (填字母标号)
A.极性键 B.非极性键 C.配位键 D.金属键
(4)Fe的一种晶体结构如图甲、乙所示,若按甲虚线方向切割乙,得到的截面图A~D中正确的是___________ (填字母标号)。

假设铁原子的半径是rcm,铁的相对原子质量为M,则该晶体的密度为___________ (设阿伏伽德罗常数的值为NA)
(1)已知M是短周期金属元素,M的部分电离能如下表所示:

则M基态原子的电子排布式为
(2)已知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且三种离子晶体的晶格能数据如下表所示:

则KC1、CaO、TiN三种离子晶体熔点由高到低的顺序为
(3)根据下图回答:

①如图1所示,每条折线表示周期表ⅣA~ⅦA中的某一主族元素的简单氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的物质是
②As4O6的分子结构如图2所示,则该化合物中As的杂化方式是
③D的醋酸盐晶体局部结构如图3所示,该晶体中含有的化学键类型有
A.极性键 B.非极性键 C.配位键 D.金属键
(4)Fe的一种晶体结构如图甲、乙所示,若按甲虚线方向切割乙,得到的截面图A~D中正确的是

假设铁原子的半径是rcm,铁的相对原子质量为M,则该晶体的密度为
您最近一年使用:0次
7 . 海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、______ 池和结晶池。
②工业上通常以NaCl 、CO2和 NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式____________________________________________________ 。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
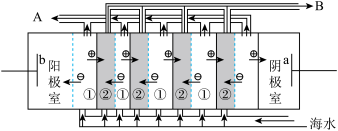
Ⅰ.电渗析法淡化海水中阴极室可获得的重要化工原料有___________________ 。
II.上图中虚线部分表示_________ 离子交换膜。 淡水从__________ (A或B)排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
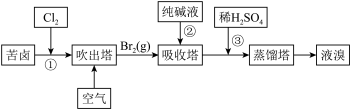
Ⅰ.写出反应③的离子方程式为____________________ 。
II.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?________ 。
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是___________ 。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、
②工业上通常以NaCl 、CO2和 NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:

Ⅰ.电渗析法淡化海水中阴极室可获得的重要化工原料有
II.上图中虚线部分表示
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:

Ⅰ.写出反应③的离子方程式为
II.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是
您最近一年使用:0次
2019-01-30更新
|
281次组卷
|
3卷引用:2015届甘肃省西北师大附中高三校四诊模拟化学试卷
名校
解题方法
8 . SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________ ,该反应中SO2表现出______ 性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________ ,该反应中SO2表现出__________ 性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________ ;
已知:
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________ ;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________ ,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________ 。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是
您最近一年使用:0次
2018-12-24更新
|
451次组卷
|
4卷引用:甘肃省天水市武山县2023届高三上学期二模化学试题
名校
9 . 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
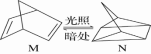
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH=+88.6 kJ·mol-1, 则M与N较稳定的是_________ 。
(2)已知CH3OH(l)的燃烧热为726.5 kJ·mol-1,CH3OH(l) +1/2 O2(g)===CO2(g)+2H2O(g) ΔH=-a kJ·mol-1,则a________ 726.5(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时放出145 kJ热量,写出该反应的热化学方程式:_____________________________________________ 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为__________ 。
(5)已知拆开1 mol H-H键、1 mol N-H键、1 mol N≡N 键分别需要的能量是a kJ、b kJ、c kJ,则N2与H2反应生成NH3的热化学方程式为_________________________________ 。
(6)通过以下反应可获得新型能源二甲醚(CH3OCH3)。
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1
则反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=__________________________________ 。(用含a,b,c,d的式子表示)
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH=+88.6 kJ·mol-1, 则M与N较稳定的是

(2)已知CH3OH(l)的燃烧热为726.5 kJ·mol-1,CH3OH(l) +1/2 O2(g)===CO2(g)+2H2O(g) ΔH=-a kJ·mol-1,则a
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时放出145 kJ热量,写出该反应的热化学方程式:
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为
(5)已知拆开1 mol H-H键、1 mol N-H键、1 mol N≡N 键分别需要的能量是a kJ、b kJ、c kJ,则N2与H2反应生成NH3的热化学方程式为
(6)通过以下反应可获得新型能源二甲醚(CH3OCH3)。
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1
则反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=
您最近一年使用:0次
2018-12-11更新
|
338次组卷
|
2卷引用:【全国百强校】甘肃省平凉市静宁县第一中学2019届高三上学期第三次模拟考试化学试题
名校
10 . 储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目________________________________ 。
(2)上述反应中氧化剂是______ (填化学式),被氧化的元素是________ (填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是____________ (填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_________ L。
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目
(2)上述反应中氧化剂是
(3)H2SO4 在上述反应中表现出来的性质是
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
2018-09-29更新
|
1013次组卷
|
4卷引用:【全国百强校】甘肃省静宁县第一中学2019届高三上学期第一次模拟考试化学试题



