1 . 寻找安全高效、低成本的储氢材料对于实现氢能经济具有重要意义,以下列举了三种常见的储氢材料。
I.氰基配合物Cu3[Co(CN)6]2·xH2O
(1)基态Cu原子的价层电子排布式为___________ 。
(2)H2O能参与配位的原因是___________ 。
(3)CN-中C为正价,从原子结构的角度说明理由___________ 。
II.三维多孔金属有机骨架材料MOFs
MOF-5的低温储氢性能非常优异,其晶体结构如下图所示。对苯二甲酸(BDC)作为有机配体,与无机基团[Zn4O]6+连接,化学式为 Zn4O(BDC)3。

(4)[Zn4O]6+中O原子的杂化轨道类型为___________ 。
(5)下列也可以作为有机配体与[Zn4O]6+连接形成三维多孔骨架的是___________ 。
A. B.
B.  C.
C.
III.金属氢化物
Mg2FeH6是非常有潜力的储氢材料。其晶胞形状为立方体,边长为a nm,如下图所示。

(6)Mg2FeH6晶胞中H原子个数为___________ 。
(7)已知Mg2FeH6的摩尔质量是M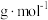 ,阿伏加德罗常数为NA,该晶体的密度为
,阿伏加德罗常数为NA,该晶体的密度为___________ 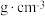 。(1 nm =
。(1 nm =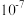 cm)
cm)
I.氰基配合物Cu3[Co(CN)6]2·xH2O
(1)基态Cu原子的价层电子排布式为
(2)H2O能参与配位的原因是
(3)CN-中C为正价,从原子结构的角度说明理由
II.三维多孔金属有机骨架材料MOFs
MOF-5的低温储氢性能非常优异,其晶体结构如下图所示。对苯二甲酸(BDC)作为有机配体,与无机基团[Zn4O]6+连接,化学式为 Zn4O(BDC)3。

(4)[Zn4O]6+中O原子的杂化轨道类型为
(5)下列也可以作为有机配体与[Zn4O]6+连接形成三维多孔骨架的是
A.
 B.
B.  C.
C.
III.金属氢化物
Mg2FeH6是非常有潜力的储氢材料。其晶胞形状为立方体,边长为a nm,如下图所示。

(6)Mg2FeH6晶胞中H原子个数为
(7)已知Mg2FeH6的摩尔质量是M
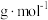 ,阿伏加德罗常数为NA,该晶体的密度为
,阿伏加德罗常数为NA,该晶体的密度为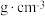 。(1 nm =
。(1 nm =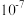 cm)
cm)
您最近一年使用:0次
名校
解题方法
2 . 以黄铜矿(主要成分为CuFeS2)为原料,用(NH4)2S2O8溶液作浸取剂提取铜。
已知:i.S2O 的结构式为
的结构式为 。
。
ii.CuFeS2、Ag2S均能导电。
(1)(NH4)2S2O8有强氧化性,用(NH4)2S2O8溶液作浸取剂浸出CuFeS2的原理示意图如下。

①正极的电极反应式为___________ 。
②浸取初期,随着浸泡时间延长,Cu2+的浸出速率提高。可能的原因是___________ 。
(2)在足量 (NH4)2S2O8溶液中添加少量AgNO3溶液作为浸取剂与CuFeS2作用,一段时间结果如下:
①结合离子方程式解释添加Ag+ 可以显著提高Cu元素的浸出率的原因:___________ 。
②进一步研究发现添加的少量Ag+ 可以多次循环使用,具有类似“催化剂”的作用。其中Ag+“再生”的离子方程式为:___________ 。
(3)进一步从浸出液中提取铜并使(NH4)2S2O8再生的流程示意图如下。

①在空气中焙烧FeC2O4得到铁红,反应的化学方程式为___________ 。
②由滤液B电解(Pt作电极)生成(NH4)2S2O8的总反应的离子方程式为___________ 。
③从能源及物质利用的角度,说明电解滤液B而不直接电解滤液A的优点:___________ 。
已知:i.S2O
 的结构式为
的结构式为 。
。ii.CuFeS2、Ag2S均能导电。
(1)(NH4)2S2O8有强氧化性,用(NH4)2S2O8溶液作浸取剂浸出CuFeS2的原理示意图如下。

①正极的电极反应式为
②浸取初期,随着浸泡时间延长,Cu2+的浸出速率提高。可能的原因是
(2)在足量 (NH4)2S2O8溶液中添加少量AgNO3溶液作为浸取剂与CuFeS2作用,一段时间结果如下:
| 添加Ag+ | 未加Ag+ | |
| Cu元素的浸出率 | 98.02% | 30.90% |
| 过程中产物形态 |  |  |
②进一步研究发现添加的少量Ag+ 可以多次循环使用,具有类似“催化剂”的作用。其中Ag+“再生”的离子方程式为:
(3)进一步从浸出液中提取铜并使(NH4)2S2O8再生的流程示意图如下。

①在空气中焙烧FeC2O4得到铁红,反应的化学方程式为
②由滤液B电解(Pt作电极)生成(NH4)2S2O8的总反应的离子方程式为
③从能源及物质利用的角度,说明电解滤液B而不直接电解滤液A的优点:
您最近一年使用:0次
2024-02-23更新
|
221次组卷
|
3卷引用:北京市第八中学2023-2024学年高三下学期零模化学试题
名校
解题方法
3 . 戊二醛( )是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
)是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
I.吡喃法制备戊二醛的反应步骤如下:
第一步:
第二步:CH2=CHCHO+CH2=CHOC2H5
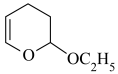
第三步: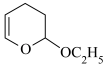
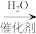

有关有机物性质如下表所示:
(1)分离第二步反应后混合物的方法是_______ 。
(2)第二步反应中有管道堵塞情况,分析原因。
原因1:产物在催化剂条件下发生开环聚合生成堵塞管道的物质。
原因2:反应物与产物反应生成堵塞管道的物质。写出 与
与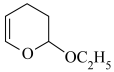 发生类似第二步反应所生成产物的结构简式:①
发生类似第二步反应所生成产物的结构简式:①_______ 。
原因3:②_______ 。
(3)该制备过程中可循环使用的物质是_______ 。
Ⅱ.在某催化剂下,用环戊烯( )法制备戊二醛的反应途径如下图所示。
)法制备戊二醛的反应途径如下图所示。
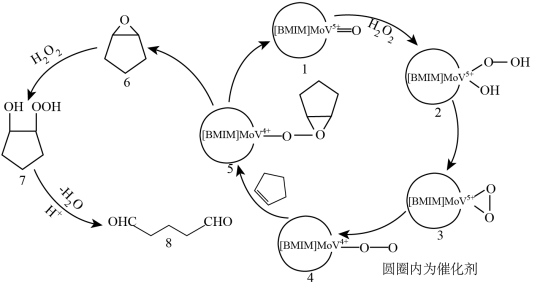
(4)过氧化氢氧化环戊烯的化学方程式为_______ 。
(5)已知过氧化氢用量过少、过多都降低戊二醛的选择性。请结合反应途径解释可能的原因:_______ 。
Ⅲ.测定戊二醛的含量:取 含戊二醛的样品液于
含戊二醛的样品液于 碘量瓶中。加入过量6.5%三乙醇胺
碘量瓶中。加入过量6.5%三乙醇胺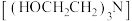 溶液
溶液 与盐酸羟胺
与盐酸羟胺 中性溶液
中性溶液 ,摇匀,静置反应
,摇匀,静置反应 。用
。用 硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液
硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液 。
。
以不含戊二醛的三乙醇胺、盐酸羟胺中性溶液重复上述操作,消耗硫酸标准液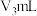 。
。
滴定过程中发生如下反应:
反应a: +
+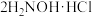 =
=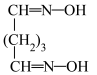 +2HCl+2H2O(反应较慢)
+2HCl+2H2O(反应较慢)
反应b: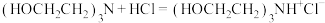
反应c: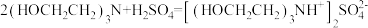
(6)该样品液中戊二醛的含量为_______  。(戊二醛的摩尔质量:
。(戊二醛的摩尔质量: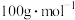 )
)
 )是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
)是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。I.吡喃法制备戊二醛的反应步骤如下:
第一步:

第二步:CH2=CHCHO+CH2=CHOC2H5


第三步:


有关有机物性质如下表所示:
| 结构简式 | 溶解性 | 密度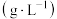 | 沸点( ) ) |
 | 溶于水 | 0.84 | 52.5 |
 | 微溶于水 | 0.753 | 33.0 |
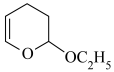 | 微溶于水 | 0.969 | 144.8 |
 | 溶于水 | 1.063 | 187.0 |
(2)第二步反应中有管道堵塞情况,分析原因。
原因1:产物在催化剂条件下发生开环聚合生成堵塞管道的物质。
原因2:反应物与产物反应生成堵塞管道的物质。写出
 与
与 发生类似第二步反应所生成产物的结构简式:①
发生类似第二步反应所生成产物的结构简式:①原因3:②
(3)该制备过程中可循环使用的物质是
Ⅱ.在某催化剂下,用环戊烯(
 )法制备戊二醛的反应途径如下图所示。
)法制备戊二醛的反应途径如下图所示。
(4)过氧化氢氧化环戊烯的化学方程式为
(5)已知过氧化氢用量过少、过多都降低戊二醛的选择性。请结合反应途径解释可能的原因:
Ⅲ.测定戊二醛的含量:取
 含戊二醛的样品液于
含戊二醛的样品液于 碘量瓶中。加入过量6.5%三乙醇胺
碘量瓶中。加入过量6.5%三乙醇胺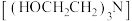 溶液
溶液 与盐酸羟胺
与盐酸羟胺 中性溶液
中性溶液 ,摇匀,静置反应
,摇匀,静置反应 。用
。用 硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液
硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液 。
。以不含戊二醛的三乙醇胺、盐酸羟胺中性溶液重复上述操作,消耗硫酸标准液
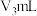 。
。滴定过程中发生如下反应:
反应a:
 +
+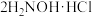 =
=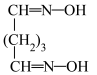 +2HCl+2H2O(反应较慢)
+2HCl+2H2O(反应较慢)反应b:
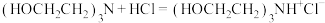
反应c:
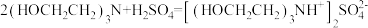
(6)该样品液中戊二醛的含量为
 。(戊二醛的摩尔质量:
。(戊二醛的摩尔质量: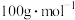 )
)
您最近一年使用:0次
2023-05-28更新
|
356次组卷
|
2卷引用:北京市十一学校2023届高三下学期三模化学试题
名校
解题方法
4 . 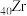 与
与 同族,
同族, 有3种常见晶胞结构,最为常见的是立方
有3种常见晶胞结构,最为常见的是立方 (晶胞为立方体)、四方
(晶胞为立方体)、四方 (晶胞为长方体,其底面为正方形),立方
(晶胞为长方体,其底面为正方形),立方 性质与钻石接近,可加工为璀璨夺目的饰品。
性质与钻石接近,可加工为璀璨夺目的饰品。___________ 。
(2)将氧氯化锆 配制成物质的量浓度为
配制成物质的量浓度为 的溶液,持续煮沸50小时后过滤,即可得到粉末状的
的溶液,持续煮沸50小时后过滤,即可得到粉末状的 ,制备
,制备 的化学方程式
的化学方程式___________ 。
(3)上图所示立方 的晶胞中,位于顶点的原子是
的晶胞中,位于顶点的原子是___________ 。
(4)上图所示四方 的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为
的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为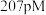 或
或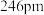 ,其余Zr原子距离明显远于
,其余Zr原子距离明显远于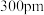 ,距离每个O原子“最近”的Zr原子共
,距离每个O原子“最近”的Zr原子共___________ 个。
(5)四方 升温至2370℃时转化为立方
升温至2370℃时转化为立方 ,两种晶体中Zr原子间最近距离均为
,两种晶体中Zr原子间最近距离均为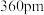 ,则四方
,则四方 转化为立方
转化为立方 时,密度
时,密度___________ (填“增大”“不变”或“减小”)。两种晶体中,密度较大的晶体的密度计算式为___________ 。(列出计算式即可。以 表示阿伏加德罗常数的值。)
表示阿伏加德罗常数的值。)
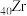 与
与 同族,
同族, 有3种常见晶胞结构,最为常见的是立方
有3种常见晶胞结构,最为常见的是立方 (晶胞为立方体)、四方
(晶胞为立方体)、四方 (晶胞为长方体,其底面为正方形),立方
(晶胞为长方体,其底面为正方形),立方 性质与钻石接近,可加工为璀璨夺目的饰品。
性质与钻石接近,可加工为璀璨夺目的饰品。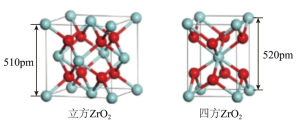
(2)将氧氯化锆
 配制成物质的量浓度为
配制成物质的量浓度为 的溶液,持续煮沸50小时后过滤,即可得到粉末状的
的溶液,持续煮沸50小时后过滤,即可得到粉末状的 ,制备
,制备 的化学方程式
的化学方程式(3)上图所示立方
 的晶胞中,位于顶点的原子是
的晶胞中,位于顶点的原子是(4)上图所示四方
 的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为
的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为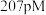 或
或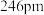 ,其余Zr原子距离明显远于
,其余Zr原子距离明显远于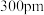 ,距离每个O原子“最近”的Zr原子共
,距离每个O原子“最近”的Zr原子共(5)四方
 升温至2370℃时转化为立方
升温至2370℃时转化为立方 ,两种晶体中Zr原子间最近距离均为
,两种晶体中Zr原子间最近距离均为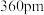 ,则四方
,则四方 转化为立方
转化为立方 时,密度
时,密度 表示阿伏加德罗常数的值。)
表示阿伏加德罗常数的值。)
您最近一年使用:0次
2023-05-27更新
|
345次组卷
|
2卷引用:北京市中国人民大学附属中学2023届高三三模化学试题
名校
5 . 制备纳米Fe并对其还原去除水中的硝酸盐污染物进行研究。
已知:i.纳米Fe具有很高的活性,易被氧化使表面形成氧化层
ii.纳米Fe将 还原为
还原为 的转化关系如下:
的转化关系如下:

(1)纳米Fe的制备原理: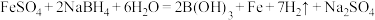 ,其中电负性H>B.反应中,氧化剂是
,其中电负性H>B.反应中,氧化剂是___________ 。
(2)酸性条件下,纳米Fe和 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是___________ 。
(3)检验溶液中 的操作和现象是
的操作和现象是___________ 。
(4)水体中含有的 与
与 反应,会降低
反应,会降低 的去除率。
的去除率。 与
与 反应的离子方程式是
反应的离子方程式是___________ 。
(5)溶液初始pH较低有利于 的去除,可能的原因是
的去除,可能的原因是___________ (答1条)。
(6)反应结束时,溶液的pH升高至10左右。一段时间内,纳米Fe还原 的产物分析如图。
的产物分析如图。 、
、 和
和
ii.总氮包括硝态氮、亚硝态氮和氨氮
iii.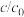 为溶液中粒子的物质的量浓度与初始
为溶液中粒子的物质的量浓度与初始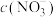 的比值
的比值
①溶液中只检出少量 ,从化学反应速率的角度解释原因:
,从化学反应速率的角度解释原因:___________ 。
②反应结束时,溶液中的总氮量小于初始时的总氮量,可能的原因是___________ 。
已知:i.纳米Fe具有很高的活性,易被氧化使表面形成氧化层
ii.纳米Fe将
 还原为
还原为 的转化关系如下:
的转化关系如下:
(1)纳米Fe的制备原理:
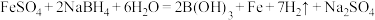 ,其中电负性H>B.反应中,氧化剂是
,其中电负性H>B.反应中,氧化剂是(2)酸性条件下,纳米Fe和
 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是(3)检验溶液中
 的操作和现象是
的操作和现象是(4)水体中含有的
 与
与 反应,会降低
反应,会降低 的去除率。
的去除率。 与
与 反应的离子方程式是
反应的离子方程式是(5)溶液初始pH较低有利于
 的去除,可能的原因是
的去除,可能的原因是(6)反应结束时,溶液的pH升高至10左右。一段时间内,纳米Fe还原
 的产物分析如图。
的产物分析如图。
 、
、 和
和
ii.总氮包括硝态氮、亚硝态氮和氨氮
iii.
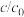 为溶液中粒子的物质的量浓度与初始
为溶液中粒子的物质的量浓度与初始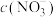 的比值
的比值①溶液中只检出少量
 ,从化学反应速率的角度解释原因:
,从化学反应速率的角度解释原因:②反应结束时,溶液中的总氮量小于初始时的总氮量,可能的原因是
您最近一年使用:0次
2023-05-11更新
|
635次组卷
|
5卷引用:北京市西城区2023届高三二模化学试题
北京市西城区2023届高三二模化学试题北京市第一七一中学2023-2024学年高三上学期10月考化学试题(已下线)北京市第四中学2023-2024学年高三上学期期中考试化学试题(已下线)北京市第四中学2023-2024学年高三上学期 期中化学试卷(已下线)FHgkyldyjhx08
名校
解题方法
6 . 我国科学家发现催化剂 可高效活化
可高效活化 ,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。
,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。

(1)Fe元素在元素周期表中的位置是___________ 。
(2)污染物X在电极a上的反应式是___________ 。
(3)科研团队研究了X分别为 、
、 和
和 [也可以写作
[也可以写作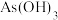 ]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
①基态As原子的价层电子排布式是___________ 。
② 中的键角
中的键角___________ (填“>”“<”或“=”) 中的键角。
中的键角。
③ 的结构是
的结构是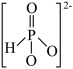 ,P原子的杂化轨道类型是
,P原子的杂化轨道类型是___________ 。
(4)比较反应能力:
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
(5) 晶胞的体积为
晶胞的体积为 ,晶体密度为
,晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,一个晶胞中Fe原子的个数为
,一个晶胞中Fe原子的个数为___________ ( 的摩尔质量:160g/mol)。
的摩尔质量:160g/mol)。
 可高效活化
可高效活化 ,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。
,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。
(1)Fe元素在元素周期表中的位置是
(2)污染物X在电极a上的反应式是
(3)科研团队研究了X分别为
 、
、 和
和 [也可以写作
[也可以写作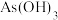 ]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
]的反应能力,发现中心原子含有孤电子对的物质易被氧化。①基态As原子的价层电子排布式是
②
 中的键角
中的键角 中的键角。
中的键角。③
 的结构是
的结构是 ,P原子的杂化轨道类型是
,P原子的杂化轨道类型是(4)比较反应能力:

 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是(5)
 晶胞的体积为
晶胞的体积为 ,晶体密度为
,晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,一个晶胞中Fe原子的个数为
,一个晶胞中Fe原子的个数为 的摩尔质量:160g/mol)。
的摩尔质量:160g/mol)。
您最近一年使用:0次
2023-05-11更新
|
816次组卷
|
4卷引用:北京市西城区2023届高三二模化学试题
名校
7 . 正极材料为LiCoO2的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应除了得到LiFePO4外,还有另外一种酸式盐产物,请写出共沉淀的化学方程式为_______ 。
②高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善诚信后的LiFePO4的导电性能外,还能_______ 。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O 被氧化成SO
被氧化成SO ,LiCoO2在溶解过程中反应的化学方程式为
,LiCoO2在溶解过程中反应的化学方程式为_______ 。
②已知Co的氧化物与Fe的氧化物类似。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_______ (填化学式),在350~400℃范围内,剩余固体的成分为_______ (填化学式)。

(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应除了得到LiFePO4外,还有另外一种酸式盐产物,请写出共沉淀的化学方程式为
②高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善诚信后的LiFePO4的导电性能外,还能
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O
 被氧化成SO
被氧化成SO ,LiCoO2在溶解过程中反应的化学方程式为
,LiCoO2在溶解过程中反应的化学方程式为②已知Co的氧化物与Fe的氧化物类似。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为

您最近一年使用:0次
2023-04-26更新
|
179次组卷
|
2卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
名校
8 . 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式_______ (如果系数是1,不用填写):

(2)整个过程中的还原剂是_______ 。
(3)把KI换成KBr,则CCl4层变为_______ 色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_______ 。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)500kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2_______ L(标准状况,保留2位小数)。
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式

(2)整个过程中的还原剂是
(3)把KI换成KBr,则CCl4层变为
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)500kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2
您最近一年使用:0次
2023-04-26更新
|
297次组卷
|
3卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
名校
9 . 制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol•L-1硫酸铝酸性溶液,经检验,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5(温室下,0.1 mol•L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_______ 。
(2)往溶液中加入H2O2的作用是_______ (用离子方程式表示)。
(3)加入的X试剂(填选项编号)是_______ 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是_______ 。
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为
(2)往溶液中加入H2O2的作用是
(3)加入的X试剂(填选项编号)是
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
您最近一年使用:0次
10 . 以下是有关胶体性质的实验探究,回答相关的问题。
Fe(OH)3胶体的制备:
(1)实验室制取Fe(OH)3胶体的方法是_______ ;该反应的离子方程式是:_______ 。制备Fe(OH)3胶体用到的FeCl3溶解在盐酸溶液中制备得到,需要用盐酸溶液的理由是:_______ 。
(2)制备得到的Fe(OH)3胶体体系具有的性质是_______ (填写序号字母)。
a.光束通过该液体的形成光亮的“通路”
b.静止一段时间后,该红褐色液体仍然澄清透明
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在分离和提纯Fe(OH)3胶体时用到的方法是:_______ (填分离操作的名称)。
Fe(OH)3胶体的制备:
(1)实验室制取Fe(OH)3胶体的方法是
(2)制备得到的Fe(OH)3胶体体系具有的性质是
a.光束通过该液体的形成光亮的“通路”
b.静止一段时间后,该红褐色液体仍然澄清透明
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在分离和提纯Fe(OH)3胶体时用到的方法是:
您最近一年使用:0次



