解题方法
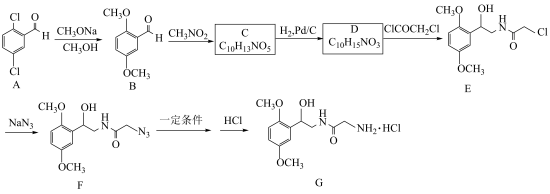
1 . 有机物G是一种选择性作用于α受体的激动剂,其一种合成路线如图所示:
(1) 中
中 的结构如图所示,其中存在的两个大π键可用符号
的结构如图所示,其中存在的两个大π键可用符号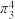 表示,1个
表示,1个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为_______ 。_______ 。
(3)C的结构简式为_______ 。
(4)C转化为E的过程中,发生反应的类型依次是_______ 、_______ 。
(5)G发生水解反应的产物之一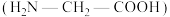 能发生自身的缩聚反应,写出该缩聚反应的化学方程式:
能发生自身的缩聚反应,写出该缩聚反应的化学方程式:_______ (不要求书写反应条件)。
(6)M在分子组成上比C多两个“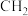 ”原子团,M同时具有如下结构与性质:
”原子团,M同时具有如下结构与性质:
ⅰ.含有苯环且苯环上有四个取代基,其中有三个是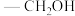
ⅱ.含有 且属于两性化合物
且属于两性化合物
M的可能结构有_______ 种(不考虑立体异构)。
(7)已知: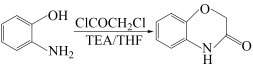 。根据上述合成路线和相关信息,设计以
。根据上述合成路线和相关信息,设计以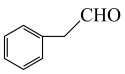 和流程中相关试剂为原料制备
和流程中相关试剂为原料制备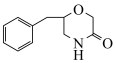 的合成路线:
的合成路线:_______ (其他试剂任选)。
(1)
 中
中 的结构如图所示,其中存在的两个大π键可用符号
的结构如图所示,其中存在的两个大π键可用符号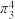 表示,1个
表示,1个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为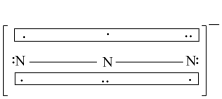
(3)C的结构简式为
(4)C转化为E的过程中,发生反应的类型依次是
(5)G发生水解反应的产物之一
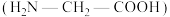 能发生自身的缩聚反应,写出该缩聚反应的化学方程式:
能发生自身的缩聚反应,写出该缩聚反应的化学方程式:(6)M在分子组成上比C多两个“
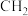 ”原子团,M同时具有如下结构与性质:
”原子团,M同时具有如下结构与性质:ⅰ.含有苯环且苯环上有四个取代基,其中有三个是
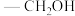
ⅱ.含有
 且属于两性化合物
且属于两性化合物M的可能结构有
(7)已知:
 。根据上述合成路线和相关信息,设计以
。根据上述合成路线和相关信息,设计以 和流程中相关试剂为原料制备
和流程中相关试剂为原料制备 的合成路线:
的合成路线:
您最近一年使用:0次
2024-05-30更新
|
153次组卷
|
2卷引用:2024届山西省天一大联考高三下学期考前模拟考试理科综合试题-高中化学
2 . 工业上常用合成气(主要成分为CO、H2及少量CO2、H2O)制备甲醇,然后再利用甲醇合成其它化工产品,部分合成原理如下图所示:
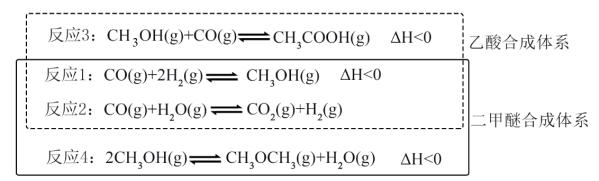
回答下列问题:
(1)反应2为副反应,为了减少该副反应的发生,提高反应1的选择性,要优先考虑_______ ,已知298K时,由稳定态单质生成1mol化合物的焓变叫该物质在此温度下的标准生成焓( )。下表为几种物质的标准生成焓,反应2的ΔH=
)。下表为几种物质的标准生成焓,反应2的ΔH=_______ kJ·mol-1
(2)500K温度下,在2L的刚性容器中充入4molCO和8molH2制备二甲醚(忽略反应2的发生),4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3)。
①从开始到平衡,反应1的v(H2)=_______ mol·L-1·min-1。
②反应4中甲醇的转化率为_______ ,反应1的平衡常数Kc=_______ 。
(3)在T2K、1.0×104kPa下,等物质的量的CO与CH3OH混合气体只发生反应3。反应速率v正-v逆=k正·p(CO)·p(CH3OH)-k逆·p(CH3COOH),k正、k逆分别为正、逆反应的速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,当CO的转化率为20%时, =
=________ 。
(4)对于反应2(不考虑其他反应),若CO和CO2的浓度随时间发生变化的曲线如图所示。则t2时刻改变的条件可能是_______ (任写一种),若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质_________ (假设各物质状态均保持不变)。


回答下列问题:
(1)反应2为副反应,为了减少该副反应的发生,提高反应1的选择性,要优先考虑
 )。下表为几种物质的标准生成焓,反应2的ΔH=
)。下表为几种物质的标准生成焓,反应2的ΔH=| 物质 | CO2(g) | CO(g) | H2O(g) |
 (kJ·mol-1) (kJ·mol-1) | -394 | -111 | -242 |
①从开始到平衡,反应1的v(H2)=
②反应4中甲醇的转化率为
(3)在T2K、1.0×104kPa下,等物质的量的CO与CH3OH混合气体只发生反应3。反应速率v正-v逆=k正·p(CO)·p(CH3OH)-k逆·p(CH3COOH),k正、k逆分别为正、逆反应的速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,当CO的转化率为20%时,
 =
=(4)对于反应2(不考虑其他反应),若CO和CO2的浓度随时间发生变化的曲线如图所示。则t2时刻改变的条件可能是

您最近一年使用:0次
2022-06-13更新
|
524次组卷
|
2卷引用:山西省晋城市2022届高三下学期第二次模拟考试理科综合化学试题
解题方法
3 . 乳酸薄荷醇酯广泛应用于化妆品和食品等行业中。实验室以薄荷醇和乳酸为原料直接反应制备乳酸薄荷醇酯的化学方程式为:
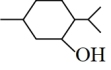 +
+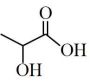
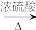
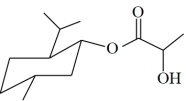 +H2O
+H2O
主要实验装置示意图和有关数据如下:
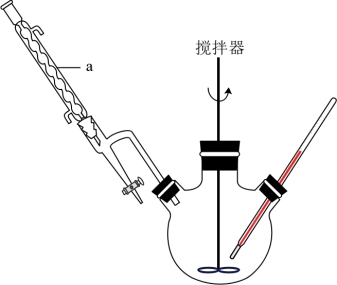
实验步骤如下:
Ⅰ.合成:在带有温度计、分水器、搅拌器的250mL三颈烧瓶中加入薄荷醇15.6g、90%乳酸23.5 g、浓硫酸0.1 g、甲苯50 g,加热到120℃,加热回流2.5 h。
Ⅱ.分离与提纯:降温冷却后放出水层,有机层与反应液合并,将合并液分别用20 mL10%碳酸钠溶液洗涤两次、去离子水洗涤两次,干燥,减压蒸馏,得到产品13.7 g。
回答下列问题:
(1)仪器a的名称是_______ ,在以 上“合成”步骤中需控制反应温度120℃的原因可能是_______ 。
(2)实验中加入过量乳酸的目的是_______ 。 ;分水器的作用主要是_______ 。
(3)甲苯的作用之一是带出生成的水,另一个作用是_______ ;若采用环己烷替代甲苯,其优点是_______ 。
(4)在“分离与提纯”步骤中,水层应从分液漏斗的_______ (填“ 上口”或“下口”)放出,用碳酸钠溶液洗涤的主要目的是_______ 。
(5)“减压蒸馏”的目的是_______ 。
(6)本实验中乳酸薄荷醇酯的产率约为_______ 。 (结果保留两位有效数字)
 +
+
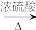
 +H2O
+H2O主要实验装置示意图和有关数据如下:

| 物质 | 乳酸 | 薄荷醇 | 乳酸薄荷醇酯 | 甲苯(有毒) |
| 相对分子质量 | 90 | 156 | 228 | 92 |
| 密度/(g·cm-3) | 1.25 | 0.89 | 0.976 | 0.89 |
| 熔点/℃ | 16.8 | 43 | -47 | -94.9 |
| 沸点/℃ | 122 | 103 | 142 | 110.6 |
| 溶解性 | 易溶水和有机溶剂 | 微溶于水,易溶于有机溶剂 | 微溶于水,易溶于有 机溶剂 | 不溶于水,可作有 机溶剂 |
Ⅰ.合成:在带有温度计、分水器、搅拌器的250mL三颈烧瓶中加入薄荷醇15.6g、90%乳酸23.5 g、浓硫酸0.1 g、甲苯50 g,加热到120℃,加热回流2.5 h。
Ⅱ.分离与提纯:降温冷却后放出水层,有机层与反应液合并,将合并液分别用20 mL10%碳酸钠溶液洗涤两次、去离子水洗涤两次,干燥,减压蒸馏,得到产品13.7 g。
回答下列问题:
(1)仪器a的名称是
(2)实验中加入过量乳酸的目的是
(3)甲苯的作用之一是带出生成的水,另一个作用是
(4)在“分离与提纯”步骤中,水层应从分液漏斗的
(5)“减压蒸馏”的目的是
(6)本实验中乳酸薄荷醇酯的产率约为
您最近一年使用:0次
4 . 工业废水中常含有一定量的 ,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将
,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将 转化为
转化为 ,再将
,再将 转化为
转化为 沉淀。
沉淀。
(1)利用硫酸工业废气中的 可以处理酸性含铬废水,用离子方程式表示反应原理:
可以处理酸性含铬废水,用离子方程式表示反应原理:___________ 。
(2)常温下,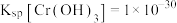 ,除去被
,除去被 还原所得溶液中的
还原所得溶液中的 [使
[使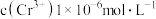 ],需调节溶液的pH至少为
],需调节溶液的pH至少为___________ 。
(3) 和
和 类似,也是两性氢氧化物。写出
类似,也是两性氢氧化物。写出 的酸式电离方程式:
的酸式电离方程式:___________ 。
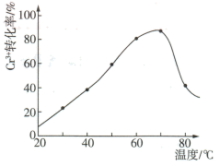
(4) 在强碱中可被
在强碱中可被 氧化为
氧化为 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。控制其他条件不变,反应温度对 转化率的影响如图所示。请分析温度超过70℃时
转化率的影响如图所示。请分析温度超过70℃时 转化率下降的原因:
转化率下降的原因:___________
 ,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将
,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将 转化为
转化为 ,再将
,再将 转化为
转化为 沉淀。
沉淀。(1)利用硫酸工业废气中的
 可以处理酸性含铬废水,用离子方程式表示反应原理:
可以处理酸性含铬废水,用离子方程式表示反应原理:(2)常温下,
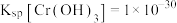 ,除去被
,除去被 还原所得溶液中的
还原所得溶液中的 [使
[使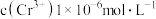 ],需调节溶液的pH至少为
],需调节溶液的pH至少为(3)
 和
和 类似,也是两性氢氧化物。写出
类似,也是两性氢氧化物。写出 的酸式电离方程式:
的酸式电离方程式:(4)
 在强碱中可被
在强碱中可被 氧化为
氧化为 ,发生反应的离子方程式为
,发生反应的离子方程式为 转化率的影响如图所示。请分析温度超过70℃时
转化率的影响如图所示。请分析温度超过70℃时 转化率下降的原因:
转化率下降的原因:
您最近一年使用:0次
2021-08-01更新
|
384次组卷
|
5卷引用:山西省实验中学2018届高三上学期学业质量监测化学试题
山西省实验中学2018届高三上学期学业质量监测化学试题人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡选择性必修1(SJ)专题3第四单元 沉淀溶解平衡(已下线)3.4.2 沉淀溶解平衡的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第八章 水溶液中的离子平衡(测)-2023年高考化学一轮复习讲练测(全国通用)
5 . 山西老陈醋是中国四大名醋之首,食醋的主要成分为醋酸。已知:25℃时CH3COOH的电离常数Ka=1.8×10-5。请回答:
(1)25℃时,pH=2的醋酸溶液中,c(H+)______ ;将其加水稀释, 的值将
的值将______ (填“增大”“减小”或“无法判断”)。
(2)醋酸钠溶液呈碱性的原因是______ (用离子方程式表示),溶液中各离子浓度由大到小的顺序为______ 。
(3)已知25℃时,H2S的Ka1=1.3×10-7、Ka2=7.1×10-15、,则25℃时等浓度的CH3COONa、Na2S两种溶液的碱性较强的是______ 。
(4)日常生活中可用醋酸除水垢,但工业锅炉的水垢中常含有硫酸钙,需先用Na2CO3溶液处理,最后再用NH4Cl溶液除去。已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(CaSO4)=9.1×10-6、,结合化学平衡原理解释加入Na2CO3溶液的原因:______ (用溶解平衡表达式和必要的文字叙述加以说明)。
(1)25℃时,pH=2的醋酸溶液中,c(H+)
 的值将
的值将(2)醋酸钠溶液呈碱性的原因是
(3)已知25℃时,H2S的Ka1=1.3×10-7、Ka2=7.1×10-15、,则25℃时等浓度的CH3COONa、Na2S两种溶液的碱性较强的是
(4)日常生活中可用醋酸除水垢,但工业锅炉的水垢中常含有硫酸钙,需先用Na2CO3溶液处理,最后再用NH4Cl溶液除去。已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(CaSO4)=9.1×10-6、,结合化学平衡原理解释加入Na2CO3溶液的原因:
您最近一年使用:0次
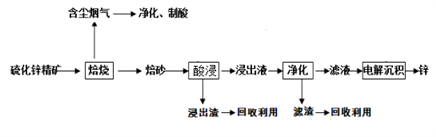
6 . 锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某硫化锌精矿的主要成分是ZnS (还含有少量FeS等其它成分),以其为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________ 。
浸出液净化过程中加入的主要物质是锌粉,其作用是___________________ 。
(2)电解沉积过程中的阴极采用铝板,阳极采用情性电极,阳极的电极反应式是______________ 。
(3)在该流程中可循环使用的物质是Zn和_________ 。
(4)改逬的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生主要反应的离子方程式为_________________ 。
(5)硫化锌精矿(ZnS )遇到硫酸铜溶液可慢慢的转化为铜蓝(CuS)。请解释该反应发生的原理______________________________________________________ 。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一尼罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火锻红,….,冷淀,毀罐取出,…即倭铅也。”该炼锌工艺主要反应的化学方程式为__________________________ (注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)。
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为
浸出液净化过程中加入的主要物质是锌粉,其作用是
(2)电解沉积过程中的阴极采用铝板,阳极采用情性电极,阳极的电极反应式是
(3)在该流程中可循环使用的物质是Zn和
(4)改逬的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生主要反应的离子方程式为
(5)硫化锌精矿(ZnS )遇到硫酸铜溶液可慢慢的转化为铜蓝(CuS)。请解释该反应发生的原理
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一尼罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火锻红,….,冷淀,毀罐取出,…即倭铅也。”该炼锌工艺主要反应的化学方程式为
您最近一年使用:0次
7 . 目前很多工厂实现了烟气的脱硫脱硝和氨氮废水的无害化处理,回答下列问题:
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO )的浓度也随之变大,写出该反应的离子方程式:
)的浓度也随之变大,写出该反应的离子方程式:___ 。
②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
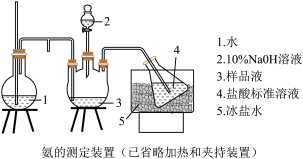
NH4Cl的电子式为___ 。盛放样品液的仪器是___ (填名称);圆底烧瓶中长玻璃导管的作用是___ ;冰盐水的作用是___ 。
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是___ 。
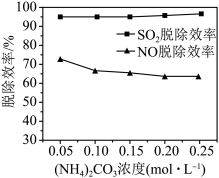
②NO脱除效率总是小于SO2脱除效率的主要原因是___ 。(写出一点)
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:
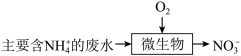
下列有关说法正确的是___ (填标号)。
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH 直接转化为NO
直接转化为NO
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH
 )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO )的浓度也随之变大,写出该反应的离子方程式:
)的浓度也随之变大,写出该反应的离子方程式:②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。

NH4Cl的电子式为
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是

②NO脱除效率总是小于SO2脱除效率的主要原因是
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:

下列有关说法正确的是
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH
 直接转化为NO
直接转化为NO
您最近一年使用:0次
10-11高一下·内蒙古赤峰·期末
名校
8 . 现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________ 热反应,且m+n______ p(填“>”、“=”或“<”)。
(2)减压时,A的质量分数__________ 。(填“增大”、“减小”或“不变”,下同)
(3)若容积不变加入B,则A的转化率__________ ,B的转化率__________ 。
(4)若升高温度,则平衡时B、C的浓度之比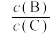 将
将__________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________ 。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________ ;而维持容器内压强不变,充入氖气时,混合物颜色__________ 。(填“变深”、“变浅”或“不变”)
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的逆反应为
(2)减压时,A的质量分数
(3)若容积不变加入B,则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比
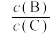 将
将(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色
您最近一年使用:0次
2020-04-27更新
|
263次组卷
|
20卷引用:【全国校级联考】山西省汾阳市第二高级中学、文水县第二高级中学2016-2017学年高二上学期第一次联考化学试题
【全国校级联考】山西省汾阳市第二高级中学、文水县第二高级中学2016-2017学年高二上学期第一次联考化学试题(已下线)2010—2011学年内蒙古赤峰二中高一下学期期末考试化学试卷(已下线)2011-2012学年江西省赣县中学南北校区高二9月份联考化学试卷(已下线)2011-2012年河南省郑州市智林学校高二上学期10月份月考化学试卷(已下线)2013-2014学年河北省遵化市高二上学期期中质量检测化学试卷(已下线)2014届四川省雅安中学高二下学期4月月考化学试卷(已下线)2013-2014四川省雅安中学高二4月月考化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷2014-2015四川省雅安中学高二下学期开学考试化学试卷山东省曲阜师范大学附属中学2017-2018学年高二上学期期中考试化学试题甘肃省甘谷县第一中学2018-2019学年高二上学期第一次月考子材班化学试题2018-2019学年人教版高中化学选修四章化学反应速率和化学平衡末综合测评(二)(已下线)2018年10月23日 《每日一题》人教选修4--化学平衡移动的判断陕西省蓝田县焦岱中学2018-2019学年高二上学期第一次月考化学试题安徽省合肥市一六八中学2018-2019学年高二上学期期中考试化学试题江苏省东海县第二中学2019-2020学年高二下学期第一次学分认定测试化学试题安徽省阜阳市大田中学2018-2019学年高二下学期期中考试化学试题湖南省宁乡县第七中学2020-2021学年高二10月月考化学试题云南省保山第九中学2019-2020学年高二下学期期末考试化学试题内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二下学期开学考试化学试题
名校
解题方法
9 . 现有五种可溶性物质 A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子 Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子 NO3-、OH-、Cl-、CO32-、Xn-(n = 1 或 2)中的一种。
(1)通过比较分析,无需检验就可判断其中必有的两种物质是________ 和 _______ 。
(2)物质 C 中含有离子 Xn-。为了确定 Xn-,现将(1)中的两种物质记为 A 和 B,当 C 与 A 的溶液混合时产生白色沉淀,继续加入过量 A 溶液白色沉淀部分溶解,然后将沉淀中滴入足量稀 HCl,白色沉淀不溶解,则 C 为______ (填化学式)。写出部分白色沉淀溶解的离子方程式 ______ 。
(3)将 19.2 g Cu 投入装有足量 D 溶液的试管中,Cu 不溶解,再滴加稀 H2SO4,Cu 逐渐溶解,管口附近有红棕色气体出现,则物质 D 一定含有上述离子中的________ (填相应的离子符号),写出 Cu 溶解的离子方程式 _________ ,若要将 Cu 完全溶解,至少加入 H2SO4 的物质的量是__________ 。
(4)E 溶液与氢碘酸反应时可生成使淀粉变蓝的物质,写出该反应的化学方程式为_________ 。
(1)通过比较分析,无需检验就可判断其中必有的两种物质是
(2)物质 C 中含有离子 Xn-。为了确定 Xn-,现将(1)中的两种物质记为 A 和 B,当 C 与 A 的溶液混合时产生白色沉淀,继续加入过量 A 溶液白色沉淀部分溶解,然后将沉淀中滴入足量稀 HCl,白色沉淀不溶解,则 C 为
(3)将 19.2 g Cu 投入装有足量 D 溶液的试管中,Cu 不溶解,再滴加稀 H2SO4,Cu 逐渐溶解,管口附近有红棕色气体出现,则物质 D 一定含有上述离子中的
(4)E 溶液与氢碘酸反应时可生成使淀粉变蓝的物质,写出该反应的化学方程式为
您最近一年使用:0次
2019-11-05更新
|
199次组卷
|
4卷引用:山西省吕梁市2020届高三10月模拟化学试题
2012·山西·模拟预测
解题方法
10 . 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是_______ 。
(2)已知:2Cu(s)+ O2(g)=Cu2O(s) △H = -akJ·mol-1
O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+ O2(g)=CO(g) △H = -bkJ·mol-1
O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+ O2(g)=CuO(s) △H = -ckJ·mol-1
O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_______ kJ·mol-1。
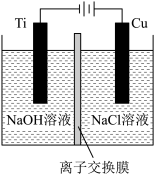
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为_______ 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为_______ 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: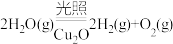 △H >0
△H >0
水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是_______ (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是
(2)已知:2Cu(s)+
 O2(g)=Cu2O(s) △H = -akJ·mol-1
O2(g)=Cu2O(s) △H = -akJ·mol-1C(s)+
 O2(g)=CO(g) △H = -bkJ·mol-1
O2(g)=CO(g) △H = -bkJ·mol-1Cu(s)+
 O2(g)=CuO(s) △H = -ckJ·mol-1
O2(g)=CuO(s) △H = -ckJ·mol-1则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
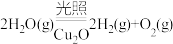 △H >0
△H >0水蒸气的浓度随时间t变化如下表所示。
| 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
您最近一年使用:0次



