名校
解题方法
1 . 化学反应中的热量问题,对于化工生产有重要的意义
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H=_______ kJ/mol。
(2)已知在微生物作用条件下, 经过两步反应被氧化成
经过两步反应被氧化成 ,两步反应的能量变化示意图如下。
,两步反应的能量变化示意图如下。 (aq)全部被氧化成
(aq)全部被氧化成 (aq)的热化学方程式为:
(aq)的热化学方程式为:_______ 。
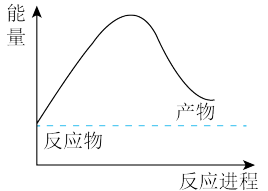
(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为_______ (填“吸热”或“放热”)反应。 _______ kJ(用含a、b、c、d的代数式表示)。
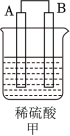
(4)室温下,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示装置中进行中和反应。回答下列问题:_______ ,保持其他条件不变,实验中改用100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液进行反应,与上述实验相比,二者所测的中和热_______ (填“相等”或“不相等”),原因是_______ 。
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为_______ 。
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H=_______ kJ/mol(已知该温度下水的比热容:c=4.18J/(g·℃),保留三位有效数字)。
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H=
(2)已知在微生物作用条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 ,两步反应的能量变化示意图如下。
,两步反应的能量变化示意图如下。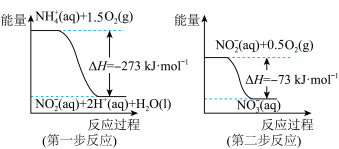
 (aq)全部被氧化成
(aq)全部被氧化成 (aq)的热化学方程式为:
(aq)的热化学方程式为:(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |
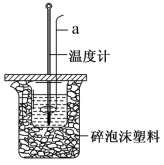
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H=
您最近一年使用:0次
名校
解题方法
2 . 利用电化学装置原理可以设计出许多应用于环境保护、化学品提取的装置。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。_______ 极, 电极b表面发生的电极反应为_______ 。
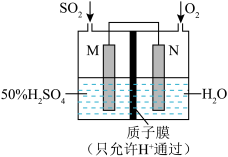
(2)可用电化学原理处理SO2制备硫酸并提供电能,装置如图,电极为多孔材料。写出M极的电极方程式:_______ ,外电路中电流方向为:_______ (填“从M到N”或者“从N到M”)_______ 。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。

(2)可用电化学原理处理SO2制备硫酸并提供电能,装置如图,电极为多孔材料。写出M极的电极方程式:

您最近一年使用:0次
名校
解题方法
3 . 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。
(1)正四面体烷的分子式为___________ ,其二氯取代产物有___________ 种。
(2)关于乙烯基乙炔分子的说法错误的是___________ 。
a.能使酸性KMnO4溶液褪色
b.1mol乙烯基乙炔能与3mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:___________ 。
(4)以乙炔为主要原料,自选必要的无机试剂,合成聚氯乙烯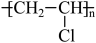 ,试写出有关化学反应方程式:
,试写出有关化学反应方程式:___________ 。

(1)正四面体烷的分子式为
(2)关于乙烯基乙炔分子的说法错误的是
a.能使酸性KMnO4溶液褪色
b.1mol乙烯基乙炔能与3mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:
(4)以乙炔为主要原料,自选必要的无机试剂,合成聚氯乙烯
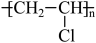 ,试写出有关化学反应方程式:
,试写出有关化学反应方程式:
您最近一年使用:0次
4 . 氮氧化物是主要的大气污染物之一,可用一氧化碳或活性炭还原氮氧化物,减少大气污染。回答下列问题:
(1)一定条件下,CO与NO反应生成两种无污染的气体,反应的化学方程式为2CO(g)+2NO(g)=N2(g)+2CO2(g),生成1mol N2(g),转移电子的物质的量为___________ mol,为提高该反应的化学反应速率,下列措施可行的是 ___________ (填字母)。
A.压缩容器体积 B.降低温度 C.使用合适催化剂 D.恒温恒容充入稀有气体
(2)两个10L的密闭容器中分别都加入活性炭(足量)和1.0mol NO,发生反应:C(s)+2NO(g)=N2(g)+CO2(g)。实验测得,两容器中在不同温度下NO和N2的物质的量变化见下表:
①T1℃时,0~5min内,反应速率v(CO2)=___________ mol•L-1•min-1。
②T2℃时,按表中数据,反应一定达到化学平衡状态的时间段是___________ min~10min,此时,容器中CO2的物质的量浓度是___________ mol•L-1,NO的平衡转化率为___________ 。
③两容器中温度关系为T1___________ (填“>”“<”或“=”)T2。
(1)一定条件下,CO与NO反应生成两种无污染的气体,反应的化学方程式为2CO(g)+2NO(g)=N2(g)+2CO2(g),生成1mol N2(g),转移电子的物质的量为
A.压缩容器体积 B.降低温度 C.使用合适催化剂 D.恒温恒容充入稀有气体
(2)两个10L的密闭容器中分别都加入活性炭(足量)和1.0mol NO,发生反应:C(s)+2NO(g)=N2(g)+CO2(g)。实验测得,两容器中在不同温度下NO和N2的物质的量变化见下表:
| 物质的量/mol | 容器1(T1/℃) | 容器2(T2/℃) | |||||||
| 0 | 5min | 9min | 10min | 12min | 0 | 5min | 9min | 10min | |
| NO | 1.0 | 0.58 | 0.42 | 0.40 | 0.40 | 1.0 | 0.50 | 0.34 | 0.34 |
| N2 | 0 | 0.21 | 0.29 | 0.30 | 0.30 | 0 | 0.25 | 0.33 | 0.33 |
②T2℃时,按表中数据,反应一定达到化学平衡状态的时间段是
③两容器中温度关系为T1
您最近一年使用:0次
解题方法
5 . 电池在日常生活中使用越来越广泛。回答下列问题:
(1)燃料电池是一种高效、环境友好的供电装置,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。___________ (填“A”或“B”)口通入。
②b极的电极反应式为___________ 。
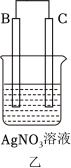
(2) A、B、C、D四种金属按下表中装置进行实验。
①装置甲溶液中的阴离子移向 ___________ (填“A”或“B”)极。
②装置乙中正极的电极反应式为___________ 。
③四种金属活动性由强到弱的顺序是___________ 。
(3)锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是___________ ;当导线中有0.4mol电子通过时,理论上消耗的O2在标准状况下的体积是 ___________ L。
(1)燃料电池是一种高效、环境友好的供电装置,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。
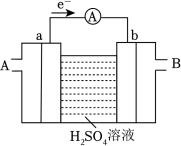
②b极的电极反应式为
(2) A、B、C、D四种金属按下表中装置进行实验。
| 装置 |
|
|
|
| 现象 | B表面产生气泡 | C质量增加 | D极不断溶解 |
②装置乙中正极的电极反应式为
③四种金属活动性由强到弱的顺序是
(3)锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是
您最近一年使用:0次
名校
解题方法
6 . 一定条件下,O2得电子转化为超氧自由基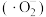 ,并实现如图所示的转化:
,并实现如图所示的转化:
(1)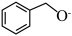 中有
中有___________ 种不同化学环境的氢原子。
(2)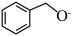 转化为
转化为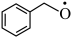 是
是___________ (填“氧化”或“还原”)反应。
(3)写出图示转化总反应的化学方程式:___________ 。
(4)用现代仪器区分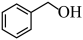 与
与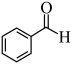 的方法是
的方法是___________ 。
(5)已知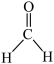 分子中所有原子都在同一平面内,则
分子中所有原子都在同一平面内,则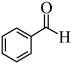 中至多有
中至多有___________ 个原子共平面。
(6)已知10.8g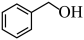 在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重
在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重___________ g和___________ g。
(7)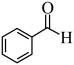 继续氧化产物(C7H6O2)与
继续氧化产物(C7H6O2)与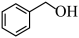 反应的化学方程式:
反应的化学方程式:___________ 。
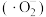 ,并实现如图所示的转化:
,并实现如图所示的转化: 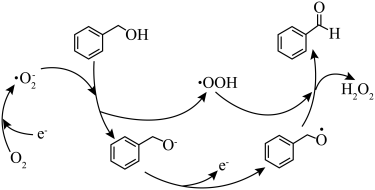
(1)
 中有
中有(2)
 转化为
转化为 是
是(3)写出图示转化总反应的化学方程式:
(4)用现代仪器区分
 与
与 的方法是
的方法是(5)已知
 分子中所有原子都在同一平面内,则
分子中所有原子都在同一平面内,则 中至多有
中至多有(6)已知10.8g
 在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重
在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重(7)
 继续氧化产物(C7H6O2)与
继续氧化产物(C7H6O2)与 反应的化学方程式:
反应的化学方程式:
您最近一年使用:0次
2024-05-22更新
|
119次组卷
|
3卷引用:山西省运城市三晋卓越联盟2023-2024学年高二下学期期中考试化学试题
7 . 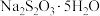 俗称“大苏打”,它是一种常用的试剂.
俗称“大苏打”,它是一种常用的试剂.
(1)工业上,常用 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 .写出离子方程式:
.写出离子方程式:__________________ .理论上,能发生的氧化还原反应都可以设计成原电池.如果将上述反应设计成原电池,则正极反应式为____________ .
(2)已知: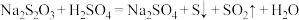
某小组设计实验探究影响化学反应速率的外界因素:
①
_________ ,设计实验I,Ⅱ的目的是_________ .
②实验测得: .由实验I、Ⅲ得出结论是
.由实验I、Ⅲ得出结论是________________ .
③根据表格信息,__________ (填“能”或“不能”)比较a和d的大小,原因是________ .
(3)已知: 是白色难溶物.大苏打易变质生成
是白色难溶物.大苏打易变质生成 .设计实验证明某大苏打样品是否变质:
.设计实验证明某大苏打样品是否变质:__________________ .
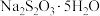 俗称“大苏打”,它是一种常用的试剂.
俗称“大苏打”,它是一种常用的试剂.(1)工业上,常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 .写出离子方程式:
.写出离子方程式:(2)已知:
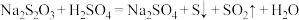
某小组设计实验探究影响化学反应速率的外界因素:
| 序号 | 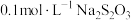 溶液 溶液 | 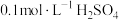 溶液 溶液 | 蒸馏水 | 温度 | 变浑浊时间 |
| I |  |  | 0 | 35℃ | a s |
| II |  | 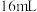 | V mL | 35℃ | b s |
| III |  |  | 0 | 45℃ | c s |
| IV |  |  | 5 mL | 40℃ | d s |

②实验测得:
 .由实验I、Ⅲ得出结论是
.由实验I、Ⅲ得出结论是③根据表格信息,
(3)已知:
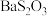 是白色难溶物.大苏打易变质生成
是白色难溶物.大苏打易变质生成 .设计实验证明某大苏打样品是否变质:
.设计实验证明某大苏打样品是否变质:
您最近一年使用:0次
名校
8 . 化学电源在生产生活中有着广泛的应用,同学们常常通过设计实验和查阅资料的方式学习化学电源的相关知识。
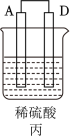
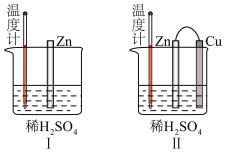
(1)甲同学为了解反应中的能量转化,设计了一组对比实验(实验装置如图Ⅰ和图Ⅱ)。____ Ⅱ(>、<或=),温度计的示数Ⅰ___ II(>、<或=)。
(2)乙同学用如图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则 a 电极的电极反应式为________ ,当量筒中收集到 336mL(标准状况下)气体时,通过导线的电子的物质的量为_______ 。
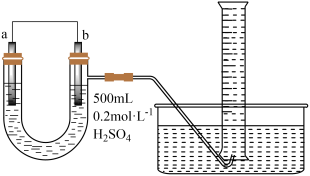
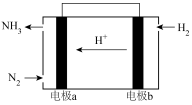
(3)丙同学了解到科学家正在研究利用原电池原理常温常压下合成氨,在该装置如图,电极 a 为____ 极(填“正”或“负”)。_____ ,电解质溶液为_____ ,负极的电极反应式为_____ 。
(1)甲同学为了解反应中的能量转化,设计了一组对比实验(实验装置如图Ⅰ和图Ⅱ)。
(2)乙同学用如图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则 a 电极的电极反应式为

(3)丙同学了解到科学家正在研究利用原电池原理常温常压下合成氨,在该装置如图,电极 a 为
您最近一年使用:0次
2024-04-04更新
|
219次组卷
|
2卷引用:山西省大同市第一中学校2023-2024学年高一下学期4月期中考试化学试题
解题方法
9 . 回答下列问题。
(1)请用双线桥标出下列反应的电子转移情况:
①Cl2+2NaOH=NaCl+NaClO+H2O:___________ 。
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O:
MnCl2+Cl2↑+2H2O:___________ 。
(2)请写出下列反应的离子方程式。
①钠与水反应的离子方程式:___________ 。
②氢氧化铜与盐酸反应的离子方程式:___________ 。
(3)小苏打可做胃药,治疗胃酸过多,请用化学方程式写出其反应原理:___________ 。
(1)请用双线桥标出下列反应的电子转移情况:
①Cl2+2NaOH=NaCl+NaClO+H2O:
②MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O:
MnCl2+Cl2↑+2H2O:(2)请写出下列反应的离子方程式。
①钠与水反应的离子方程式:
②氢氧化铜与盐酸反应的离子方程式:
(3)小苏打可做胃药,治疗胃酸过多,请用化学方程式写出其反应原理:
您最近一年使用:0次
解题方法
10 . 回答下列问题。
(1)将一小块金属钠投入盛有水的烧杯里,钠熔化成闪亮的小球,说明___________ ;向烧杯中滴加酚酞试液,溶液呈___________ 色;其中反应的化学方程式为___________ ;若钠着火,可如何处理?___________ 。
(2)Na2O2可在呼吸面具中作为氧气的来源,其发生反应的化学方程式为___________ 。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用___________ 方法,所涉及的化学方程式为___________ 。
(1)将一小块金属钠投入盛有水的烧杯里,钠熔化成闪亮的小球,说明
(2)Na2O2可在呼吸面具中作为氧气的来源,其发生反应的化学方程式为
(3)除去Na2CO3粉末中混入的NaHCO3杂质用
您最近一年使用:0次