名校
解题方法
1 . 已知在2L的密闭容器中进行如下可逆反应,各物质的有关数据如下:
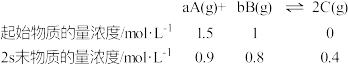
请回答下列问题。
(1)该可逆反应的化学方程式可表示为_______ 。
(2)用物质B来表示0~2s的平均反应速率为_______ 。
(3)从反应开始到2s末,A的转化率为_______ 。
(4)下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_______ (填序号)。
A.vB(消耗)=vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA:vB:vC=3:1:2
E.容器内气体C的物质的量分数保持不变
(5)若平衡后改变温度,使得容器中气体的平均摩尔质量变大,则反应向_______ (填“反应物”或“生成物”)的方向移动。
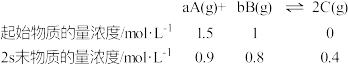
请回答下列问题。
(1)该可逆反应的化学方程式可表示为
(2)用物质B来表示0~2s的平均反应速率为
(3)从反应开始到2s末,A的转化率为
(4)下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
A.vB(消耗)=vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA:vB:vC=3:1:2
E.容器内气体C的物质的量分数保持不变
(5)若平衡后改变温度,使得容器中气体的平均摩尔质量变大,则反应向
您最近一年使用:0次
名校
2 . Ⅰ.在一定条件下A与B反应可生成C和D,其能量变化如图:

(1)若E1>E2,反应体系的总能量_______ (填“升高”或“降低”),为_______ (填“吸热”或“放热”)反应。原因是_______ 。
Ⅱ.2020年第七十五届联合国大会上,中国向世界郑重承诺在2030年前实现碳达峰,在2060年前实现碳中和。大力发展绿色能源、清洁能源是实现碳中和的最有效方法。
(2)原电池反应能够提供电能而不产生CO2气体,如图是某原电池装置图。

①Zn棒是原电池的_______ 极,发生_______ (填“氧化”或“还原”)反应。
②Cu棒上发生的电极反应式为_______ 。
③溶液中H+向_______ (填“Zn”或“Cu”)电极定向移动。
(3)将上述装置中电解质稀H2SO4换为足量AgNO3溶液,灯泡也变亮,电流表指针偏转,无色溶液颜色没有变化。
①原电池的负极是_______ (填“Zn”或“Cu”),正极的电极反应式为_______ 。
②若更换电解质时称量两个电极,质量恰好相等,放电一段时间后再称量两个电极,发现质量相差2.81g,则导线上通过的n(e-)=_______ mol。
(4)碱性锌锰电池是日常生活中常用电池,原电池反应是:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH。该原电池电解质是KOH溶液,写出正极的电极反应_______ 。

(1)若E1>E2,反应体系的总能量
Ⅱ.2020年第七十五届联合国大会上,中国向世界郑重承诺在2030年前实现碳达峰,在2060年前实现碳中和。大力发展绿色能源、清洁能源是实现碳中和的最有效方法。
(2)原电池反应能够提供电能而不产生CO2气体,如图是某原电池装置图。

①Zn棒是原电池的
②Cu棒上发生的电极反应式为
③溶液中H+向
(3)将上述装置中电解质稀H2SO4换为足量AgNO3溶液,灯泡也变亮,电流表指针偏转,无色溶液颜色没有变化。
①原电池的负极是
②若更换电解质时称量两个电极,质量恰好相等,放电一段时间后再称量两个电极,发现质量相差2.81g,则导线上通过的n(e-)=
(4)碱性锌锰电池是日常生活中常用电池,原电池反应是:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH。该原电池电解质是KOH溶液,写出正极的电极反应
您最近一年使用:0次
3 . 根据已学知识,请回答下列问题:
(1)基态 N 原子中,核外电子占据的最高能层的符号是___________ ,占据该能层电子的原子轨道形状为___________ 。
(2)写出3p轨道上有2个未成对电子的元素的符号:___________ 。
(3)某元素被科学家称之为人体微量元素中的"防癌之王",其原子的价层电子排布式为4s24p4,该元素的名称是___________ 。
(4)已知铁是26号元素,写出基态 Fe 的价层电子排布式:___________ ;在元素周期表中,该元素在___________ (填“s”“p”“d”“f”或“ds”)区。
(5)从原子结的角度分析 B 、N和O的第一电能由大到小的顺序为___________ ,电负性由大到小的顺序是___________ 。
(1)基态 N 原子中,核外电子占据的最高能层的符号是
(2)写出3p轨道上有2个未成对电子的元素的符号:
(3)某元素被科学家称之为人体微量元素中的"防癌之王",其原子的价层电子排布式为4s24p4,该元素的名称是
(4)已知铁是26号元素,写出基态 Fe 的价层电子排布式:
(5)从原子结的角度分析 B 、N和O的第一电能由大到小的顺序为
您最近一年使用:0次
名校
4 . 化学反应中的能量变化通常表现为热量的变化。回答下列问题:
(1)已知: 、
、 、
、 各
各 分别与足量水反应热量变化依次为
分别与足量水反应热量变化依次为 、
、 、
、 。
。
①固态钠与水反应的热化学方程式为_______ 。
②钠、钾与水反应,钠、钾均熔化为球状,而锂与水反应,锂始终为固体,下列可解释这一事实的是_______ (填标号)。
A.锂的密度比钠、钾的大
B.锂的熔点比钠、钾的高得多,实验条件下产生的热量不足以使其熔化
C.锂与水的反应是吸热反应,钠、钾与水的反应是放热反应
D.相同质量时,锂与水反应产生的热量比钠、钾的少
(2) 和
和 在铁催化剂表面合成氨的相关能量与反应历程如图所示(其中吸附在
在铁催化剂表面合成氨的相关能量与反应历程如图所示(其中吸附在 催化剂表面上的物种用
催化剂表面上的物种用 标注):
标注):
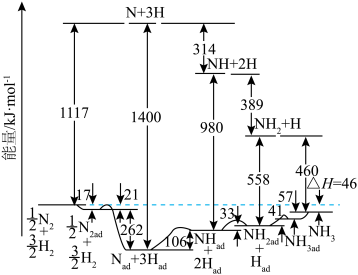
① 和
和 合成
合成 的热化学方程式为
的热化学方程式为_______ 。
②下列反应历程中,吸热的是_______ (填标号)。
A. B.
B.
C.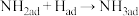 D.
D.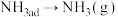
③键能通常是指在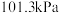 和
和 下,将
下,将 气态分子拆开成气态原子时,每个键所需能量的平均值,
气态分子拆开成气态原子时,每个键所需能量的平均值, 中
中 键的平均键能为
键的平均键能为_______  (保留一位小数)。
(保留一位小数)。
(3)向量热计中加入 盐酸(溶液温度
盐酸(溶液温度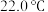 ),再迅速加入相同温度
),再迅速加入相同温度 溶液,盖上杯盖,匀速搅拌,测得最高温度为
溶液,盖上杯盖,匀速搅拌,测得最高温度为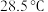 ,设该盐酸和
,设该盐酸和 溶液的密度均为
溶液的密度均为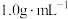 ,溶液的比热容为
,溶液的比热容为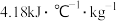 。由实验数据可得出每反应生成
。由实验数据可得出每反应生成 的
的 为
为_______ (保留一位小数)。
(1)已知:
 、
、 、
、 各
各 分别与足量水反应热量变化依次为
分别与足量水反应热量变化依次为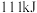 、
、 、
、 。
。①固态钠与水反应的热化学方程式为
②钠、钾与水反应,钠、钾均熔化为球状,而锂与水反应,锂始终为固体,下列可解释这一事实的是
A.锂的密度比钠、钾的大
B.锂的熔点比钠、钾的高得多,实验条件下产生的热量不足以使其熔化
C.锂与水的反应是吸热反应,钠、钾与水的反应是放热反应
D.相同质量时,锂与水反应产生的热量比钠、钾的少
(2)
 和
和 在铁催化剂表面合成氨的相关能量与反应历程如图所示(其中吸附在
在铁催化剂表面合成氨的相关能量与反应历程如图所示(其中吸附在 催化剂表面上的物种用
催化剂表面上的物种用 标注):
标注):
①
 和
和 合成
合成 的热化学方程式为
的热化学方程式为②下列反应历程中,吸热的是
A.
 B.
B.
C.
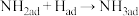 D.
D.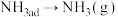
③键能通常是指在
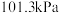 和
和 下,将
下,将 气态分子拆开成气态原子时,每个键所需能量的平均值,
气态分子拆开成气态原子时,每个键所需能量的平均值, 中
中 键的平均键能为
键的平均键能为 (保留一位小数)。
(保留一位小数)。(3)向量热计中加入
 盐酸(溶液温度
盐酸(溶液温度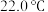 ),再迅速加入相同温度
),再迅速加入相同温度 溶液,盖上杯盖,匀速搅拌,测得最高温度为
溶液,盖上杯盖,匀速搅拌,测得最高温度为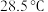 ,设该盐酸和
,设该盐酸和 溶液的密度均为
溶液的密度均为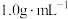 ,溶液的比热容为
,溶液的比热容为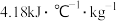 。由实验数据可得出每反应生成
。由实验数据可得出每反应生成 的
的 为
为
您最近一年使用:0次
名校
解题方法
5 . 电石(主要成分为 )是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
)是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
(1)碳元素在元素周期表中的位置为_______ ; 的电子式为
的电子式为_______ 。
(2)①目前工业上合成电石主要采用氧热法。
已知: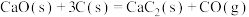
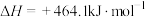 ;
;

 。
。
若不考虑热量耗散,物料转化率均为 ,最终炉中出来的气体只有
,最终炉中出来的气体只有 。则为了维持热平衡,每生产
。则为了维持热平衡,每生产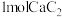 ,投料的量为
,投料的量为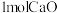 、
、_______ 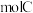 及
及_______  。
。
②制乙炔后的固体废渣主要成分为 ,可用于制取漂白粉,制取漂白粉的化学方程式为
,可用于制取漂白粉,制取漂白粉的化学方程式为_______ 。
(3)乙炔是二种重要的有机化工原料,乙炔在不同的反应条件下可以转化成下列化合物:
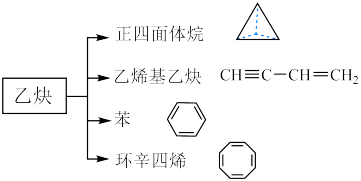
下列说法正确的是_______(填标号)。
(4)以乙炔为原料可制备维尼纶(PVAC),其合成路线如下:
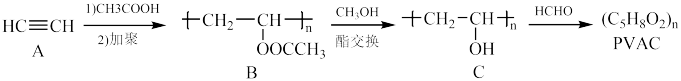
① 中官能团名称为
中官能团名称为_______ 。
② 经过两步反应,第二步为加聚反应,第一步反应类型为
经过两步反应,第二步为加聚反应,第一步反应类型为_______ 。
③ 的反应过程中另一种生成物的结构简式为
的反应过程中另一种生成物的结构简式为_______ 。
 )是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
)是重要的基本化工原料,主要用于生产乙炔。回答下列问题:(1)碳元素在元素周期表中的位置为
 的电子式为
的电子式为(2)①目前工业上合成电石主要采用氧热法。
已知:
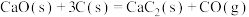
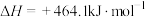 ;
;
 。
。若不考虑热量耗散,物料转化率均为
 ,最终炉中出来的气体只有
,最终炉中出来的气体只有 。则为了维持热平衡,每生产
。则为了维持热平衡,每生产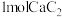 ,投料的量为
,投料的量为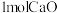 、
、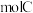 及
及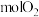 。
。②制乙炔后的固体废渣主要成分为
 ,可用于制取漂白粉,制取漂白粉的化学方程式为
,可用于制取漂白粉,制取漂白粉的化学方程式为(3)乙炔是二种重要的有机化工原料,乙炔在不同的反应条件下可以转化成下列化合物:

下列说法正确的是_______(填标号)。
| A.乙烯基乙炔分子中所有原子可以处于同一直线上 |
B.常温下, 苯中含碳碳双键数目约为 苯中含碳碳双键数目约为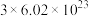 |
| C.环辛四烯与苯均能使酸性高锰酸钾溶液褪色 |
| D.正四面体烷与环辛四烯的一取代物均只有一种 |
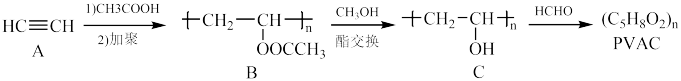
①
 中官能团名称为
中官能团名称为②
 经过两步反应,第二步为加聚反应,第一步反应类型为
经过两步反应,第二步为加聚反应,第一步反应类型为③
 的反应过程中另一种生成物的结构简式为
的反应过程中另一种生成物的结构简式为
您最近一年使用:0次
名校
6 .  和
和 在厨房中很常见,回答下列问题:
在厨房中很常见,回答下列问题:
(1) 从其组成的阴离子来看,属于
从其组成的阴离子来看,属于_______ , 的俗称为
的俗称为_______ ,等物质的量的 和
和 固体中所含的离子总数之比为
固体中所含的离子总数之比为_______ 。
(2)厨房去油污选用 溶液而不选用
溶液而不选用 溶液的原因为
溶液的原因为_______ 。
(3)比较 和
和 的热稳定性的示意图如图,一段时间后,观察到烧杯Ⅱ中的溶液变浑浊了,而烧杯Ⅰ中的溶液未变浑浊。
的热稳定性的示意图如图,一段时间后,观察到烧杯Ⅱ中的溶液变浑浊了,而烧杯Ⅰ中的溶液未变浑浊。
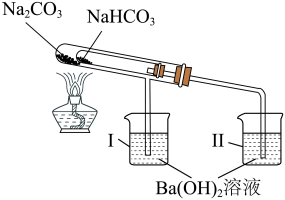
①热稳定性:
_______ (填“>”、“<”或“=”) 。
。
②烧杯Ⅱ中的溶液变浑浊,反应后的产物为_______ (填化学式)。
(4)碳酸氢钠受热分解时转化率与熔烧时间的关系如图。
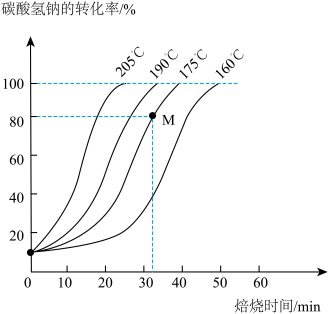
①碳酸氢钠受热分解的化学方程式为_______ 。
②若起始时投入的碳酸氢钠的质量为16.8g(假设不含其他杂质),则M点时产生的二氧化碳气体的体积为_______ L。(气体已换算成标准状况下,转化率 )
)
 和
和 在厨房中很常见,回答下列问题:
在厨房中很常见,回答下列问题:(1)
 从其组成的阴离子来看,属于
从其组成的阴离子来看,属于 的俗称为
的俗称为 和
和 固体中所含的离子总数之比为
固体中所含的离子总数之比为(2)厨房去油污选用
 溶液而不选用
溶液而不选用 溶液的原因为
溶液的原因为(3)比较
 和
和 的热稳定性的示意图如图,一段时间后,观察到烧杯Ⅱ中的溶液变浑浊了,而烧杯Ⅰ中的溶液未变浑浊。
的热稳定性的示意图如图,一段时间后,观察到烧杯Ⅱ中的溶液变浑浊了,而烧杯Ⅰ中的溶液未变浑浊。
①热稳定性:

 。
。②烧杯Ⅱ中的溶液变浑浊,反应后的产物为
(4)碳酸氢钠受热分解时转化率与熔烧时间的关系如图。

①碳酸氢钠受热分解的化学方程式为
②若起始时投入的碳酸氢钠的质量为16.8g(假设不含其他杂质),则M点时产生的二氧化碳气体的体积为
 )
)
您最近一年使用:0次
7 . 水溶液广泛存在于生命体及其赖以生存的环境中,与生命活动、日常生活、工农业生产和环境保护等息息相关。请回答:
(1)人体血浆中的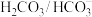 对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是
对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是_______ (用离子方程式表示),肾脏通过分泌 调节血液pH,分泌
调节血液pH,分泌 可使血液pH
可使血液pH_______ (填“升高”或“降低”)。人体血液的pH=7.4[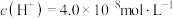 ]时,
]时, 和
和 浓度比值约为20∶1,该条件下
浓度比值约为20∶1,该条件下 的
的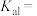
_______ 。
(2) 可用作白色颜料和阻燃剂等,在实验室可利用
可用作白色颜料和阻燃剂等,在实验室可利用 的水解反应制取。为得到较多的
的水解反应制取。为得到较多的 ,操作时先将
,操作时先将 缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为
缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为_______ ;反应后期还要加入少量氨水,目的是_______ 。
(3)工业上处理废水时,可采用FeS除去废水中的 ,原因是
,原因是_______ (用离子方程式表示),已知: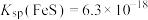 、
、 ,则上述反应的化学平衡常数K=
,则上述反应的化学平衡常数K=_______ 。
(1)人体血浆中的
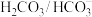 对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是
对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是 调节血液pH,分泌
调节血液pH,分泌 可使血液pH
可使血液pH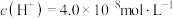 ]时,
]时, 和
和 浓度比值约为20∶1,该条件下
浓度比值约为20∶1,该条件下 的
的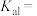
(2)
 可用作白色颜料和阻燃剂等,在实验室可利用
可用作白色颜料和阻燃剂等,在实验室可利用 的水解反应制取。为得到较多的
的水解反应制取。为得到较多的 ,操作时先将
,操作时先将 缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为
缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为(3)工业上处理废水时,可采用FeS除去废水中的
 ,原因是
,原因是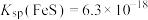 、
、 ,则上述反应的化学平衡常数K=
,则上述反应的化学平衡常数K=
您最近一年使用:0次
8 . 将0.4molN2O4充入2L固定容积的密闭容器中发生反应:N2O4(g) 2NO2(g) △H。分别在T1和T2时,测得NO2的物质的量随时间的变化如下图所示:
2NO2(g) △H。分别在T1和T2时,测得NO2的物质的量随时间的变化如下图所示:
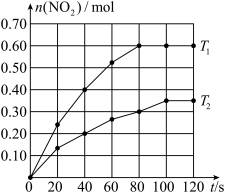
(1)该反应的△H_______ (填“>”“<”或“=”)0,理由是_______ 。
(2) T1时,40~80s内用N2O4的浓度变化表示的反应速率为_______ mol·L-1·s-1。
(3) T1时,反应的平衡常数K=_______ 。恒温恒容条件下,下列能说明该反应达到平衡状态的是_______ (填序号)。
①v(NO2)=2v(N2O4);②反应体系的总压强保持恒定不变;③混合气体的密度保持恒定不变;④体系颜色保持不变;⑤容器内NO2和N2O4的浓度相等
(4)T2时,改变条件使反应重新达到平衡时, 的值变小,则采取的措施可能是_______(填字母)。
的值变小,则采取的措施可能是_______(填字母)。
 2NO2(g) △H。分别在T1和T2时,测得NO2的物质的量随时间的变化如下图所示:
2NO2(g) △H。分别在T1和T2时,测得NO2的物质的量随时间的变化如下图所示:
(1)该反应的△H
(2) T1时,40~80s内用N2O4的浓度变化表示的反应速率为
(3) T1时,反应的平衡常数K=
①v(NO2)=2v(N2O4);②反应体系的总压强保持恒定不变;③混合气体的密度保持恒定不变;④体系颜色保持不变;⑤容器内NO2和N2O4的浓度相等
(4)T2时,改变条件使反应重新达到平衡时,
 的值变小,则采取的措施可能是_______(填字母)。
的值变小,则采取的措施可能是_______(填字母)。| A.增大 N2O4的起始浓度 | B.升高温度 |
| C.向混合气体中通入NO2 | D.使用高效催化剂 |
您最近一年使用:0次
2023-02-11更新
|
131次组卷
|
2卷引用:山西省临汾市2022-2023学年高二下学期开学考试化学试题
名校
9 . A~R 9种元素在元素周期表中的位置如图。
回答下列问题:
(1)E的原子结构示意图为_______ 。
(2)常温下, 的状态为
的状态为_______ (填“液”、“固”或“气”)态。
(3)写出单质A与 在加热条件下发生反应的化学方程式:
在加热条件下发生反应的化学方程式:_______ 。
(4)化合物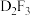 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为_______ 。
(5)H元素形成的单质的用途有_______ (填一种即可)。
(6)最高价氧化物对应水化物的碱性:C_______ (填“>”、“<”或“=”)A,判断的理由为_______ 。
(7)化合物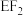 所含分子中的电子总数为
所含分子中的电子总数为_______ ,与其具有相同电子数的化合物分子为_______ (填标号)。
a. b.
b. c.
c. d.
d.
| 周期 | 族 | |||||||
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | A | E | F | |||||
| 3 | C | D | G | H | ||||
| 4 | B | R | ||||||
(1)E的原子结构示意图为
(2)常温下,
 的状态为
的状态为(3)写出单质A与
 在加热条件下发生反应的化学方程式:
在加热条件下发生反应的化学方程式:(4)化合物
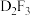 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为(5)H元素形成的单质的用途有
(6)最高价氧化物对应水化物的碱性:C
(7)化合物
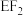 所含分子中的电子总数为
所含分子中的电子总数为a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2023-02-08更新
|
156次组卷
|
3卷引用:山西省忻州市河曲县中学校2022-2023学年高一下学期开学考试化学试题
名校
解题方法
10 . 将6mol H2和3molCO充入容积为0.5L的密闭容器中,进行如下反应: 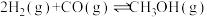 ,6秒末时容器内压强为开始时的0.6倍。试计算:
,6秒末时容器内压强为开始时的0.6倍。试计算:
(1)H2的反应速率是_________ 。
(2)CO的转化率为_________ 。
(3)化学平衡常数为_________ 。(注:写出计算过程)
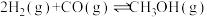 ,6秒末时容器内压强为开始时的0.6倍。试计算:
,6秒末时容器内压强为开始时的0.6倍。试计算:(1)H2的反应速率是
(2)CO的转化率为
(3)化学平衡常数为
您最近一年使用:0次



