1 . 高炉炼铁是重要的工业过程,冶炼过程中涉及如下反应:
①FeO(s)+CO(g) Fe(s)+CO2(g) ΔH1 =-11kJ/mol
Fe(s)+CO2(g) ΔH1 =-11kJ/mol
②FeO(s)+C(s) Fe(s)+CO(g) ΔH2=+161.5kJ/mol
Fe(s)+CO(g) ΔH2=+161.5kJ/mol
③C(s)+CO2(g) 2CO(g)
2CO(g)
(1)反应③的ΔH=___________ kJ/mol。
(2)在恒温恒容密闭容器中投入足量石墨与CO2进行反应③,可判定其达到平衡的条件有___________(填序号)。
(3)反应②的压力平衡常数表达式Kp2=___________ 。
(4)恒容密闭容器中加入足量C、FeO,进行上述反应。改变温度,测得平衡时容器总压的对数lg(p总/kPa)、各气体的物质的量分数x(CO)、x(CO2)的变化如图所示:
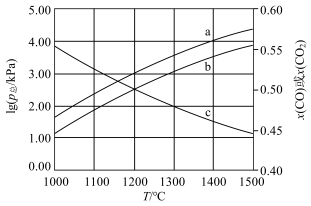
①x( CO)对应的曲线是___________ (填序号),判断依据是___________ 。
②在1200℃下进行上述反应,平衡时CO2分压为___________ kPa,反应①在此温度下的压力平衡常数Kp1 =___________ 。
(5)高炉炼铁过程中会生成“渗碳体”Fe3C (相对分子质量为M),晶胞为长方体 (如图),晶胞参数为a pm, b pm, c pm,阿伏加德罗常数为NA,则其密度为___________ g/cm3(用含M、a、b、c、NA的式子表示)。

①FeO(s)+CO(g)
 Fe(s)+CO2(g) ΔH1 =-11kJ/mol
Fe(s)+CO2(g) ΔH1 =-11kJ/mol②FeO(s)+C(s)
 Fe(s)+CO(g) ΔH2=+161.5kJ/mol
Fe(s)+CO(g) ΔH2=+161.5kJ/mol③C(s)+CO2(g)
 2CO(g)
2CO(g)(1)反应③的ΔH=
(2)在恒温恒容密闭容器中投入足量石墨与CO2进行反应③,可判定其达到平衡的条件有___________(填序号)。
| A.容器总压保持不变 |
| B.石墨断开3mol碳碳σ键的同时,CO断开2mol碳氧三键 |
| C.CO的体积分数保持不变 |
D.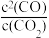 保持不变 保持不变 |
(4)恒容密闭容器中加入足量C、FeO,进行上述反应。改变温度,测得平衡时容器总压的对数lg(p总/kPa)、各气体的物质的量分数x(CO)、x(CO2)的变化如图所示:

①x( CO)对应的曲线是
②在1200℃下进行上述反应,平衡时CO2分压为
(5)高炉炼铁过程中会生成“渗碳体”Fe3C (相对分子质量为M),晶胞为长方体 (如图),晶胞参数为a pm, b pm, c pm,阿伏加德罗常数为NA,则其密度为

您最近一年使用:0次
名校
2 .  作为电池正极材料,具有比容量高、环境友好、相对于其它锂离子电池正极材料工作电压较为适中等优点。高温固相法生产
作为电池正极材料,具有比容量高、环境友好、相对于其它锂离子电池正极材料工作电压较为适中等优点。高温固相法生产 通常以
通常以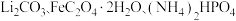 为原料在氮气的氛围中高温条件下制得,请回答下列问题:
为原料在氮气的氛围中高温条件下制得,请回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为 _______ 。
(2)制备 的理论原料比
的理论原料比 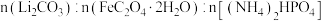 为
为_______ 。
(3)高温固相反应法的第一阶段为预分解,温度设在 400℃,目的是使原料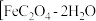 和
和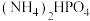 ]先发生分解反应。某实验小组对原料的分解分别进行了研究。
]先发生分解反应。某实验小组对原料的分解分别进行了研究。
①固体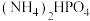 加热到 150℃时,分解生成
加热到 150℃时,分解生成 和氨气,
和氨气, 的化学名称为
的化学名称为_______ ; 190℃时完全分解得到 等产物,
等产物, 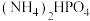 完全分解的总反应的化学方程式为
完全分解的总反应的化学方程式为_______ 。
②下图是实验室测量得到的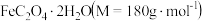 在氮气的氛围中加热分解时,固体质量随温度变化的曲线。300℃ 和 400℃时,固体成分的化学式分别是
在氮气的氛围中加热分解时,固体质量随温度变化的曲线。300℃ 和 400℃时,固体成分的化学式分别是_______ 、_______ ;400~500℃ 时,固体质量增大(含有  可能的原因是
可能的原因是_______ 。

(4) 产品中铁的含量可通过如下方法测定:称取一定质量试样用盐酸溶解,在溶液中加入稍过量的
产品中铁的含量可通过如下方法测定:称取一定质量试样用盐酸溶解,在溶液中加入稍过量的 溶液,再加入
溶液,再加入 饱和溶液,加入指示剂,用重铬酸钾标准溶液滴定
饱和溶液,加入指示剂,用重铬酸钾标准溶液滴定 。已知:
。已知: 。实验中加入
。实验中加入  饱和溶液的目的是
饱和溶液的目的是_______ ;若用铁粉代替  和
和 ,对测量结果的影响是
,对测量结果的影响是_______ (填“偏大”“偏小”或“无影响”)。
 作为电池正极材料,具有比容量高、环境友好、相对于其它锂离子电池正极材料工作电压较为适中等优点。高温固相法生产
作为电池正极材料,具有比容量高、环境友好、相对于其它锂离子电池正极材料工作电压较为适中等优点。高温固相法生产 通常以
通常以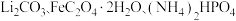 为原料在氮气的氛围中高温条件下制得,请回答下列问题:
为原料在氮气的氛围中高温条件下制得,请回答下列问题:(1)
 中铁元素的化合价为
中铁元素的化合价为 (2)制备
 的理论原料比
的理论原料比 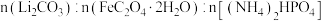 为
为(3)高温固相反应法的第一阶段为预分解,温度设在 400℃,目的是使原料
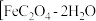 和
和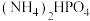 ]先发生分解反应。某实验小组对原料的分解分别进行了研究。
]先发生分解反应。某实验小组对原料的分解分别进行了研究。①固体
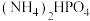 加热到 150℃时,分解生成
加热到 150℃时,分解生成 和氨气,
和氨气, 的化学名称为
的化学名称为 等产物,
等产物, 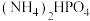 完全分解的总反应的化学方程式为
完全分解的总反应的化学方程式为②下图是实验室测量得到的
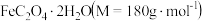 在氮气的氛围中加热分解时,固体质量随温度变化的曲线。300℃ 和 400℃时,固体成分的化学式分别是
在氮气的氛围中加热分解时,固体质量随温度变化的曲线。300℃ 和 400℃时,固体成分的化学式分别是 可能的原因是
可能的原因是
(4)
 产品中铁的含量可通过如下方法测定:称取一定质量试样用盐酸溶解,在溶液中加入稍过量的
产品中铁的含量可通过如下方法测定:称取一定质量试样用盐酸溶解,在溶液中加入稍过量的 溶液,再加入
溶液,再加入 饱和溶液,加入指示剂,用重铬酸钾标准溶液滴定
饱和溶液,加入指示剂,用重铬酸钾标准溶液滴定 。已知:
。已知: 。实验中加入
。实验中加入  饱和溶液的目的是
饱和溶液的目的是 和
和 ,对测量结果的影响是
,对测量结果的影响是
您最近一年使用:0次
名校
解题方法
3 . (1)次氯酸盐是一些漂白剂和消毒剂的有效成分。“84”消毒液的有效成分是次氯酸钠,制取该消毒液的化学方程式为__ 。
(2)二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在一定条件下与SO2反应制得。该反应的离子方程式为__ 。
(3)漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年之久,但亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1molHClO2发生分解反应时,转移电子的物质的量是___ mol。
(4)海水提溴过程中溴元素的变化如图所示:

①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因:__ 。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列化学方程式:___ 。
____Br2+____Na2CO3=____NaBrO3+____CO2+____
(5)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量如表。则原溶液中NaI的物质的量是___ mol。
(2)二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在一定条件下与SO2反应制得。该反应的离子方程式为
(3)漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年之久,但亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1molHClO2发生分解反应时,转移电子的物质的量是
(4)海水提溴过程中溴元素的变化如图所示:

①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因:
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列化学方程式:
____Br2+____Na2CO3=____NaBrO3+____CO2+____
(5)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量如表。则原溶液中NaI的物质的量是
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 | 未知 |
您最近一年使用:0次
2021-04-15更新
|
239次组卷
|
5卷引用:云南省峨山彝族自治县第一中学2018届高三第四次模拟考试化学试题
云南省峨山彝族自治县第一中学2018届高三第四次模拟考试化学试题河北省武邑中学2018届高三上学期第三次调研考试化学试题(已下线)学科网2019年高考化学一轮复习讲练测2.4 氧化还原反应的规律及应用 测新疆巴音郭楞蒙古自治州第二中学2021届高三上学期开学摸底考试化学试题黑龙江省佳木斯市第八中学2021-2022学年高三上学期第二次调研(期中)考试化学试题
4 . 某学习小组利用如图所示装置将氯气和空气(不参与反应)以体积比约为1:3混合后,与湿润的碳酸钠反应制取Cl2O,并进一步制取次氯酸。

已知:Cl2O是黄棕色具有强烈刺激性气味的气体,沸点为2.2℃,易溶于CC14和水。其爆炸极限为23.5%~100%,与有机物、还原剂接触或加热时会燃烧或爆炸。
回答下列问题:
(1)装置C的仪器名称为______ ,该装置的作用是______ 。
(2)装置A中发生反应的化学方程式为_______ 。
(3)针对此实验的有关说法正确的是_______ (填标号)。
a.装置不用橡胶管连接且橡胶塞要作保护处理,是为了防止橡胶燃烧或爆炸
b.可利用CCl4除去Cl2O中混有的Cl2
c.氯气与空气混合的目的是将生成的Cl2O稀释,降低爆炸危险
(4)为了进一步制取HClO,可将Cl2O通入水中,该过程宜在避光条件下进行,原因是______ (用化学方程式表示);此方法相较于用氯气直接溶于水制备次氯酸溶液的优点是______ (答出一条即可)。
(5)将制得的HClO溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能是①NaOH被HClO中和;②______ 。设计实验探究溶液红色褪去的原因______ 。

已知:Cl2O是黄棕色具有强烈刺激性气味的气体,沸点为2.2℃,易溶于CC14和水。其爆炸极限为23.5%~100%,与有机物、还原剂接触或加热时会燃烧或爆炸。
回答下列问题:
(1)装置C的仪器名称为
(2)装置A中发生反应的化学方程式为
(3)针对此实验的有关说法正确的是
a.装置不用橡胶管连接且橡胶塞要作保护处理,是为了防止橡胶燃烧或爆炸
b.可利用CCl4除去Cl2O中混有的Cl2
c.氯气与空气混合的目的是将生成的Cl2O稀释,降低爆炸危险
(4)为了进一步制取HClO,可将Cl2O通入水中,该过程宜在避光条件下进行,原因是
(5)将制得的HClO溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能是①NaOH被HClO中和;②
您最近一年使用:0次
5 . 由N、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题:
(1)基态N的原子核外___ 种运动状态不同的电子,基态 P原子核外电子排布式为_____ ,P、S、Cl的第一电离能由大到小顺序为___ 。
(2)PCl3分子中的中心原子杂化轨道类型是__ ,该分子构型为____ 。
(3)PCl3 是一种无色的液体,遇水容易水解生成两种酸,则方程式__ 。
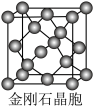
(4)已知MgO与NiO的晶体结构(如图)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO___ NiO(填“>”、“<”或“=”),理由是__ 。

(5)金刚石晶胞含有__ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=___ a,列式表示碳原子在晶胞中的空间占有率___ (请用r和a表示不要求计算结果)。
(1)基态N的原子核外
(2)PCl3分子中的中心原子杂化轨道类型是
(3)PCl3 是一种无色的液体,遇水容易水解生成两种酸,则方程式
(4)已知MgO与NiO的晶体结构(如图)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO

(5)金刚石晶胞含有

您最近一年使用:0次
6 . 石油裂解气用途广泛,可用于合成各种橡胶和医药中间体。利用石油裂解气合成CR橡胶和医药中间体K的路线如图:
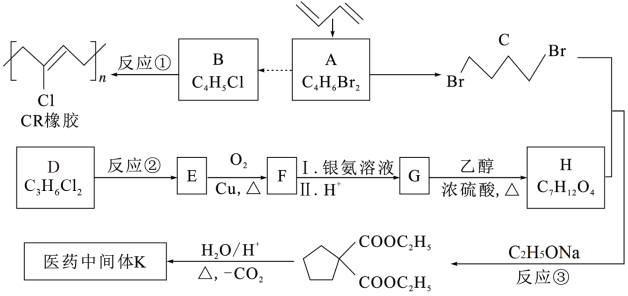
已知:I.氯代烃D的相对分子质量是113,氯的质量分数约为62.8%,核磁共振氢谱峰面积之比为2︰1;
Ⅱ.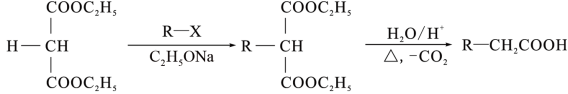
(1)A的顺式异构体的结构简式为___________ 。D的系统名称是___________ 。
(2)反应②的条件是___________ ,依次写出①和③的反应类型:___________ 、___________ 。
(3)写出F→G过程中第一步反应的化学方程式:_________________________________ 。
(4)G还能与其他醇类发生反应,写出G与乙二醇发生聚合反应的化学方程式:________ 。
(5)写出比G多2个碳原子的同系物的所有同分异构体的结构简式:___________ 。
(6)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B__ 。合成路线流程图示如:H2C=CH2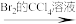
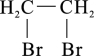

已知:I.氯代烃D的相对分子质量是113,氯的质量分数约为62.8%,核磁共振氢谱峰面积之比为2︰1;
Ⅱ.
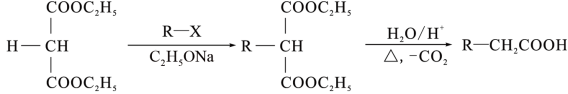
(1)A的顺式异构体的结构简式为
(2)反应②的条件是
(3)写出F→G过程中第一步反应的化学方程式:
(4)G还能与其他醇类发生反应,写出G与乙二醇发生聚合反应的化学方程式:
(5)写出比G多2个碳原子的同系物的所有同分异构体的结构简式:
(6)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B
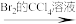
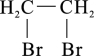
您最近一年使用:0次
真题
名校
7 . Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是_________________ 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的_________ 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________ 。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为____________ (用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为___________ 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于___________ 。
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
您最近一年使用:0次
2019-01-30更新
|
1111次组卷
|
12卷引用:2012届云南省红河州高三5月统一检测理科综合化学试卷
(已下线)2012届云南省红河州高三5月统一检测理科综合化学试卷(已下线)2011届山西省山大附中高三高考模拟题试题(理综)化学部分2009年普通高等学校招生统一考试理综试题化学部分(福建卷)(已下线)2014-2015学年山东桓台第二中学高二上学期(10月)检测化学试卷(已下线)2015届内蒙古赤峰市宁城县高三上学期摸底统一考试化学试卷2014-2015福建省漳浦县三校高二下学期期中化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷福建省莆田市第一中学2016-2017学年高二下学期期中考试化学试题四川省南充市白塔中学2019-2020学年高二12月月考化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)宁夏回族自治区吴忠市吴忠中学2019-2020学年高二下学期期末考试化学试题(已下线)第十一章 能力提升检测卷-2021年高考化学一轮复习讲练测
名校
8 . 根据信息写方程式:
(1)Pb与C同主族,化合价有+2价和+4价,PbO与PbO2是铅的两种常见氧化物,已知PbO2具有强氧化性,与浓盐酸共热可生成一种黄绿色气体和PbCl2 。试写出Pb3O4与浓盐酸反应的化学方程式:__________________________________ 。
(2)过氧化钠可用于实验室制O2,其化学方程式为__________________________________ 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为______________________________ 。
(4)Fe的一种含氧酸根FeO42-- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是__________________________________ 。
(5)向菱镁矿(主要成分为MgCO3,含少量FeCO3)中,首先加入稀硫酸,过滤后,再加入H2O2。写出加入H2O2氧化时发生反应的化学方程式:______________________________________ 。
(1)Pb与C同主族,化合价有+2价和+4价,PbO与PbO2是铅的两种常见氧化物,已知PbO2具有强氧化性,与浓盐酸共热可生成一种黄绿色气体和PbCl2 。试写出Pb3O4与浓盐酸反应的化学方程式:
(2)过氧化钠可用于实验室制O2,其化学方程式为
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
(4)Fe的一种含氧酸根FeO42-- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
(5)向菱镁矿(主要成分为MgCO3,含少量FeCO3)中,首先加入稀硫酸,过滤后,再加入H2O2。写出加入H2O2氧化时发生反应的化学方程式:
您最近一年使用:0次
2018-09-27更新
|
394次组卷
|
3卷引用:云南省玉溪市第一中学2019届高三上学期第二次调研考试化学试题
解题方法
9 . 如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O

请回答:
(1)甲池是________ 池,通入O2的电极作为________ 极,电极反应式为_______________________________________________________________ 。
(2)乙池是________ 池,A电极名称为________ 极,电极反应式为_______________________________________________________________ 。
乙池中的总反应离子方程式为______________________________________________________________ ,
溶液的pH________ (填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________ mL(标准状况下)。

请回答:
(1)甲池是
(2)乙池是
乙池中的总反应离子方程式为
溶液的pH
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2
您最近一年使用:0次
2018-06-06更新
|
1126次组卷
|
2卷引用:云南省保山市2018届高三毕业复习统一检测(一) 高三理综化学部分
名校
解题方法
10 . 某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 g NaHCO3固体的烧杯中加入10 mL水(20 ℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10 mL 密度约为1.1 g·mL-120%的盐酸(20 ℃),搅拌,测量温度T3。
得到下表1的数据:
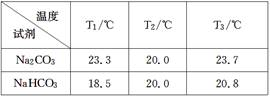
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是______________________ (用离子方程式表示)。
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解____________________________________ 。
(3)分析表1的数据得出:Na2CO3固体溶于水________ ,NaHCO3固体溶于水________ (填“放热”或“吸热”)。
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。
乙同学认为应该增加一个实验,并补做如下实验:向盛有10 mL水(20 ℃)的烧杯中加入10 mL________ ,搅拌,测量温度为22.2 ℃。
(5)结合上述探究,下列说法正确的是________ 。
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1g混合物,加热至质量不变时,称其质量为m2g,则原混合物中NaHCO3的质量分数为________ (用代数式表示)。
附表:溶解度表
 .
.
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 g NaHCO3固体的烧杯中加入10 mL水(20 ℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10 mL 密度约为1.1 g·mL-120%的盐酸(20 ℃),搅拌,测量温度T3。
得到下表1的数据:

回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解
(3)分析表1的数据得出:Na2CO3固体溶于水
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。
乙同学认为应该增加一个实验,并补做如下实验:向盛有10 mL水(20 ℃)的烧杯中加入10 mL
(5)结合上述探究,下列说法正确的是
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1g混合物,加热至质量不变时,称其质量为m2g,则原混合物中NaHCO3的质量分数为
附表:溶解度表
 .
.
您最近一年使用:0次
2018-05-25更新
|
516次组卷
|
5卷引用:云南省文山州2018届高三毕业生复习统一检测理综化学试题
云南省文山州2018届高三毕业生复习统一检测理综化学试题2015届北京市石景山区高三上学期期末考试化学试卷2016届山东省德州中学高三上学期1月月考化学试卷(已下线)2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用河北省安平中学2021-2022学年高三上学期第二次月考化学试题



