名校
解题方法
1 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.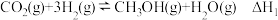
Ⅱ.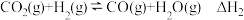
回答下列问题:
(1)反应I、II的1nK(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。据图判断,升高温度时,反应CO(g)+2H2(g)
(温度的倒数)的变化如图所示。据图判断,升高温度时,反应CO(g)+2H2(g) CH3OH(g)的化学平衡常数将
CH3OH(g)的化学平衡常数将___________ (填“增大”“减小”或“不变”)。

(2)上述反应体系在一定条件下建立平衡后,若在恒温恒压下充入氦气,反应Ⅱ的平衡将___________ (填“正向”“逆向”或“不”)移动;若将反应体系体积压缩至原来一半,重新达到平衡时两反应所需时间tI___________ tII(填“>”“<”或“=”)。
(3)恒压条件下,将CO2和H2按体积比1:3混合,初始压强为P0,在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
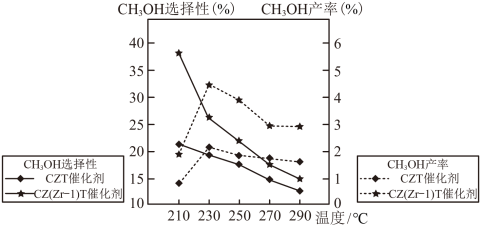
已知:CH3OH的选择性=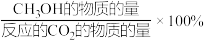
①在上述条件下合成甲醇的工业条件是___________ 。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr—1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是___________ 。
③已知反应Ⅱ的速率方程可表示为 ,
,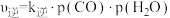 ,其中
,其中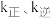 分别为正、逆反应的速率常数,1gk与
分别为正、逆反应的速率常数,1gk与 的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是
的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是___________ ;230℃下,图中A、B、C、D点的纵坐标分别为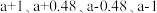 ,达到平衡时,测得体系中
,达到平衡时,测得体系中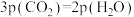 ,以物质的分压表示的反应I的平衡常数
,以物质的分压表示的反应I的平衡常数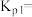
___________ 。(已知:10-0.48=0.33,10-0.52=0.30)

Ⅰ.
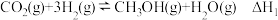
Ⅱ.
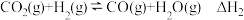
回答下列问题:
(1)反应I、II的1nK(K代表化学平衡常数)随
 (温度的倒数)的变化如图所示。据图判断,升高温度时,反应CO(g)+2H2(g)
(温度的倒数)的变化如图所示。据图判断,升高温度时,反应CO(g)+2H2(g) CH3OH(g)的化学平衡常数将
CH3OH(g)的化学平衡常数将
(2)上述反应体系在一定条件下建立平衡后,若在恒温恒压下充入氦气,反应Ⅱ的平衡将
(3)恒压条件下,将CO2和H2按体积比1:3混合,初始压强为P0,在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。

已知:CH3OH的选择性=
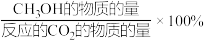
①在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr—1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是
③已知反应Ⅱ的速率方程可表示为
 ,
,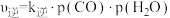 ,其中
,其中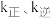 分别为正、逆反应的速率常数,1gk与
分别为正、逆反应的速率常数,1gk与 的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是
的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是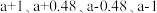 ,达到平衡时,测得体系中
,达到平衡时,测得体系中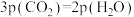 ,以物质的分压表示的反应I的平衡常数
,以物质的分压表示的反应I的平衡常数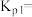

您最近一年使用:0次
2022-06-02更新
|
1560次组卷
|
6卷引用:宁夏银川市银川一中2024届高三一模理综-化学试题
宁夏银川市银川一中2024届高三一模理综-化学试题山东省实验中学2022届高三打靶化学试题(已下线)第22讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(全国通用)新疆维吾尔自治区阿克苏地区第二中学2022-2023学年高三上学期第一次月考化学试题山东省青岛第二中学2022-2023学年高三上学期期中考试化学试题山东省济宁市泗水县2023-2024学年高三上学期期中考试化学试题
2 . 研究氮氧化物的反应机理,NOx之间的转化对等于消除环境污染有具有重要意义。
Ⅰ.升高温度绝大多数的化学反应速率增大,但是2NO(g) + O2(g) 2NO2(g) (∆H< 0)的速率却随温度的升高而减小。某化学小组为研究特殊现象的实质原因,查阅资料知:
2NO2(g) (∆H< 0)的速率却随温度的升高而减小。某化学小组为研究特殊现象的实质原因,查阅资料知:
2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g) (快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ∆H1< 0
N2O2(g) (快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ∆H1< 0
②N2O2(g)+O2(g) 2NO2(g) (慢) v2正=k2正c(N2O2) c(O2) v2逆=k2逆c2(NO2) ∆H2< 0
2NO2(g) (慢) v2正=k2正c(N2O2) c(O2) v2逆=k2逆c2(NO2) ∆H2< 0
(1)一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_______ ,根据速率方程分析,升高温度该反应速率减小的原因是_______ (填字母)。
a. k2正增大,c(N2O2)增大 b. k2正减小,c(N2O2)减小 c. k2正增大,c(N2O2)减小 d. k2正减小,c(N2O2)增大
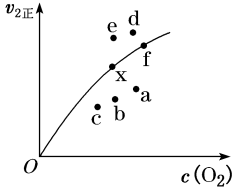
(2)由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为_______ (填字母)。
Ⅱ.回答下列问题
(3)已知:N2O4(g) 2NO2(g) ∆H> 0,将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
2NO2(g) ∆H> 0,将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
①下列可以作为反应达到平衡的判据是_______ 。
A.气体的压强不变 B.容器内气体的密度不变 C. K不变 D. v正(N2O4) =2v逆(NO2) E.容器内颜色不变
② t1时刻反应达到平衡,混合气体平衡总压强P,N2O4气体的平衡转化率为75%,则反应N2O4(g) 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=_______ 。[对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]
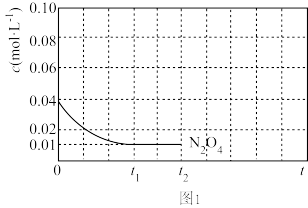
③反应温度T1时,c(N2O4)随t(时间)变化曲线如图1,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线。_______
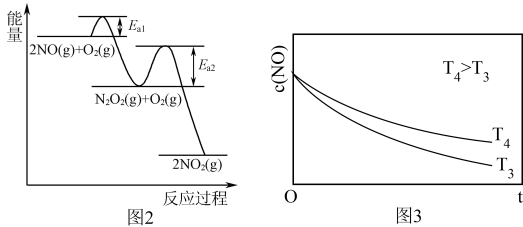
(4)NO氧化反应: 2NO(g)+O2(g) 2NO2(g)分两步进行,其反应过程能量变化示意图如图2。
2NO2(g)分两步进行,其反应过程能量变化示意图如图2。
Ⅰ.2NO(g) N2O2(g) ∆H1
N2O2(g) ∆H1
Ⅱ.N2O2(g)+O2(g) 2NO2(g) ∆H2
2NO2(g) ∆H2
①决定NO氧化反应速率的步骤是_______ (填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4 >T3),测得c(NO)随t(时间)的变化曲线如图3,转化相同量的NO,在温度_______ (填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图(图2)分析其原因_______ 。
Ⅰ.升高温度绝大多数的化学反应速率增大,但是2NO(g) + O2(g)
 2NO2(g) (∆H< 0)的速率却随温度的升高而减小。某化学小组为研究特殊现象的实质原因,查阅资料知:
2NO2(g) (∆H< 0)的速率却随温度的升高而减小。某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:①2NO(g)
 N2O2(g) (快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ∆H1< 0
N2O2(g) (快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ∆H1< 0 ②N2O2(g)+O2(g)
 2NO2(g) (慢) v2正=k2正c(N2O2) c(O2) v2逆=k2逆c2(NO2) ∆H2< 0
2NO2(g) (慢) v2正=k2正c(N2O2) c(O2) v2逆=k2逆c2(NO2) ∆H2< 0(1)一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=a. k2正增大,c(N2O2)增大 b. k2正减小,c(N2O2)减小 c. k2正增大,c(N2O2)减小 d. k2正减小,c(N2O2)增大
(2)由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为

Ⅱ.回答下列问题
(3)已知:N2O4(g)
 2NO2(g) ∆H> 0,将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
2NO2(g) ∆H> 0,将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。①下列可以作为反应达到平衡的判据是
A.气体的压强不变 B.容器内气体的密度不变 C. K不变 D. v正(N2O4) =2v逆(NO2) E.容器内颜色不变
② t1时刻反应达到平衡,混合气体平衡总压强P,N2O4气体的平衡转化率为75%,则反应N2O4(g)
 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=③反应温度T1时,c(N2O4)随t(时间)变化曲线如图1,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线。

(4)NO氧化反应: 2NO(g)+O2(g)
 2NO2(g)分两步进行,其反应过程能量变化示意图如图2。
2NO2(g)分两步进行,其反应过程能量变化示意图如图2。
Ⅰ.2NO(g)
 N2O2(g) ∆H1
N2O2(g) ∆H1 Ⅱ.N2O2(g)+O2(g)
 2NO2(g) ∆H2
2NO2(g) ∆H2①决定NO氧化反应速率的步骤是
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4 >T3),测得c(NO)随t(时间)的变化曲线如图3,转化相同量的NO,在温度
您最近一年使用:0次
名校
解题方法
3 . 肉桂酸( )主要用于香精香料、食品添加剂、医药工业、美容、农药有机合成等方面。实验室可通过如下反应合成,实验装置如图所示:
)主要用于香精香料、食品添加剂、医药工业、美容、农药有机合成等方面。实验室可通过如下反应合成,实验装置如图所示:
主反应: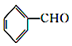 +(CH3CO)2O(乙酸酐)
+(CH3CO)2O(乙酸酐)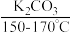
 +CH3COOH
+CH3COOH
副反应:


 (树脂状物)
(树脂状物)

| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g mL-1 mL-1 | 溶解性 |
| 乙酸 | 60 | 16.6 | 117.9 | 1.05 | 能与冷水任意比互溶 |
| 苯甲醛 | 106 | -26 | 179 | 1.06 | 微溶于水,与苯,乙醇、乙醚混溶 |
| 乙酸酐 | 102 | -73.1 | 138.6 | 1.082 | 能溶于冷水 |
| 肉桂酸 | 148 | 133 | 300 | 1.248 | 不溶于冷水,易溶于苯、乙醚,在热水中溶于乙醇 |
Ⅰ.将7.00g无水K2CO3、14.5mL乙酸酐和5.0mL苯甲醛依次加入150mL仪器a中,加热至微沸后保持温度150-170℃加热回流30-45min。
Ⅱ.将反应后的混合物冷却,边搅拌边分次加入40mL水浸泡。
Ⅲ.连接水蒸气蒸馏装置将未完全反应的苯甲醛用水蒸气蒸馏除去。
Ⅳ.将仪器a冷却,加入40mL10%NaOH溶液,使所有的肉桂酸形成钠盐而溶解。加入90mL蒸馏水,将混合物加热,活性炭脱色,趁热过滤除去树脂状物,将滤液冷却至室温以下。
Ⅴ.边搅拌边将20mL浓盐酸和20mL水的混合物加到肉桂酸盐溶液中至呈酸性。用冷水冷却,待结晶完全后抽滤得到粗产品,粗产品经进一步提纯后,得到3.56g产品。
回答下列问题:
(1)仪器a的名称为
(2)冷却水的入口为
(3)水蒸气蒸馏将苯甲醛完全除去的标志是
(4)步骤Ⅳ趁热过滤的目的是
(5)加入浓盐酸与水的混合物后发生反应的化学方程式为
(6)将粗产品提纯的操作名称为
您最近一年使用:0次
2022-05-06更新
|
1182次组卷
|
6卷引用:宁夏石嘴山市第三中学2022届高三第三次模拟考试理综化学试题
宁夏石嘴山市第三中学2022届高三第三次模拟考试理综化学试题福建省连城县第一中学2022-2023学年高三上学期暑期月考化学试题(已下线)微专题46 常见有机物的制备实验-备战2023年高考化学一轮复习考点微专题(已下线)第十一章 有机化学基础 (测)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题03 化学实验专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)河北省石家庄市第十七中学2023-2024学年高二下学期第一次月考化学试题
名校
4 . (1)向浓NH4Cl溶液中加入CaCO3粉末,发现碳酸钙逐渐溶解,同时还观察到有气泡产生,生成气体的成分是________ 。用离子方程式表示产生上述现象的原因:_______________________ 。
(2)在浓NH4Cl溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是________ 。
A.碳B.铜C.镁D.硫
(2)在浓NH4Cl溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是
A.碳B.铜C.镁D.硫
您最近一年使用:0次
2020-09-27更新
|
264次组卷
|
3卷引用:宁夏回族自治区吴忠中学2018-2019学年高二上学期期末模拟化学试题
宁夏回族自治区吴忠中学2018-2019学年高二上学期期末模拟化学试题(已下线)3.3.1+盐溶液呈现不同酸碱性的原因-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)北京市首都师范大学附属中学2021-2022学年高二上学期10月月考化学试题
名校
解题方法
5 . 硫脲(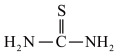 )是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
)是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
(1)硫脲中硫的化合价为_______ ;与硫脲互为同分异构且能与FeCl3溶液发生显色反应的化合物的化学式为_______
(2)可用H2NCN(氨基腈)与C2H5SH (乙硫醇)反应制备硫脲。氨基腈的电子式为_____
(3)制取氨基腈的传统工艺流程如下:
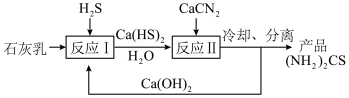
①反应Ⅱ的化学方程式为______
②测定硫脲含量的方法如下:
步骤1 :准确称取a g产品,经溶解等步骤最后在500 mL容量瓶中定容。
步骤2:准确量取20.00 mL配制好的溶液注入碘量瓶中,加入V1 mL c1 mol/L I2的标
准溶液及适量的NaOH溶液,于暗处放置10 min(2NaOH+I2=NaIO+NaI+H2O,
4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2)。
步骤3:加水及适量的盐酸,摇匀。
步骤4:用c2 mol/L标准Na2S2O2溶液滴定剩余的I2( I2+2Na2S2O2=2NaI+Na2S4O6) ,加入淀粉溶液,滴定至终点时消耗Na2S2O2溶液V2mL。
“步骤3”加入盐酸的目的_________ (用离子方程式说明)。
“步骤4”滴定至终点时的颜色变化是________ 。
③产品中(NH2)2CS的质量分数为_______ (列出计算式)。
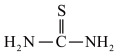 )是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
)是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:(1)硫脲中硫的化合价为
(2)可用H2NCN(氨基腈)与C2H5SH (乙硫醇)反应制备硫脲。氨基腈的电子式为
(3)制取氨基腈的传统工艺流程如下:

①反应Ⅱ的化学方程式为
②测定硫脲含量的方法如下:
步骤1 :准确称取a g产品,经溶解等步骤最后在500 mL容量瓶中定容。
步骤2:准确量取20.00 mL配制好的溶液注入碘量瓶中,加入V1 mL c1 mol/L I2的标
准溶液及适量的NaOH溶液,于暗处放置10 min(2NaOH+I2=NaIO+NaI+H2O,
4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2)。
步骤3:加水及适量的盐酸,摇匀。
步骤4:用c2 mol/L标准Na2S2O2溶液滴定剩余的I2( I2+2Na2S2O2=2NaI+Na2S4O6) ,加入淀粉溶液,滴定至终点时消耗Na2S2O2溶液V2mL。
“步骤3”加入盐酸的目的
“步骤4”滴定至终点时的颜色变化是
③产品中(NH2)2CS的质量分数为
您最近一年使用:0次
解题方法
6 . 决定物质性质的重要因素是物质结构。请回答下列问题:
(1)基态K原子中,核外电子占据最高能层的符号是_______ ,占据该能层电子的电子云轮廓图形状为______________ 。
(2)已知元素M是组成物质 的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号
的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号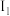 至
至 表示)如表所示:
表示)如表所示:
元素M化合态常见化合价是_________ 价,其基态原子电子排布式为_______
(3) 的中心原子的杂化方式为
的中心原子的杂化方式为__________ ,键角为____________
(4)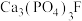 中非金属元素电负性由大到小的顺序为
中非金属元素电负性由大到小的顺序为_____________
(5)下列元素或化合物的性质变化顺序正确的是_______________
A.第一电离能: B.共价键的极性:
B.共价键的极性: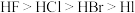
C.晶格能: D.热稳定性:
D.热稳定性: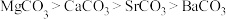
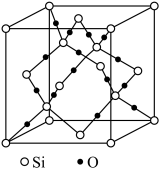
(6)如图是 晶胞,构成二氧化硅晶体结构的最小环是由
晶胞,构成二氧化硅晶体结构的最小环是由________ 个原子构成。已知晶胞参数为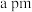 ,则其晶胞密度为
,则其晶胞密度为________  。
。
(1)基态K原子中,核外电子占据最高能层的符号是
(2)已知元素M是组成物质
 的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号
的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号 至
至 表示)如表所示:
表示)如表所示: |  |  |  | 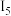 | |
电离能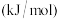 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是
(3)
 的中心原子的杂化方式为
的中心原子的杂化方式为(4)
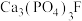 中非金属元素电负性由大到小的顺序为
中非金属元素电负性由大到小的顺序为(5)下列元素或化合物的性质变化顺序正确的是
A.第一电离能:
 B.共价键的极性:
B.共价键的极性: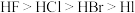
C.晶格能:
 D.热稳定性:
D.热稳定性: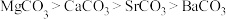
(6)如图是
 晶胞,构成二氧化硅晶体结构的最小环是由
晶胞,构成二氧化硅晶体结构的最小环是由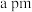 ,则其晶胞密度为
,则其晶胞密度为 。
。
您最近一年使用:0次
7 . Ⅰ.在 密闭容器中放入
密闭容器中放入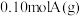 ,在一定温度进行如下反应:
,在一定温度进行如下反应:
容器内气体总压强(P)与起始压强 的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
回答下列问题
(1)下列能提高A的转化率的是_______
A.升高温度 B.体系中通入A气体
C.将D的浓度减小 D.通入稀有气体 ,使体系压强增大到原的5倍
,使体系压强增大到原的5倍
(2)该反应的平衡常数的表达式K_______ ,前2小时C的反应速率是_________  ;
;
(3)平衡时A的转化率___________ ,C的体积分数__________ (均保留两位有效数字)
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的物质的量取值范围
______ 
Ⅱ.已知乙酸是一种重要的化工原料,该反应所用的原理与工业合成乙酸的原理类似;常温下,将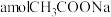 溶于水配成
溶于水配成 溶液,向其中滴加等体积的
溶液,向其中滴加等体积的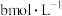 的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数
的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数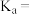
___________
 密闭容器中放入
密闭容器中放入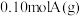 ,在一定温度进行如下反应:
,在一定温度进行如下反应:
容器内气体总压强(P)与起始压强
 的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)时间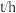 | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | |
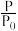 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
(1)下列能提高A的转化率的是
A.升高温度 B.体系中通入A气体
C.将D的浓度减小 D.通入稀有气体
 ,使体系压强增大到原的5倍
,使体系压强增大到原的5倍(2)该反应的平衡常数的表达式K
 ;
;(3)平衡时A的转化率
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的物质的量取值范围


Ⅱ.已知乙酸是一种重要的化工原料,该反应所用的原理与工业合成乙酸的原理类似;常温下,将
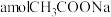 溶于水配成
溶于水配成 溶液,向其中滴加等体积的
溶液,向其中滴加等体积的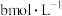 的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数
的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数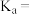
您最近一年使用:0次
解题方法
8 . 甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知 、
、 、
、 的燃烧热分别为
的燃烧热分别为 ,
,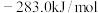 ,
,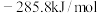 。利用甲烷制备合成气的反应为
。利用甲烷制备合成气的反应为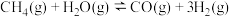
 。
。
根据上述数据能否计算
________ (填“能”或“否”),理由是________________ 。
(2)在某密闭容器中通入
 和
和 ,在不同条件下发生反应:
,在不同条件下发生反应:
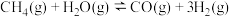

测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。

①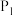
________  ,
,
________ (填“<”、“>”或“=”)。
②m、n、q三点的化学平衡常数大小关系为________ 。
③q点甲烷的转化率为________ ,该条件下的化学平衡常数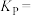
________ (用含有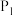 的表达式表示,
的表达式表示,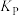 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
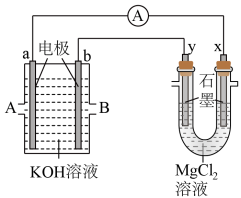
(3)用甲烷和 构成的燃料电池电解
构成的燃料电池电解 溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是________ ,x电极的电极反应式是________ 。
(1)已知
 、
、 、
、 的燃烧热分别为
的燃烧热分别为 ,
,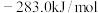 ,
,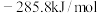 。利用甲烷制备合成气的反应为
。利用甲烷制备合成气的反应为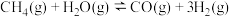
 。
。根据上述数据能否计算

(2)在某密闭容器中通入

 和
和 ,在不同条件下发生反应:
,在不同条件下发生反应: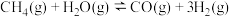

测得平衡时
 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
①
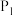
 ,
,
②m、n、q三点的化学平衡常数大小关系为
③q点甲烷的转化率为
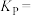
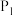 的表达式表示,
的表达式表示,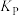 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。(3)用甲烷和
 构成的燃料电池电解
构成的燃料电池电解 溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
您最近一年使用:0次
9 . Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为____________
(2)已知HN3是一种弱酸,其在水溶液中的电离方程式为HN3 H++N3-,与N3-互为等电子体的一种分子为:
H++N3-,与N3-互为等电子体的一种分子为:_______ ,N3-离子杂化类型为___________ 。
(3)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是___________ ,1mol该配离子中所含σ键的数目为____ ,配位体NH3的空间构型为:___________ 。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________ ,立方体中Fe2+间连接起来形成的空间构型是_____________ 。
(5)NiO的晶体结构如下图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________ 。
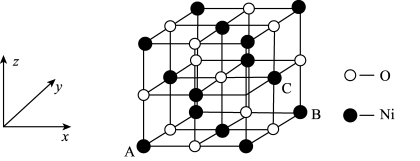
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如下图),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________ g(用含a、NA的代数式表示)。
(1)基态Co原子的价电子排布式为
(2)已知HN3是一种弱酸,其在水溶液中的电离方程式为HN3
 H++N3-,与N3-互为等电子体的一种分子为:
H++N3-,与N3-互为等电子体的一种分子为:(3)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为
(5)NiO的晶体结构如下图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如下图),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为

您最近一年使用:0次
2019-03-28更新
|
1020次组卷
|
5卷引用:【全国百强校】宁夏回族自治区石嘴山市第三中学2019届高三下学期一模考试理科综合化学试题
【全国百强校】宁夏回族自治区石嘴山市第三中学2019届高三下学期一模考试理科综合化学试题宁夏石嘴山市第三中学2020届高三上学期期末考试理综化学试题江西省赣州市赣县三中2020届高三下学期3月月考理综化学试题安徽省合肥市庐江县2019-2020学年高二下学期期末考试化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点13-14)
10 . 【化学选修-化学与技术】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作______________ 剂。
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式:___________________________ 。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是_________________________________________________ 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
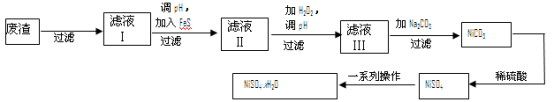
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为______________ 。
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是______________ ,调pH的目的是________________ 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是_______________________________________________________ 。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式:
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
您最近一年使用:0次
2019-01-30更新
|
545次组卷
|
2卷引用:2015届宁夏银川市第九中学高三下学期第一次模考理综化学试卷



