1 . 硼的化合物有重要应用。
(1)H3BO3的层内结构如图所示,虚线部分表示存在______ 键。

(2)H3BO3可由BCl3水解得到。依据价层电子对互斥理论(VSEPR)推测,BCl3的空间结构的名称为______ 。写出BCl3水解的化学方程式_______ 。
(3)H3BO3是一元酸,在水溶液中硼酸的电离方程式为:H3BO3+H2O [B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式
[B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式________ 。
(4)氨硼烷(NH3BH3)是一种有潜力的固体储氢材料。NH3BH3中N为-3价,B为+3价。H、B、N电负性由大到小的顺序为________ 。NH3BH3分子间存在“双氢键”使氨硼烷的熔点明显升高,“双氢键”能形成的原因是_______ 。
(1)H3BO3的层内结构如图所示,虚线部分表示存在

(2)H3BO3可由BCl3水解得到。依据价层电子对互斥理论(VSEPR)推测,BCl3的空间结构的名称为
(3)H3BO3是一元酸,在水溶液中硼酸的电离方程式为:H3BO3+H2O
 [B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式
[B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式(4)氨硼烷(NH3BH3)是一种有潜力的固体储氢材料。NH3BH3中N为-3价,B为+3价。H、B、N电负性由大到小的顺序为
您最近一年使用:0次
解题方法
2 . 化学工业为疫情防控提供了强有力的物质支撑,防护器材、消毒药剂等等都与化学有关,回答下列问题。
(1)口罩面罩所用的无纺布成分是聚丙烯,由丙烯制得聚丙烯的方程式是___________ ,一种口罩的滤材被提前注入了电荷,并且这部分电荷在正常储存时可以长时间存在,该滤材对___________ 成分的吸附效果较好。
a. b.胶体 c.水蒸气 d.NO
b.胶体 c.水蒸气 d.NO
(2)用于口罩灭菌处理的环氧乙烷,常用乙烯氧化法制备,其中一种目前比较认可的反应机理为




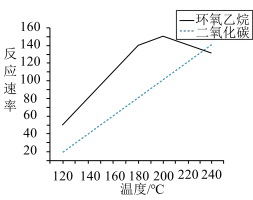
乙烯合成环氧乙烷的选择性为___________ %[选择性=  ]。氧化过程中,产物的生成速率与温度的关系如图,该反应适宜的反应温度为
]。氧化过程中,产物的生成速率与温度的关系如图,该反应适宜的反应温度为___________ ℃。
(3)过氧乙酸(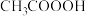 )也是一种常用的消毒剂,过氧乙酸中,极性键与非极性键数目之比为
)也是一种常用的消毒剂,过氧乙酸中,极性键与非极性键数目之比为___________ ,过氧乙酸的优点是杀菌速度快,缺点可能是___________ 。
(1)口罩面罩所用的无纺布成分是聚丙烯,由丙烯制得聚丙烯的方程式是
a.
 b.胶体 c.水蒸气 d.NO
b.胶体 c.水蒸气 d.NO(2)用于口罩灭菌处理的环氧乙烷,常用乙烯氧化法制备,其中一种目前比较认可的反应机理为





乙烯合成环氧乙烷的选择性为
 ]。氧化过程中,产物的生成速率与温度的关系如图,该反应适宜的反应温度为
]。氧化过程中,产物的生成速率与温度的关系如图,该反应适宜的反应温度为
(3)过氧乙酸(
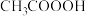 )也是一种常用的消毒剂,过氧乙酸中,极性键与非极性键数目之比为
)也是一种常用的消毒剂,过氧乙酸中,极性键与非极性键数目之比为
您最近一年使用:0次
3 . NOx、CO是重要污染物,处理NOx、CO等污染物对建设美丽中国具有重要意义。回答下列问题。
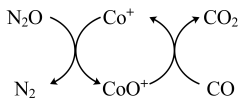
(1)已知CO(g)还原 的反应机理如图所示
的反应机理如图所示
已知:


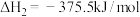
CO(g)与 反应的热化学方程式为
反应的热化学方程式为___________ 。
(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为 ,发生反应
,发生反应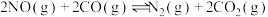 ,达到平衡时NO(g)和
,达到平衡时NO(g)和 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为___________ (结果保留一位小数),该反应的化学平衡常数Kp=___________ 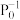 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,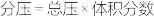 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则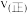
___________ 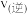 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(3)对于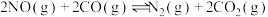 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
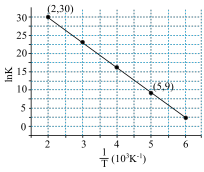
则该反应的活化能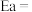
___________  。
。
(4)电解法转化 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
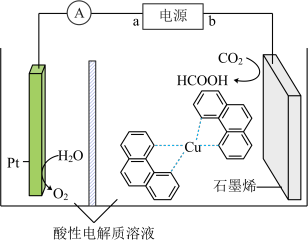
①a为电源的___________ (填“正极”或“负极”),该装置的阴极的电极反应式为___________ 。
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为___________ g。

(1)已知CO(g)还原
 的反应机理如图所示
的反应机理如图所示已知:



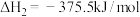
CO(g)与
 反应的热化学方程式为
反应的热化学方程式为(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为
 ,发生反应
,发生反应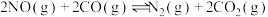 ,达到平衡时NO(g)和
,达到平衡时NO(g)和 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为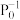 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,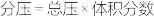 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则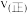
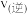 (填“>”“<”或“=”)
(填“>”“<”或“=”)(3)对于
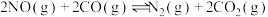 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
则该反应的活化能
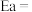
 。
。(4)电解法转化
 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
①a为电源的
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为
您最近一年使用:0次
2023-08-15更新
|
501次组卷
|
2卷引用:新疆乌鲁木齐市等3地2022-2023学年高三上学期第一次联考(一模)化学试题
解题方法
4 . 化学实验是研究物质及其变化的基本方法。
(1)某无色透明溶液中可能大量存在 、
、 、
、 中的几种离子。
中的几种离子。
①不做任何实验就可以肯定原溶液中不存在的离子是_______ 。
②取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______ 。
③取②的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是_______ 。
④原溶液可能大量存在的阴离子是下列A~D中的_______ (填标号)。
A. B.
B. C.
C. D.
D.
(2)某小组同学对比 和
和 的性质,并进行了如下实验:
的性质,并进行了如下实验:
①写出 水解的离子方程式
水解的离子方程式_______ 。
②向相同体积、相同浓度的 和
和 溶液中分别滴加
溶液中分别滴加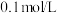 的盐酸,溶液pH变化如下图所示。
的盐酸,溶液pH变化如下图所示。
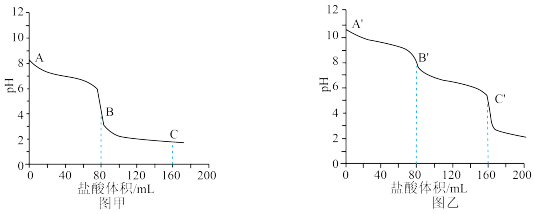
a.图_______ (填“甲”或“乙”)是 的滴定曲线。
的滴定曲线。
b.A′~B′的离子方程式为_______ 。写出A′溶液中各离子浓度由大到小的顺序_______ 。
c.A、B、C三点溶液中,水的电离程度由大到小的顺序为_______ 。
③向 的
的 和
和 溶液中分别滴加少量
溶液中分别滴加少量 溶液,均产生白色沉淀,后者有气体产生,且白色沉淀的成分只有一种。已知:
溶液,均产生白色沉淀,后者有气体产生,且白色沉淀的成分只有一种。已知:
i. 的
的 溶液中,
溶液中,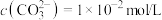 ,
,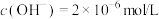
ii.25℃时,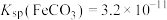 ,
,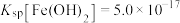
写出向 溶液中滴加少量
溶液中滴加少量 溶液发生的离子反应方程式
溶液发生的离子反应方程式_______ 。
(1)某无色透明溶液中可能大量存在
 、
、 、
、 中的几种离子。
中的几种离子。①不做任何实验就可以肯定原溶液中不存在的离子是
②取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
③取②的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是
④原溶液可能大量存在的阴离子是下列A~D中的
A.
 B.
B. C.
C. D.
D.
(2)某小组同学对比
 和
和 的性质,并进行了如下实验:
的性质,并进行了如下实验:①写出
 水解的离子方程式
水解的离子方程式②向相同体积、相同浓度的
 和
和 溶液中分别滴加
溶液中分别滴加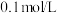 的盐酸,溶液pH变化如下图所示。
的盐酸,溶液pH变化如下图所示。
a.图
 的滴定曲线。
的滴定曲线。b.A′~B′的离子方程式为
c.A、B、C三点溶液中,水的电离程度由大到小的顺序为
③向
 的
的 和
和 溶液中分别滴加少量
溶液中分别滴加少量 溶液,均产生白色沉淀,后者有气体产生,且白色沉淀的成分只有一种。已知:
溶液,均产生白色沉淀,后者有气体产生,且白色沉淀的成分只有一种。已知:i.
 的
的 溶液中,
溶液中,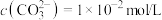 ,
,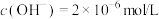
ii.25℃时,
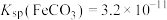 ,
,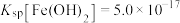
写出向
 溶液中滴加少量
溶液中滴加少量 溶液发生的离子反应方程式
溶液发生的离子反应方程式
您最近一年使用:0次
解题方法
5 . 下图是氮在生态系统中的循环。细菌和电催化可促使含氮物质进行氧化还原反应。

(1)写出N在周期表中的位置_______ 。 中N元素的化合价为
中N元素的化合价为_______ 。
(2)依据图中所示的氮循环,写出自然界中固氮的一种途径_______ 。
(3)氮肥是水体中铵态氮的主要来源之一、实验室中检验 可以用
可以用_______ 溶液,产生气体使湿润的_______ 色石蕊试纸变色。
(4)硝化过程中,含氮物质发生_______ (填“氧化”或“还原”)反应。
(5)铵态氮( )与亚硝态氮(
)与亚硝态氮( )可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生
)可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生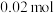 氮气时,转移电子的物质的量为
氮气时,转移电子的物质的量为_______  。
。
(6)由于过度的人为干预,水体中的硝酸盐水平正在增加。硝酸盐转化为无害氮的反硝化作用,可以通过电催化法来实现,写出在中性介质中硝酸盐转化为氮气的阴极电极反应式_______ 。

(1)写出N在周期表中的位置
 中N元素的化合价为
中N元素的化合价为(2)依据图中所示的氮循环,写出自然界中固氮的一种途径
(3)氮肥是水体中铵态氮的主要来源之一、实验室中检验
 可以用
可以用(4)硝化过程中,含氮物质发生
(5)铵态氮(
 )与亚硝态氮(
)与亚硝态氮( )可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生
)可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生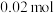 氮气时,转移电子的物质的量为
氮气时,转移电子的物质的量为 。
。(6)由于过度的人为干预,水体中的硝酸盐水平正在增加。硝酸盐转化为无害氮的反硝化作用,可以通过电催化法来实现,写出在中性介质中硝酸盐转化为氮气的阴极电极反应式
您最近一年使用:0次
6 . 二氧化氯( )是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
(1) 的制备:制备
的制备:制备 的常用方法有两种,分别为
的常用方法有两种,分别为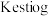 法、
法、 与
与 反应法。
反应法。
①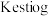 法制备
法制备 的原理为
的原理为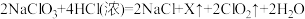 ,X的化学式为
,X的化学式为___________ ,将 通入
通入 溶液中,有红褐色沉淀生成,溶液中的主要阴离子为
溶液中,有红褐色沉淀生成,溶液中的主要阴离子为 、
、 ,若消耗
,若消耗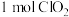 ,则被氧化的
,则被氧化的 为
为___________  。
。
② 与
与 反应法制备
反应法制备 ,生成物只有两种,参加反应的
,生成物只有两种,参加反应的 与
与 物质的量之比为
物质的量之比为___________ ,与 法相比,
法相比, 与
与 反应法的优点是
反应法的优点是___________ (填一条)。
(2) 的用途:除毒、除异味。
的用途:除毒、除异味。
① 可以将剧毒的氰化物氧化成
可以将剧毒的氰化物氧化成 和
和 ,离子方程式为
,离子方程式为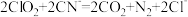 ,
, 属于
属于___________ (填“酸”“碱”或“两”)性氧化物,每转移 ,生成
,生成___________ L(标准状况下) 。
。
② 能把水溶液中有异味的
能把水溶液中有异味的 氧化成四价锰,使之形成不溶于水的
氧化成四价锰,使之形成不溶于水的 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
 )是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:(1)
 的制备:制备
的制备:制备 的常用方法有两种,分别为
的常用方法有两种,分别为 法、
法、 与
与 反应法。
反应法。①
 法制备
法制备 的原理为
的原理为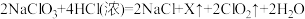 ,X的化学式为
,X的化学式为 通入
通入 溶液中,有红褐色沉淀生成,溶液中的主要阴离子为
溶液中,有红褐色沉淀生成,溶液中的主要阴离子为 、
、 ,若消耗
,若消耗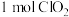 ,则被氧化的
,则被氧化的 为
为 。
。②
 与
与 反应法制备
反应法制备 ,生成物只有两种,参加反应的
,生成物只有两种,参加反应的 与
与 物质的量之比为
物质的量之比为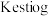 法相比,
法相比, 与
与 反应法的优点是
反应法的优点是(2)
 的用途:除毒、除异味。
的用途:除毒、除异味。①
 可以将剧毒的氰化物氧化成
可以将剧毒的氰化物氧化成 和
和 ,离子方程式为
,离子方程式为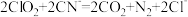 ,
, 属于
属于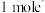 ,生成
,生成 。
。②
 能把水溶液中有异味的
能把水溶液中有异味的 氧化成四价锰,使之形成不溶于水的
氧化成四价锰,使之形成不溶于水的 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
2023-02-07更新
|
370次组卷
|
2卷引用:新疆乌鲁木齐市高级中学2022-2023学年高三第一次模拟考试化学试题
名校
解题方法
7 . 2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。
(1)基态钛原子的py原子轨道上的电子数为_______ 个。 与钛同周期的第ⅡA族和ⅢA族两种元素中第一电离能较大的是_______ (写 元素符号)。。
(2)Ti的配合物有多种。在Ti(CO)6、T(H2O) 和TiF
和TiF 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是_______ (写元素符号), Ti(H2O) 中∠H-O-H
中∠H-O-H_______ (填大于、小于或等于)单个水分子中∠H-O-H,原因为_______ ; Ti(NO3)4的球棍结构如图,Ti 的配位数是_______ ,N原子的杂化方式为_______ , 与NO 互为等电子体的分子为
互为等电子体的分子为_______ (写分子式)
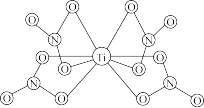
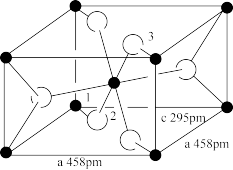
(3)钛白粉学名为二氧化钛,它是一种染料及颜料,其化学式为TiO2,如图为TiO2的晶胞结构图,回答:已知微粒1、2的坐标分别为(0,0, 0)和(0.31, 0.31, 0), 则微粒3的坐标为_______ ; 设阿伏加德罗常数的值为NA,TiO2的密度为_______ g·cm-3(列出计算式)。
(1)基态钛原子的py原子轨道上的电子数为
(2)Ti的配合物有多种。在Ti(CO)6、T(H2O)
 和TiF
和TiF 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是 中∠H-O-H
中∠H-O-H 互为等电子体的分子为
互为等电子体的分子为
(3)钛白粉学名为二氧化钛,它是一种染料及颜料,其化学式为TiO2,如图为TiO2的晶胞结构图,回答:已知微粒1、2的坐标分别为(0,0, 0)和(0.31, 0.31, 0), 则微粒3的坐标为

您最近一年使用:0次
2022-05-03更新
|
1308次组卷
|
3卷引用:新疆昌吉州2022届高三第二次诊断性测试理科综合化学试题
新疆昌吉州2022届高三第二次诊断性测试理科综合化学试题福建省连城县第一中学2022-2023学年高三上学期暑期月考化学试题(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题
名校
解题方法
8 .  与
与 在高温下发生反应:
在高温下发生反应: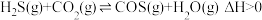 。在
。在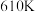 时,将
时,将 与
与 充入
充入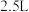 的空钢瓶中,经过
的空钢瓶中,经过 反应达到平衡,平衡时水蒸气的物质的量分数为0.125。
反应达到平衡,平衡时水蒸气的物质的量分数为0.125。
(1)用 的浓度变化表示的反应速率
的浓度变化表示的反应速率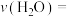
________ 。 的平衡转化率
的平衡转化率
_______  。
。
(2) 时该反应的平衡常数
时该反应的平衡常数 ,在此温度下按相同投料在相同容器中重复上述反应,经过
,在此温度下按相同投料在相同容器中重复上述反应,经过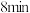 ,测得水蒸气的物质的量为
,测得水蒸气的物质的量为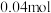 。判断此时该反应是否达到平衡
。判断此时该反应是否达到平衡___________ (填“是”“否”或“无法确定”)。
(3) 时,在体积一定的密闭容器中按原料初始组成
时,在体积一定的密闭容器中按原料初始组成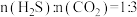 进行该反应,能判断反应达到化学平衡状态的依据是___________。
进行该反应,能判断反应达到化学平衡状态的依据是___________。
(4)要增大该反应的平衡常数K值,可采取的措施有___________。
 与
与 在高温下发生反应:
在高温下发生反应: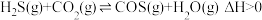 。在
。在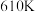 时,将
时,将 与
与 充入
充入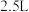 的空钢瓶中,经过
的空钢瓶中,经过 反应达到平衡,平衡时水蒸气的物质的量分数为0.125。
反应达到平衡,平衡时水蒸气的物质的量分数为0.125。(1)用
 的浓度变化表示的反应速率
的浓度变化表示的反应速率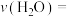
 的平衡转化率
的平衡转化率
 。
。(2)
 时该反应的平衡常数
时该反应的平衡常数 ,在此温度下按相同投料在相同容器中重复上述反应,经过
,在此温度下按相同投料在相同容器中重复上述反应,经过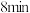 ,测得水蒸气的物质的量为
,测得水蒸气的物质的量为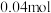 。判断此时该反应是否达到平衡
。判断此时该反应是否达到平衡(3)
 时,在体积一定的密闭容器中按原料初始组成
时,在体积一定的密闭容器中按原料初始组成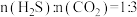 进行该反应,能判断反应达到化学平衡状态的依据是___________。
进行该反应,能判断反应达到化学平衡状态的依据是___________。| A.容器中压强不再改变 |
B.容器中 的物质的量分数不再改变 的物质的量分数不再改变 |
C. |
| D.容器中混合气体的密度不再改变 |
A.增大 的起始浓度 的起始浓度 | B.增大反应体系压强 |
| C.使用高效催化剂 | D.升高温度 |
您最近一年使用:0次
2022-01-15更新
|
522次组卷
|
3卷引用:新疆维吾尔自治区乌鲁木齐市2021-2022学年高三上学期第一次诊断性测试化学试题
新疆维吾尔自治区乌鲁木齐市2021-2022学年高三上学期第一次诊断性测试化学试题(已下线)第22讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省七台河市勃利县高级中学2022-2023学年高二上学期期中考试化学试题
9 . 化学与生产、生活、科学技术息息相关。
(1)生活中常用的“84”消毒液与洁厕灵(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:___________ 。
(2)中国古代著作中有“银针验毒”的记录,其原理类似为: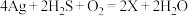 ,则X的化学式是
,则X的化学式是___________ ,其中 在该反应中
在该反应中___________ (填字母序号)。
A.是氧化剂 B.是还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)酯可用作饮料、化妆品中的香料。写出实验室制备乙酸乙酯的化学反应方程式:______ 。
(4) 和
和 都是大气污染物,汽车发动机工作时产生的
都是大气污染物,汽车发动机工作时产生的 和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是
和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是______ 。
(1)生活中常用的“84”消毒液与洁厕灵(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:
(2)中国古代著作中有“银针验毒”的记录,其原理类似为:
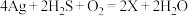 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.是氧化剂 B.是还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)酯可用作饮料、化妆品中的香料。写出实验室制备乙酸乙酯的化学反应方程式:
(4)
 和
和 都是大气污染物,汽车发动机工作时产生的
都是大气污染物,汽车发动机工作时产生的 和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是
和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是
您最近一年使用:0次
名校
10 . 研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价-物质类别关系图如图1所示。
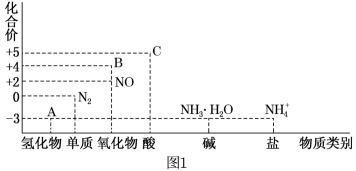
回答下列问题:
(1)图中A可以是___________ (写化学式)。符合图中B的物质之间的转化关系是___________ (用化学方程式表示)。
(2)实验室中,检验溶液中是否含有 的操作方法是
的操作方法是___________ 。
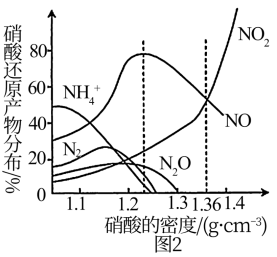
(3)图1中C代表硝酸。图2是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。下列叙述中不正确的是___________(填字母)。
(4)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入 的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图3所示。
的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图3所示。

①c点对应NaOH溶液的体积为___________ mL。
②de段发生反应的离子方程式为___________ 。

回答下列问题:
(1)图中A可以是
(2)实验室中,检验溶液中是否含有
 的操作方法是
的操作方法是(3)图1中C代表硝酸。图2是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。下列叙述中不正确的是___________(填字母)。

| A.硝酸的密度越大,其浓度越小 |
| B.当还原剂和温度都相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已 |
| C.硝酸的浓度越大,还原产物中N元素低化合价产物越少 |
D.当硝酸的密度大于 时,还原产物主要为NO、 时,还原产物主要为NO、 |
 的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图3所示。
的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图3所示。
①c点对应NaOH溶液的体积为
②de段发生反应的离子方程式为
您最近一年使用:0次
2021-12-08更新
|
621次组卷
|
4卷引用:新疆昌吉教育体系2021-2022学年高三上学期第三次模考化学试题
新疆昌吉教育体系2021-2022学年高三上学期第三次模考化学试题陕西省商洛市山阳中学2022-2023学年高三一模考试化学试题新疆生产建设兵团第二师八一中学2022-2023学年高三上学期11月月考化学试题(已下线)第四章 非金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)



