1 . 铅及其化合物用途多样。查资料得知 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:
(1)铅是碳的同族元索,铅原子基态价电子排布式为___________ ,常见价态为_____ 和_____ 。
(2) 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为___________ 。
(3) 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为___________ ; 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为___________ 。
(4) 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即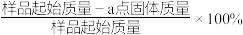 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为___________ 。 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①
②
上述过程中 的作用是
的作用是___________ ,请设计实验方案证明 的作用
的作用___________ 。
 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:(1)铅是碳的同族元索,铅原子基态价电子排布式为
(2)
 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为(3)
 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为(4)
 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即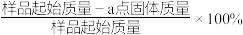 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为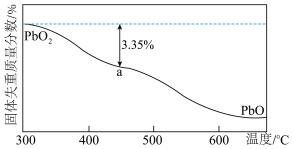
 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:①

②

上述过程中
 的作用是
的作用是 的作用
的作用
您最近一年使用:0次
名校
解题方法
2 . 汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
I.已知4CO(g)+2NO2(g) 4CO2(g)+N2(g)∆H=﹣1200kJ•mol﹣1
4CO2(g)+N2(g)∆H=﹣1200kJ•mol﹣1
(1)该反应在___ (填“高温、低温或任何温度”)下能自发进行。
(2)对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是___ (填标号)。
经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲___ 乙(填“>、=、<或不确定”,下同)。
②NO2的平衡浓度:甲___ 乙。
③甲中CO的转化率为50%,该反应的平衡常数为___ 。
II.柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。
(4)375℃时,测得排出的气体中含amol O2和0.0525 mol CO2,已知X为N2,Y为N2O,则a=___ 。
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是___ 。
I.已知4CO(g)+2NO2(g)
 4CO2(g)+N2(g)∆H=﹣1200kJ•mol﹣1
4CO2(g)+N2(g)∆H=﹣1200kJ•mol﹣1(1)该反应在
(2)对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是
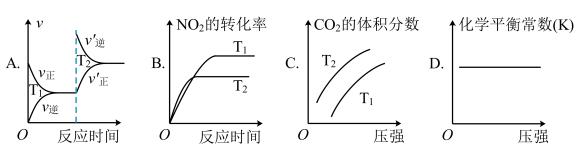
经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲
②NO2的平衡浓度:甲
③甲中CO的转化率为50%,该反应的平衡常数为
II.柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。
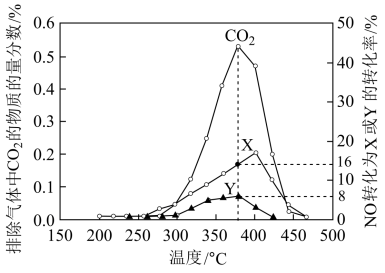
| 模拟尾气 | 气体(10mol) | 碳烟 | ||
| NO | O2 | He | ||
| 物质的量(mol) | 0.025 | 0.5 | 9.475 | 一定量 |
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是
您最近一年使用:0次
2020-06-17更新
|
1090次组卷
|
3卷引用:黑龙江省哈尔滨师范大学附属中学2020届高三6月复课线下考查理综化学试题
解题方法
3 . 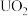 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应: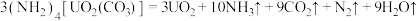 。阿伏加 德罗常数的值为
。阿伏加 德罗常数的值为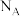 。
。
回答下列问题:
(1)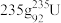 发生裂变反应:
发生裂变反应: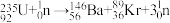 ,净产生的中子(
,净产生的中子(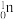 )数为
)数为________ 。基态 原子的外围电子排布式为
原子的外围电子排布式为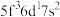 ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________ (填序号)。
A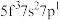 B
B 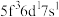 C
C  D
D 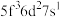
(2) 和
和 中,沸点较高的为
中,沸点较高的为________ ,与 形成的配离子稳定性较高的为
形成的配离子稳定性较高的为________ 。
(3) 中存在大
中存在大 键,形成该大
键,形成该大 键的电子数为
键的电子数为________ 。
(4)某种铀氮化物的晶体结构与 相同。
相同。 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
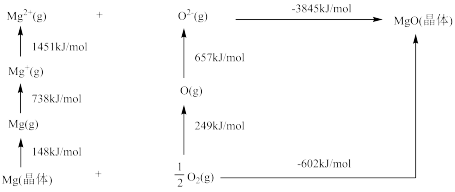
① 晶格能为
晶格能为________  。
。
② 的第二电离能大于
的第二电离能大于 的第二电离能,是由于
的第二电离能,是由于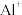 的半径较
的半径较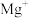 小、
小、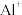 的核电荷更高以及
的核电荷更高以及_______ 。
(5)另一种铀氮化物的晶胞如下图所示, “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
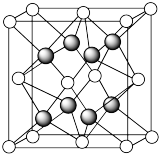
①铀元素的化合价为________ , “原子”的配位数为
“原子”的配位数为________ 。
②已知晶胞参数为 ,则晶体的密度为
,则晶体的密度为________  (列出计算式)。
(列出计算式)。
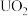 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应: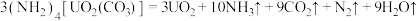 。阿伏加 德罗常数的值为
。阿伏加 德罗常数的值为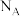 。
。回答下列问题:
(1)
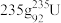 发生裂变反应:
发生裂变反应: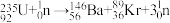 ,净产生的中子(
,净产生的中子(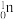 )数为
)数为 原子的外围电子排布式为
原子的外围电子排布式为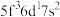 ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为A
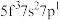 B
B 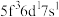 C
C  D
D 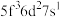
(2)
 和
和 中,沸点较高的为
中,沸点较高的为 形成的配离子稳定性较高的为
形成的配离子稳定性较高的为(3)
 中存在大
中存在大 键,形成该大
键,形成该大 键的电子数为
键的电子数为(4)某种铀氮化物的晶体结构与
 相同。
相同。 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
①
 晶格能为
晶格能为 。
。②
 的第二电离能大于
的第二电离能大于 的第二电离能,是由于
的第二电离能,是由于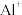 的半径较
的半径较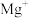 小、
小、 的核电荷更高以及
的核电荷更高以及(5)另一种铀氮化物的晶胞如下图所示,
 “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
①铀元素的化合价为
 “原子”的配位数为
“原子”的配位数为②已知晶胞参数为
 ,则晶体的密度为
,则晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
4 . 磷和砷是同主族的非金属元素。
(1)砷(As)元素位于元素周期表第____ 列;As原子能量最高的3个轨道在空间相互____ ;1个黄砷(As4)分子中含有_____ 个As﹣As键,键角_____ 度.
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于____ (选填编号).
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是_____ (选填编号).
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
___ Ni2++___ H2PO2﹣+___ H2O →____ Ni+____ H2PO3﹣+___ H+
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为______ 。
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
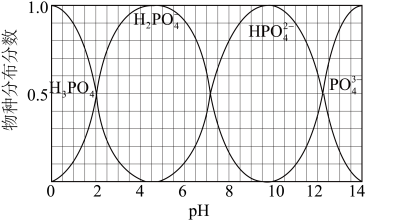
①pH=8时,溶液中主要含磷物种浓度大小关系为_________________ 。
②为获得尽可能纯的NaH2PO4,pH应控制在______________________________ 。
(1)砷(As)元素位于元素周期表第
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。

①pH=8时,溶液中主要含磷物种浓度大小关系为
②为获得尽可能纯的NaH2PO4,pH应控制在
您最近一年使用:0次
2020-03-24更新
|
168次组卷
|
2卷引用:黑龙江绥化市第一中学2021-2022学年高三下学期临考冲刺化学试题
2019·黑龙江大庆·二模
5 . 《旧唐书•舆服志》中关于白铜的记载:“自馀一品乘白铜饰犊车”,古时云南所产的镍白铜(铜镍合金)最为有名,称为“云白铜”,曾主要用于造币,亦可用于制作仿银饰品。请回答下列问题:

(1)基态Cu原子的核外电子排布式为[Ar]______ ,Cu的焰色反应为亮绿色,该现象与核外电子发生______ 有关。
(2)向CuSO4溶液中逐滴加入氨水,首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液。
①在[Cu(NH3)4]2+中Cu2+和NH3之间形成的化学键为______ ,Cu 提供的空轨道数目是______ ,提供孤电子对的成键原子是______ (填元素符号)。
②[Cu(NH3)4]SO4中含有的四种非金属元素中电负性最大的是______ (填元素符号),根据价层电子对互斥理论,氧与硫元素所形成的SO42-、SO2、SO3三种微粒中,中心原子价层电子对数不同于其他微粒的是______ 。
③在[Cu(NH3)4]SO4中,NH3的中心原子的杂化轨道类型为______ ,NH3的立体构型是______ ,HNO3和HNO2是N的两种含氧酸,请根据物质结构与性质的关系解释,HNO3比HNO2酸性强的原因是______ 。
(3)某镍白制合金的立方晶胞结构如图所示。
①在镍白铜合金中金属原子的堆积方式为______ 。
②若合金晶胞边长为a nm,其密度为dg•cm-3,则阿伏伽德罗常数(NA)的数值为______ (列出计算式即可)。

(1)基态Cu原子的核外电子排布式为[Ar]
(2)向CuSO4溶液中逐滴加入氨水,首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液。
①在[Cu(NH3)4]2+中Cu2+和NH3之间形成的化学键为
②[Cu(NH3)4]SO4中含有的四种非金属元素中电负性最大的是
③在[Cu(NH3)4]SO4中,NH3的中心原子的杂化轨道类型为
(3)某镍白制合金的立方晶胞结构如图所示。
①在镍白铜合金中金属原子的堆积方式为
②若合金晶胞边长为a nm,其密度为dg•cm-3,则阿伏伽德罗常数(NA)的数值为
您最近一年使用:0次
名校
6 . 工业上用焦炭与石英在高温下氮气流中发生如下反应,3SiO2(s)+6C(s)+2N2(g)⇌Si3N4(s)+6CO(g) +Q(Q>0),可制得一种新型陶瓷材料氮化硅(Si3N4),该材料熔点高,硬度大 ,广泛应用于光伏、轴承、冶金、化工、能源、环保等行业。回答下列问题:
(1)N2的电子式为____________ ,Si在元素周期表中的位置是_______________ ,氮化硅晶体属于__________ 晶体。
(2)该反应中,还原产物是______________ 。若测得反应生成22.4 L CO气体(标准状况下),则转移的电子的物质的量为_____________ 。
(3)该反应的平衡常数表达式K=__________________ ;若其他条件不变,降低温度,达到新的平衡时,K值____________ (填“增大”、“减小”或“不变”,以下同)。CO的浓度_________ ,SiO2的质量______________ 。
(4)已知在一定条件下的2L密闭容器中制备氮化硅,SiO2(纯度98.5%,所含杂质不与参与反应)剩余质量和反应时间的关系如右图所示。CO在0~10min的平均反应速率为_______ 。

(5)现用四氯化硅、氮气和氢气在高温下发生反应,可得较高纯度的氮化硅。反应的化学方程式为______________ 。
(1)N2的电子式为
(2)该反应中,还原产物是
(3)该反应的平衡常数表达式K=
(4)已知在一定条件下的2L密闭容器中制备氮化硅,SiO2(纯度98.5%,所含杂质不与参与反应)剩余质量和反应时间的关系如右图所示。CO在0~10min的平均反应速率为

(5)现用四氯化硅、氮气和氢气在高温下发生反应,可得较高纯度的氮化硅。反应的化学方程式为
您最近一年使用:0次
2019-03-02更新
|
278次组卷
|
4卷引用:黑龙江绥化市第一中学2021-2022学年高三下学期临考冲刺化学试题
名校
7 . 当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一。
(1)利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:
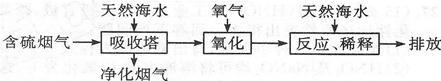
天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应的化学方程式是________ :
氧化后的海水需要加入NaOH,与之混合后才能排放。该操作的主要目的是__________________ 。
(2)利用氯碱工业产品来处理含SO2的烟气的流程如图所示:
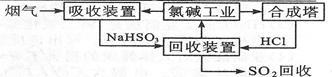
①“吸收装置”中发生反应的离子方程式是_____________________________________ 。
②上述流程中循环利用的物质是___________ .
(3)空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。

①通入空气吹出Br2,并用Na2CO3吸收的目的是________________________________ 。
②反应③中每生成3 mol Br2,转移电子的物质的____________ mol。
③为了除去工业Br2中微量的Cl2,可向工业Br2中__________ 填字母)。
a.通入HBr b.加入NaBr溶液
c.加入Na2CO3溶液 d.加入Na2SO3溶液
(4)从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是___________________ 。
②电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是___________ (填字母)。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
(1)利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:

天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应的化学方程式是
氧化后的海水需要加入NaOH,与之混合后才能排放。该操作的主要目的是
(2)利用氯碱工业产品来处理含SO2的烟气的流程如图所示:

①“吸收装置”中发生反应的离子方程式是
②上述流程中循环利用的物质是
(3)空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。

①通入空气吹出Br2,并用Na2CO3吸收的目的是
②反应③中每生成3 mol Br2,转移电子的物质的
③为了除去工业Br2中微量的Cl2,可向工业Br2中
a.通入HBr b.加入NaBr溶液
c.加入Na2CO3溶液 d.加入Na2SO3溶液
(4)从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是
②电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
您最近一年使用:0次
2019-01-30更新
|
306次组卷
|
2卷引用:2015届黑龙江省哈尔滨市六中高三下学期一模理综化学试卷
8 . 海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
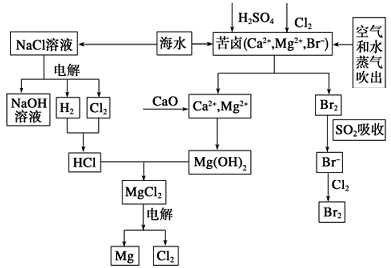
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式)________________________________________ 。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是________ ,电解饱和食盐水的化学反应方程式为______________ 。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O MgCl2+6H2O,该反应要在HCl气氛中进行,原因是
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________ 。
(3)苦卤中通入Cl2已经置换出Br2,为什么吹出后用SO2吸收转化为Br-再用Cl2置换_________ ,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________ 。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________ ;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________ 方法得到单质Br2。

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式)
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是
②制取MgCl2的过程中涉及反应:MgCl2·6H2O
 MgCl2+6H2O,该反应要在HCl气氛中进行,原因是
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是(3)苦卤中通入Cl2已经置换出Br2,为什么吹出后用SO2吸收转化为Br-再用Cl2置换
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是
您最近一年使用:0次
名校
9 . 以Cl2、NaOH、CO(NH2)2 (尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH− ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。

(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取Cl2时,阳极上产生也会产生少量的ClO2的电极反应式:________________________________ ;电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________ mol。
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________ ;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________ 。
(3)步骤Ⅱ合成N2H4·H2O的装置如下图所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_________________ ;使用冷凝管的目的是_________________________________ 。

(4)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3,欲测定亚硫酸钠产品的纯度设计如下实验方案,并进行实验。准确称取所得亚硫酸钠样品m g于烧杯中,加入适量蒸馏水配成100 mL待测溶液。移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1酸性KMnO4标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(假设杂质不反应)。样品中亚硫酸钠的质量分数为__________ (用含m、c、V的代数式表示)。某同学设计的下列滴定方式中,合理的是________ (夹持部分略去)(填字母序号)


已知:①Cl2+2OH−
 ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。

(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取Cl2时,阳极上产生也会产生少量的ClO2的电极反应式:
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(3)步骤Ⅱ合成N2H4·H2O的装置如下图所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是

(4)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3,欲测定亚硫酸钠产品的纯度设计如下实验方案,并进行实验。准确称取所得亚硫酸钠样品m g于烧杯中,加入适量蒸馏水配成100 mL待测溶液。移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1酸性KMnO4标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(假设杂质不反应)。样品中亚硫酸钠的质量分数为

您最近一年使用:0次
2018-12-30更新
|
1169次组卷
|
2卷引用:【全国百强校】黑龙江省哈尔滨市第六中学2019届高三冲刺押题卷(二)化学试题
名校
10 . 铅精矿可用于冶炼金属铅,其主要成分为PbS。
(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为____________________________ 。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____________________________________________________ 。
(2)湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
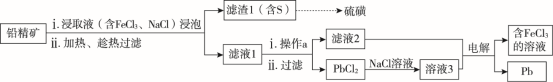
已知:PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq) + 2Cl-(aq) PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
①浸取液中FeCl3的作用是________________________________ 。
②操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是___________________________________________________________________ 。
③将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

ⅰ.溶液3应置于_________ (填“阴极室”或“阳极室”)中。
ⅱ.简述滤液2电解后再生为FeCl3的原理______________________________________ 。
ⅲ.若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数为___________ 。
(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为
(2)湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq) + 2Cl-(aq)
 PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 溶解度(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
①浸取液中FeCl3的作用是
②操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是
③将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

ⅰ.溶液3应置于
ⅱ.简述滤液2电解后再生为FeCl3的原理
ⅲ.若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数为
您最近一年使用:0次



