为了保护环境,化学实验产生的废液必须处理后才能排放。某兴趣小组对含有Fe3+、Cu2+、Ba2+三种金属离子的废液进行处理,设计实验流程如下:

(1)步骤(I)中沉淀A和滤液B分离的操作名称是___________ ,滤液B中的金属阳离子有Ba2+和___________ 。
(2)步骤(II)中生成的沉淀C是___________ 。
(3)步骤(III)中H2O2把Fe2+转化为Fe3+,H2O2作为___________ (填“氧化剂”或“还原剂”)。
(4)步骤(IV)中Fe3+和OH-反应的离子方程式为___________ 。

(1)步骤(I)中沉淀A和滤液B分离的操作名称是
(2)步骤(II)中生成的沉淀C是
(3)步骤(III)中H2O2把Fe2+转化为Fe3+,H2O2作为
(4)步骤(IV)中Fe3+和OH-反应的离子方程式为
2021高二上·福建·学业考试 查看更多[2]
更新时间:2023-07-19 19:15:16
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】活性 在橡胶、光学、化工及电子等行业中有重要应用。某工厂以铅锌烟气(主要成分为
在橡胶、光学、化工及电子等行业中有重要应用。某工厂以铅锌烟气(主要成分为 、
、 ,兼有少量
,兼有少量 、
、 )制备活性
)制备活性 的工艺流程如下:
的工艺流程如下:
(1)基态Zn原子的核外电子排布式为___________ 。
(2)为提高“酸浸”速率,可采取的措施___________ (写出一点即可)。
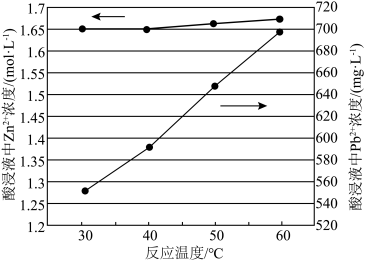
(3)“酸浸”时当浸出液pH为3.93时,温度与Zn、Pb元素浸出率的影响如图所示,则“酸浸”时采用30℃而不用更高温度的原因是___________ 。 溶液充分反应后过滤,滤渣Ⅰ中有
溶液充分反应后过滤,滤渣Ⅰ中有 ,该步反应的离子方程式为
,该步反应的离子方程式为___________ 。
(5)“还原”时,滤渣Ⅱ的主要成分为Pb、Cu,最适宜使用的试剂X是___________ (填化学式)。
(6)在“沉锌”中生成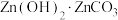 沉淀的化学方程式为
沉淀的化学方程式为___________ 。
(7)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的立方晶胞结构如图,晶胞参数为a pm。___________ 个。
②该铜锌合金晶体密度为___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 在橡胶、光学、化工及电子等行业中有重要应用。某工厂以铅锌烟气(主要成分为
在橡胶、光学、化工及电子等行业中有重要应用。某工厂以铅锌烟气(主要成分为 、
、 ,兼有少量
,兼有少量 、
、 )制备活性
)制备活性 的工艺流程如下:
的工艺流程如下: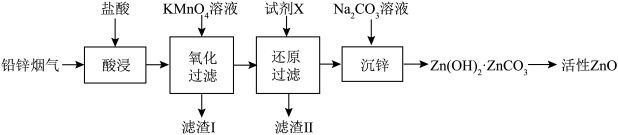
(1)基态Zn原子的核外电子排布式为
(2)为提高“酸浸”速率,可采取的措施
(3)“酸浸”时当浸出液pH为3.93时,温度与Zn、Pb元素浸出率的影响如图所示,则“酸浸”时采用30℃而不用更高温度的原因是
 溶液充分反应后过滤,滤渣Ⅰ中有
溶液充分反应后过滤,滤渣Ⅰ中有 ,该步反应的离子方程式为
,该步反应的离子方程式为(5)“还原”时,滤渣Ⅱ的主要成分为Pb、Cu,最适宜使用的试剂X是
(6)在“沉锌”中生成
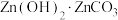 沉淀的化学方程式为
沉淀的化学方程式为(7)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的立方晶胞结构如图,晶胞参数为a pm。
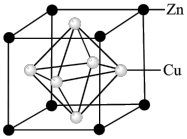
②该铜锌合金晶体密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】化学物质丰富多彩,化学反应千变万化,而常见物质之间的反应往往“隐藏着某些反应机理”。某学校化学兴趣小组对过氧化钠参与的某些反应进行了初步探究。
(I)该小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。

步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
请回答下列问题:
(1)装置①中反应的离子方程式是_______ ;
(2)装置②③中的试剂分别是_______ 、_______ ;本实验预期现象是步骤1带火星木条不复燃,步骤2带火星木条复燃;
(3)本小组还进一步探究了Na2O2与H2O的反应,实验如下:

下列有关说法不正确的是_______
(II)Na2O2具有强氧化性,H2具有还原性,该小组成员根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该小组设计并进行如图实验。

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:用小试管收集气体并检验其纯度,加热至Na2O2逐渐熔化,反应一段时间,
停止加热,充分冷却,关闭K1,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝。
(4)B装置中所盛放的试剂是_______ ,其作用是_______ 。
(5)由上述实验可推出Na2O2与H2反应的化学方程式为_______ 。
(I)该小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。

步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
请回答下列问题:
(1)装置①中反应的离子方程式是
(2)装置②③中的试剂分别是
(3)本小组还进一步探究了Na2O2与H2O的反应,实验如下:

下列有关说法不正确的是_______
| A.实验i中发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑ |
| B.实验iii中MnO2做H2O2分解反应的催化剂 |
| C.本实验可以说明Na2O2与H2O反应有H2O2生成 |
| D.本实验可以说明使酚酞试液褪色的是O2 |
(II)Na2O2具有强氧化性,H2具有还原性,该小组成员根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该小组设计并进行如图实验。

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:用小试管收集气体并检验其纯度,加热至Na2O2逐渐熔化,反应一段时间,
停止加热,充分冷却,关闭K1,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝。
(4)B装置中所盛放的试剂是
(5)由上述实验可推出Na2O2与H2反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】铍及其化合物用途广泛,以绿柱石(主要组成是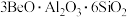 ,还含少量铁元素)和方解石(主要成分是
,还含少量铁元素)和方解石(主要成分是 )为原料生产铍的工艺流程如图所示:
)为原料生产铍的工艺流程如图所示:

已知:铝铵矾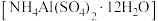 在不同温度下的溶解度如下表:
在不同温度下的溶解度如下表:
回答下列问题:
(1)绿柱石中Be元素的化合价为_____ 。“熔炼”中生成气体的电子式为_____ 。
(2)滤渣1中除 及难溶性硅酸盐外,还含有
及难溶性硅酸盐外,还含有_____ (填化学式);“转化”后,要得到铝铵矾晶体,在中学实验室中可采取的操作是_____ 、_____ 、过滤、洗涤、干燥。
(3)加 时,溶液中发生反应的离子方程式是
时,溶液中发生反应的离子方程式是_____ 。
(4)“沉铍”时,若选用氢氧化钠溶液可能造成的影响是_____ ,所得母液中的主要溶质可返回到_____ 工序循环利用。
(5)“沉铍”时加入氨水调节pH至7.5,列式并计算说明此时溶液中的铍离子是否沉淀完全_____ 。(已知:该条件下,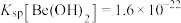 ;离子浓度
;离子浓度 时,可认为离子沉淀完全)
时,可认为离子沉淀完全)
(6)无水 可用作聚合反应的催化剂。
可用作聚合反应的催化剂。 、
、 与足量C在600~800℃制备
与足量C在600~800℃制备 的化学方程式为
的化学方程式为_____ 。
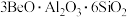 ,还含少量铁元素)和方解石(主要成分是
,还含少量铁元素)和方解石(主要成分是 )为原料生产铍的工艺流程如图所示:
)为原料生产铍的工艺流程如图所示:
已知:铝铵矾
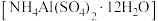 在不同温度下的溶解度如下表:
在不同温度下的溶解度如下表:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 |
| 溶解度/g | 2.10 | 5.00 | 7.74 | 10.9 | 14.9 | 26.7 |
(1)绿柱石中Be元素的化合价为
(2)滤渣1中除
 及难溶性硅酸盐外,还含有
及难溶性硅酸盐外,还含有(3)加
 时,溶液中发生反应的离子方程式是
时,溶液中发生反应的离子方程式是(4)“沉铍”时,若选用氢氧化钠溶液可能造成的影响是
(5)“沉铍”时加入氨水调节pH至7.5,列式并计算说明此时溶液中的铍离子是否沉淀完全
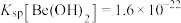 ;离子浓度
;离子浓度 时,可认为离子沉淀完全)
时,可认为离子沉淀完全)(6)无水
 可用作聚合反应的催化剂。
可用作聚合反应的催化剂。 、
、 与足量C在600~800℃制备
与足量C在600~800℃制备 的化学方程式为
的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】A、B、C、D、E是高中阶段学习的常见单质或化合物,单质A在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸。化合物C具有强氧化性、漂白性,是单质B与水反应的产物之一。化合物D是淡黄色物质,可用于呼吸面具,可由一种活泼金属E在氧气中燃烧得到。回答问题:
(1)物质C的名称____________ ,化合物D中非金属元素的化合价为___________ 。
(2)单质A在单质B中燃烧的化学方程式为___________ 。
(3)单质B与水反应的离子方程式为___________ 。
(4)化合物D与水反应的离子方程式___________ 。
(5)活泼金属E与水的反应中,单质E是______ (填“氧化剂”或“还原剂”)。
(1)物质C的名称
(2)单质A在单质B中燃烧的化学方程式为
(3)单质B与水反应的离子方程式为
(4)化合物D与水反应的离子方程式
(5)活泼金属E与水的反应中,单质E是
您最近一年使用:0次
【推荐2】虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2.他提出的三步反应如下(反应①、②里氟元素化合价不变):
①KMnO4+KF+H2O2+HF→K2MnF6+___________ +H2O
②SbCl5+HF→SbF5+ ___________
③2K2MnF6+ 4SbF5→ 4KSbF6+2MnF3+F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为___________ 。
(2)完成反应②:___________ 。
(3)反应③中的氧化剂为___________ ,被氧化的元素为___________ 。
(4)配平反应①,并用单线桥标出电子转移的方向和数目:___________ 。
①KMnO4+KF+H2O2+HF→K2MnF6+___________ +H2O
②SbCl5+HF→SbF5+ ___________
③2K2MnF6+ 4SbF5→ 4KSbF6+2MnF3+F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为
(2)完成反应②:
(3)反应③中的氧化剂为
(4)配平反应①,并用单线桥标出电子转移的方向和数目:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
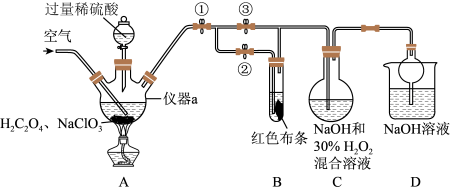
【推荐3】 又称百毒净,可用于水的净化和纸张、纺织品的漂白,用如图所示装置(夹持装置略)制备
又称百毒净,可用于水的净化和纸张、纺织品的漂白,用如图所示装置(夹持装置略)制备 并探究
并探究 的某些性质。
的某些性质。
回答下列问题:
(1)装置A用于制备 ,生成的
,生成的 中混有
中混有 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(2)关闭止水夹②,打开止水夹①、③,边通空气边向仪器a中滴加稀硫酸并加热,一段时间后,装置C中生成了 和气体,该反应体现了
和气体,该反应体现了 的
的_______ 性,若关闭止水夹③,打开止水夹②,装置B中可观察到的现象为_______ 。
(3)城市饮用水处理的新技术中用 替代
替代 ,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂
,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂 的消毒效率是
的消毒效率是 的
的_______ 倍(结果保留两位小数)。
 又称百毒净,可用于水的净化和纸张、纺织品的漂白,用如图所示装置(夹持装置略)制备
又称百毒净,可用于水的净化和纸张、纺织品的漂白,用如图所示装置(夹持装置略)制备 并探究
并探究 的某些性质。
的某些性质。
回答下列问题:
(1)装置A用于制备
 ,生成的
,生成的 中混有
中混有 ,该反应的化学方程式为
,该反应的化学方程式为(2)关闭止水夹②,打开止水夹①、③,边通空气边向仪器a中滴加稀硫酸并加热,一段时间后,装置C中生成了
 和气体,该反应体现了
和气体,该反应体现了 的
的(3)城市饮用水处理的新技术中用
 替代
替代 ,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂
,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂 的消毒效率是
的消毒效率是 的
的
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】高铁酸钾 是一种暗紫色固体,在强碱性溶液中稳定,但在
是一种暗紫色固体,在强碱性溶液中稳定,但在 催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量
催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量 、
、 等)制备高铁酸钾的工艺流程如图所示:
等)制备高铁酸钾的工艺流程如图所示:
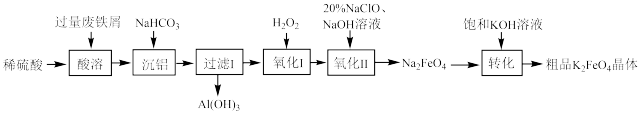
(1) 属于
属于___________ (填“酸”“碱”“盐”或“氧化物”),其中铁元素的化合价为___________ 价。
(2)加入 的目的是调节pH除铝,同时有气体生成,反应的离子方程式为
的目的是调节pH除铝,同时有气体生成,反应的离子方程式为________ 。
(3)“氧化I”发生反应的离子方程式为___________ 。
(4)“氧化Ⅱ”过程中每生成1mol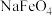 转移
转移___________ mol电子。
(5)水处理时,加入 作为净水消毒剂,发生反应的化学方程式为
作为净水消毒剂,发生反应的化学方程式为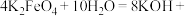
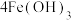 (胶体)
(胶体)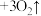 。
。 能用于消毒净水的原因是
能用于消毒净水的原因是___________ 。
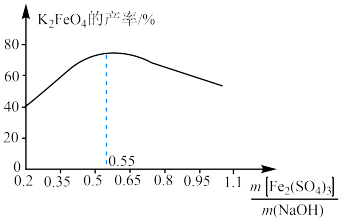
(6)在控制其他条件不变的情况下,改变 和NaOH的质量比对
和NaOH的质量比对 产率的影响如图所示,当二者质量比大于0.55时,随
产率的影响如图所示,当二者质量比大于0.55时,随 增大,
增大, 的产率下降的原因可能是
的产率下降的原因可能是___________ 。
(7)向 溶液中滴加
溶液中滴加 盐酸,产生黄绿色气体,说明
盐酸,产生黄绿色气体,说明 的氧化性
的氧化性________ (填“强”或“弱”)于 。另一种制备
。另一种制备 的反应原理为
的反应原理为 ,请分析
,请分析 和
和 的氧化性强弱关系相反的原因是
的氧化性强弱关系相反的原因是___________ 。
 是一种暗紫色固体,在强碱性溶液中稳定,但在
是一种暗紫色固体,在强碱性溶液中稳定,但在 催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量
催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量 、
、 等)制备高铁酸钾的工艺流程如图所示:
等)制备高铁酸钾的工艺流程如图所示:
(1)
 属于
属于(2)加入
 的目的是调节pH除铝,同时有气体生成,反应的离子方程式为
的目的是调节pH除铝,同时有气体生成,反应的离子方程式为(3)“氧化I”发生反应的离子方程式为
(4)“氧化Ⅱ”过程中每生成1mol
 转移
转移(5)水处理时,加入
 作为净水消毒剂,发生反应的化学方程式为
作为净水消毒剂,发生反应的化学方程式为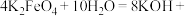
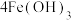 (胶体)
(胶体)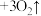 。
。 能用于消毒净水的原因是
能用于消毒净水的原因是(6)在控制其他条件不变的情况下,改变
 和NaOH的质量比对
和NaOH的质量比对 产率的影响如图所示,当二者质量比大于0.55时,随
产率的影响如图所示,当二者质量比大于0.55时,随 增大,
增大, 的产率下降的原因可能是
的产率下降的原因可能是
(7)向
 溶液中滴加
溶液中滴加 盐酸,产生黄绿色气体,说明
盐酸,产生黄绿色气体,说明 的氧化性
的氧化性 。另一种制备
。另一种制备 的反应原理为
的反应原理为 ,请分析
,请分析 和
和 的氧化性强弱关系相反的原因是
的氧化性强弱关系相反的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:

已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH 如下表所示。
②饱和氨水溶液中c(OH-)约为1×10-3mol/L。
请回答下列问题:
(1)固体C为________ (填化学式)。
(2)上述流程中两次使用试剂X,试剂X是________ (填“ 氨水” 或“氢氧化钠”), 其理由是________ 。
(3)向溶液D中滴入试剂X的过程中,发生反应的离子方程式有Mg2++2OH-=Mg(OH)2、________ 、________ 。
(4)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________ 。
(5)写出溶液F→溶液H的离子方程式:________ 。
(6)Ksp[Mg(OH)2]=________ 。

已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH 如下表所示。
| 阳离子 | Fe3+ | A13+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
请回答下列问题:
(1)固体C为
(2)上述流程中两次使用试剂X,试剂X是
(3)向溶液D中滴入试剂X的过程中,发生反应的离子方程式有Mg2++2OH-=Mg(OH)2、
(4)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是
(5)写出溶液F→溶液H的离子方程式:
(6)Ksp[Mg(OH)2]=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】某工厂的废金属屑的主要成分为铝、铁和铜,某化学兴趣小组在学习了元素及其化合物的相关知识后,设计了如图实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。

请回答:
(1)写出步骤Ⅱ中生成固体C的离子方程式:______ 。步骤Ⅲ中试剂X是_____
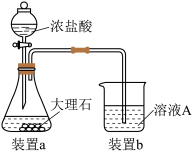
(2)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是______ 。
(3)用固体F制备CuSO4溶液,可设计如图三种途径:
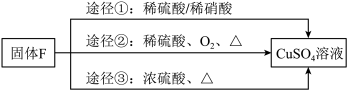
写出途径②中反应的化学方程式:______ 。
(4)用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为__________ 。

请回答:
(1)写出步骤Ⅱ中生成固体C的离子方程式:
(2)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是

(3)用固体F制备CuSO4溶液,可设计如图三种途径:

写出途径②中反应的化学方程式:
(4)用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为
您最近一年使用:0次



