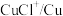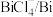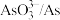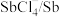1 . 铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为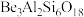 ,还含有一定量的
,还含有一定量的 和
和 )生产
)生产 的一种工艺流程如下。
的一种工艺流程如下。
①绿柱石主要化学成分写成氧化物的形式为: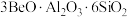
② 与
与 在周期表位置符合对角线规则,
在周期表位置符合对角线规则, 与
与 性质相似,
性质相似,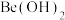 与
与 性质相似
性质相似
③ 被沉淀完全的
被沉淀完全的 ;
;
回答问题:
(1)粉碎的目的是______ ;
(2)无水 可用作聚合反应的催化剂。
可用作聚合反应的催化剂。 、
、 与
与 在600~800℃制备
在600~800℃制备 且生成一种毒性气体,化学方程式为
且生成一种毒性气体,化学方程式为_____ 。
(3)残渣主要成分是(填化学式)_____ 。浸取中浓硫酸的作用除了用于溶解矿石外,还起的作用_____ ;
(4)该流程中能循环使用的物质是_____ (填化学式)。
(5)沉铍时,用氢氧化钠溶液代替氨水得到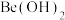 的量可能减少,用离子方程说明理由
的量可能减少,用离子方程说明理由_____ 。
(6)wg绿柱石( 含量14%)经过一系列反应后得到
含量14%)经过一系列反应后得到 ag(纯度90%),则
ag(纯度90%),则 的产率为
的产率为_____ 。
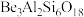 ,还含有一定量的
,还含有一定量的 和
和 )生产
)生产 的一种工艺流程如下。
的一种工艺流程如下。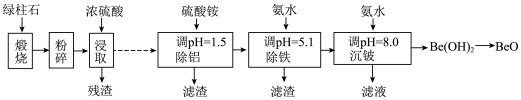
①绿柱石主要化学成分写成氧化物的形式为:
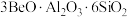
②
 与
与 在周期表位置符合对角线规则,
在周期表位置符合对角线规则, 与
与 性质相似,
性质相似,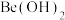 与
与 性质相似
性质相似③
 被沉淀完全的
被沉淀完全的 ;
;回答问题:
(1)粉碎的目的是
(2)无水
 可用作聚合反应的催化剂。
可用作聚合反应的催化剂。 、
、 与
与 在600~800℃制备
在600~800℃制备 且生成一种毒性气体,化学方程式为
且生成一种毒性气体,化学方程式为(3)残渣主要成分是(填化学式)
(4)该流程中能循环使用的物质是
(5)沉铍时,用氢氧化钠溶液代替氨水得到
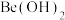 的量可能减少,用离子方程说明理由
的量可能减少,用离子方程说明理由(6)wg绿柱石(
 含量14%)经过一系列反应后得到
含量14%)经过一系列反应后得到 ag(纯度90%),则
ag(纯度90%),则 的产率为
的产率为
您最近一年使用:0次
名校
2 . 有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中只有C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
请回答下列问题:
(1)C是_______ (填元素名称)。
(2)上述元素中位于s区的有_______ (填元素符号)。
(3)与 互为等电子体的阴离子为
互为等电子体的阴离子为_______ 。
(4)已知C的氧化物CO与NiO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO_____ NiO(填“>”“<”或“=”)。
(5)浸金时,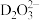 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成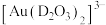 。
。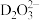 中的配位原子为
中的配位原子为_____ (填元素符号),其位置在______ (填“中心”或“端位”),理由是______ 。
 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。请回答下列问题:
(1)C是
(2)上述元素中位于s区的有
(3)与
 互为等电子体的阴离子为
互为等电子体的阴离子为(4)已知C的氧化物CO与NiO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO(5)浸金时,
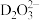 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成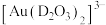 。
。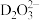 中的配位原子为
中的配位原子为
您最近一年使用:0次
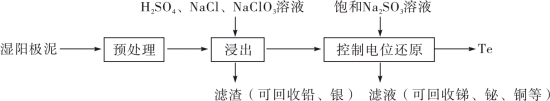
3 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)52Te的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是_______________ ;氧化后的原料还需粉碎、过筛,目的是_________________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式________________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和Na2SO3溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成_____________ (填化学式)。
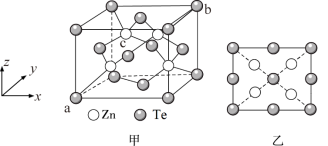
(5)将碲与锌一起加热,然后升华可制得碲化锌。碲化锌是一种重要的半导体材料,图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知a点的坐标为(0,0,0),b点的坐标为(1,1,1),则c点的坐标为_______________ ,设ZnTe的摩尔质量为M,阿伏加德罗常数的值为NA,密度为dg/cm3,则Zn与Te最近距离为___________ nm(列出计算式即可)。
物质 |
|
|
|
|
|
氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)52Te的基态原子的电子排布式为
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)将碲与锌一起加热,然后升华可制得碲化锌。碲化锌是一种重要的半导体材料,图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知a点的坐标为(0,0,0),b点的坐标为(1,1,1),则c点的坐标为
您最近一年使用:0次
7日内更新
|
56次组卷
|
2卷引用:福建省永春一中2023-2024学年高三化学最后一卷试卷
名校
4 . 有机物A-E有如下转化关系,A是最简单的不饱和烃,B和D可做食品调味剂,E有浓郁香味。回答下列问题,___________ 。
(2)B的官能团名称是___________ 。
(3)A至E中属于电解质的物质的电离方程式是___________ 。
(4)以下物质与B溶液、D溶液作用有明显不同现象的是___________。
(5)如上转化中涉及多种反应类型,写出属于取代反应的化学方程式___________ 。
(6)E有较多的同分异构体,写出其中一种含有 和
和 的结构简式
的结构简式___________ 。
(7)A与苯反应生成乙苯: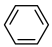

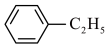 ,反应类型是
,反应类型是___________ 。
(2)B的官能团名称是
(3)A至E中属于电解质的物质的电离方程式是
(4)以下物质与B溶液、D溶液作用有明显不同现象的是___________。
| A.NaOH溶液 | B.NaHCO3溶液 | C.紫色石蕊试液 | D.苯 |
(5)如上转化中涉及多种反应类型,写出属于取代反应的化学方程式
(6)E有较多的同分异构体,写出其中一种含有
 和
和 的结构简式
的结构简式(7)A与苯反应生成乙苯:


 ,反应类型是
,反应类型是
您最近一年使用:0次
名校
5 . 借助李比希法和现代科学仪器可以确定分子结构。某化学实验小组利用如图所示的装置测定某有机化合物X的组成及结构,取6.72gX与足量氧气充分燃烧,实验结束后,高氯酸镁的质量增加8.64g,碱石棉(吸收CO2)的质量增加21.12g。___________ (填“含”或“不含”)氧元素,X的实验式为___________ 。
(2)已知X的相对分子质量为___________ ,则X的分子式为___________ 。
(3)通过核磁共振氢谱仪测得X的核磁共振氢谱图中只有1组峰,则X可能的结构简式为_____ 。
(4)X的同分异构体(不考虑立体异构)中能满足下列条件的有___________ 种,其中核磁共振氢谱有3组峰,且峰面积之比为3:2:1的是___________ (写结构简式)。
①使溴水因发生反应而褪色
②碳骨架主链上的碳原子数不小于5
③没有环状结构

(2)已知X的相对分子质量为
(3)通过核磁共振氢谱仪测得X的核磁共振氢谱图中只有1组峰,则X可能的结构简式为
(4)X的同分异构体(不考虑立体异构)中能满足下列条件的有
①使溴水因发生反应而褪色
②碳骨架主链上的碳原子数不小于5
③没有环状结构
您最近一年使用:0次
名校
解题方法
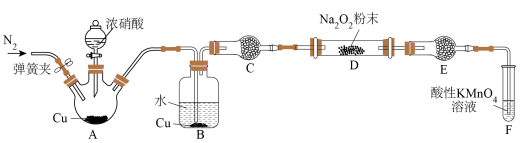
6 . 某研究性学习小组学生用图中所示装置(部分夹持装置略)探究NO与Na2O2反应的情况,提出假设并进行相关实验。 反应生成NO
反应生成NO 和Mn2+。
和Mn2+。
(1)盛装浓硝酸的仪器名称为_______ 。
(2)反应结束后打开弹簧夹,通入过量N2的目的是_______ 。
(3)C、E中所盛装的试剂不能是_______ (填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰
(4)F中发生反应的氧化剂与还原剂的物质的量之比为______ 。
(5)充分反应后,检验D装置中产物的方法是:取D装置中产物少许,_______ ,则产物是NaNO2。
(6)测定NaNO2的纯度:准确称取反应后的固体4.00g于烧杯中,加入煮沸并冷却的蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,使0.1mol L-1的酸性KMnO4溶液恰好褪色,用去20.00mL的酸性KMnO4溶液。已知:滴定过程中的离子反应方程式为2MnO
L-1的酸性KMnO4溶液恰好褪色,用去20.00mL的酸性KMnO4溶液。已知:滴定过程中的离子反应方程式为2MnO +6H++5NO
+6H++5NO =2Mn2++5NO
=2Mn2++5NO +3H2O。所得固体中NaNO2的纯度(质量分数)为
+3H2O。所得固体中NaNO2的纯度(质量分数)为_______ 。(NaNO2的摩尔质量为69g mol-1)
mol-1)
 反应生成NO
反应生成NO 和Mn2+。
和Mn2+。(1)盛装浓硝酸的仪器名称为
(2)反应结束后打开弹簧夹,通入过量N2的目的是
(3)C、E中所盛装的试剂不能是
a.无水硫酸铜 b.无水氯化钙 c.碱石灰
(4)F中发生反应的氧化剂与还原剂的物质的量之比为
(5)充分反应后,检验D装置中产物的方法是:取D装置中产物少许,
(6)测定NaNO2的纯度:准确称取反应后的固体4.00g于烧杯中,加入煮沸并冷却的蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,使0.1mol
 L-1的酸性KMnO4溶液恰好褪色,用去20.00mL的酸性KMnO4溶液。已知:滴定过程中的离子反应方程式为2MnO
L-1的酸性KMnO4溶液恰好褪色,用去20.00mL的酸性KMnO4溶液。已知:滴定过程中的离子反应方程式为2MnO +6H++5NO
+6H++5NO =2Mn2++5NO
=2Mn2++5NO +3H2O。所得固体中NaNO2的纯度(质量分数)为
+3H2O。所得固体中NaNO2的纯度(质量分数)为 mol-1)
mol-1)
您最近一年使用:0次
名校
解题方法
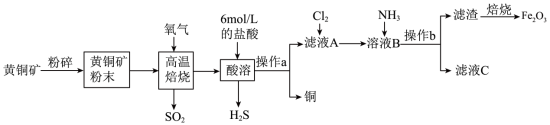
7 . 铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为CuFeS2,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
(1)将黄铜矿粉碎的目的是_______ 。
(2)高温焙烧时发生的反应方程式为CuFeS2+O2 SO2+FeS+Cu,该反应中,还原产物是
SO2+FeS+Cu,该反应中,还原产物是_______ 。
(3)操作a使用的玻璃仪器除了烧杯、漏斗、还有_______ 。
(4)写出滤液A中通入Cl2的离子方程式_______ 。
(5)滤液C的主要成分是_______ (填化学式),操作b后检验滤渣已经洗涤干净的实验操作为:取少量最后一次洗涤液于试管中,_______ ,则证明沉淀已经洗涤干净。
(6)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O,由图甲和图乙判断使用硫杆菌的最佳条件:温度为_______ 、pH为_______ 。
(1)将黄铜矿粉碎的目的是
(2)高温焙烧时发生的反应方程式为CuFeS2+O2
 SO2+FeS+Cu,该反应中,还原产物是
SO2+FeS+Cu,该反应中,还原产物是(3)操作a使用的玻璃仪器除了烧杯、漏斗、还有
(4)写出滤液A中通入Cl2的离子方程式
(5)滤液C的主要成分是
(6)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O,由图甲和图乙判断使用硫杆菌的最佳条件:温度为

您最近一年使用:0次
名校
解题方法
8 . 回答下列问题。
Ⅰ.根据要求回答下列有关问题:
(1)现有下列各组物质:① 和
和 ②
② 和
和 ③
③ 和
和 ④
④ 和
和
属于同系物的是_______ (填序号,下同);属于同分异构体的是_______ ;属于同一种物质的是_______ ;属于同素异形体的是_______ 。
(2)有A、B、C、D四种有机物,A、B属于烃类物质,C是烃的衍生物。A是含氢质量分数最大的有机物,分子结构为正四面体;B的球棍模型为 ;B与水发生加成反应得到C,C的相对分子质量为46,空间填充模型为
;B与水发生加成反应得到C,C的相对分子质量为46,空间填充模型为 。
。
①A的电子式是_______ ,C中官能团的名称是_______ 。
②物质B使溴水褪色的化学方程式为_______ 。
Ⅱ.利用甲烷与氯气光照下发生反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
提示:D装置的石棉中均匀混有足量KI粉末_______ 。
(4)B装置有三种功能:①使气体混合均匀②控制气流速度,调整气体比例③_______ 。
(5)请写出C装置中生成常温下全呈气态产物的化学方程式:_______ ,该反应属于有机反应类型为:_______ 。
Ⅰ.根据要求回答下列有关问题:
(1)现有下列各组物质:①
 和
和 ②
② 和
和 ③
③ 和
和 ④
④ 和
和
属于同系物的是
(2)有A、B、C、D四种有机物,A、B属于烃类物质,C是烃的衍生物。A是含氢质量分数最大的有机物,分子结构为正四面体;B的球棍模型为
 ;B与水发生加成反应得到C,C的相对分子质量为46,空间填充模型为
;B与水发生加成反应得到C,C的相对分子质量为46,空间填充模型为 。
。①A的电子式是
②物质B使溴水褪色的化学方程式为
Ⅱ.利用甲烷与氯气光照下发生反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
提示:D装置的石棉中均匀混有足量KI粉末

(4)B装置有三种功能:①使气体混合均匀②控制气流速度,调整气体比例③
(5)请写出C装置中生成常温下全呈气态产物的化学方程式:
您最近一年使用:0次
名校
解题方法
9 . 乙酸苯甲酯(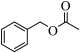 )是一种可从茉莉花中提取的有香味的物质。也可以用甲苯(
)是一种可从茉莉花中提取的有香味的物质。也可以用甲苯( )和乙醇为原料进行人工合成。一种合成路线如图:
)和乙醇为原料进行人工合成。一种合成路线如图:
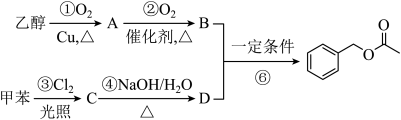
 R-OH
R-OH回答下列问题:
(1)写出乙酸苯甲酯的分子式
(2)写出反应①的化学方程式
(3)反应④的反应类型为
(4) D分子
(5)反应
(6)运用上述已知信息,也可以用甲苯和乙醇为原料合成与乙酸苯甲酯互为同分异构体的另一种酯X,则X的结构简式为:
您最近一年使用:0次
名校
10 . 硼、氮、铁、钴、镍等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是______(填标号)。
(2)硼酸( )为片层状白色晶体,层内
)为片层状白色晶体,层内 分子间通过氢键相连,如图所示。
分子间通过氢键相连,如图所示。 水溶液中存在
水溶液中存在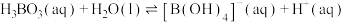 的平衡,回答下列问题。
的平衡,回答下列问题。__________ 。
②下列关于硼酸的说法正确的是__________ (填序号)。
a. 是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
c.硼酸分子的稳定性与氢键有关 d.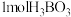 晶体中有
晶体中有 氢键
氢键
(3)叠氮化合物在化工上有重要应用, 为叠氮离子,写出与
为叠氮离子,写出与 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式__________ (写出一种即可),其立体构型为__________ 。
(4) 的结构如图所示,
的结构如图所示, 中
中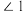 、
、 、
、 由大到小的顺序是
由大到小的顺序是____________________ 。 )晶胞沿
)晶胞沿 、
、 或
或 轴任意一个方向的投影如下图所示。晶胞中
轴任意一个方向的投影如下图所示。晶胞中 处于各顶角位置,则O处于
处于各顶角位置,则O处于__________ 位置。
①从该晶胞中能分割出来的结构图有_______ (填标号)。 ,
, 为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有__________ 个,该距离为__________ pm(仅列式不计算)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是______(填标号)。
A.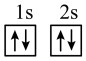 | B. |
C.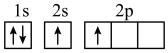 | D.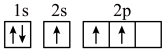 |
(2)硼酸(
 )为片层状白色晶体,层内
)为片层状白色晶体,层内 分子间通过氢键相连,如图所示。
分子间通过氢键相连,如图所示。 水溶液中存在
水溶液中存在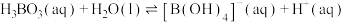 的平衡,回答下列问题。
的平衡,回答下列问题。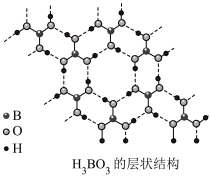
②下列关于硼酸的说法正确的是
a.
 是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
是一元酸 b.硼酸水溶液中水的电离平衡受到抑制c.硼酸分子的稳定性与氢键有关 d.
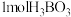 晶体中有
晶体中有 氢键
氢键(3)叠氮化合物在化工上有重要应用,
 为叠氮离子,写出与
为叠氮离子,写出与 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式(4)
 的结构如图所示,
的结构如图所示, 中
中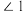 、
、 、
、 由大到小的顺序是
由大到小的顺序是
 )晶胞沿
)晶胞沿 、
、 或
或 轴任意一个方向的投影如下图所示。晶胞中
轴任意一个方向的投影如下图所示。晶胞中 处于各顶角位置,则O处于
处于各顶角位置,则O处于
①从该晶胞中能分割出来的结构图有
a. b.
b.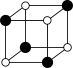 c.
c.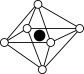 d.
d. e.
e.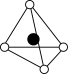
 ,
, 为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
您最近一年使用:0次