解题方法
1 . K是一种抗病毒药物的重要中间体,K的一种合成路线如下(部分试剂和条件略去)。
(1)A中官能团的名称为___________ 。
(2)B中碳原子的轨道杂化类型为___________ 。
(3)由C生成E的化学方程式为___________ 。
(4)E→F的反应类型为___________ 。
(5)H的结构简式为___________ 。
(6)K分子中具有孤电子对的原子数目有___________ 个。
(7)在H的同分异构体中,同时满足下列条件的共有___________ 种(不考虑立体异构)。
①含有苯环且苯环上只有一个取代基;
②能与金属钠反应产生 。
。
其中,不含手性碳原子的同分异构体的结构简式为___________ (任写一种)。
已知:.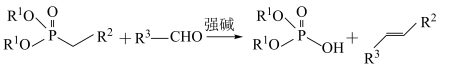
(1)A中官能团的名称为
(2)B中碳原子的轨道杂化类型为
(3)由C生成E的化学方程式为
(4)E→F的反应类型为
(5)H的结构简式为
(6)K分子中具有孤电子对的原子数目有
(7)在H的同分异构体中,同时满足下列条件的共有
①含有苯环且苯环上只有一个取代基;
②能与金属钠反应产生
 。
。其中,不含手性碳原子的同分异构体的结构简式为
您最近一年使用:0次
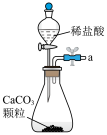
2 . 某化学兴趣小组为了探究 的性质,设计了如图所示的实验装置:
的性质,设计了如图所示的实验装置: 溶液的仪器名称是
溶液的仪器名称是_______ ;
(2)实验观察到装置C中产生淡黄色沉淀,该反应的化学方程式是_______ ;该反应氧化剂与还原剂物质的量之比是_______ ;
(3)实验观察到装置B、D、E中溶液均褪色,其中体现 还原性的是
还原性的是_______ (填标号)装置,体现 漂白性的是
漂白性的是_______ (填标号)装置;
(4)酸性 溶液可用于测定空气中
溶液可用于测定空气中 的含量。化学兴趣小组的同学将空气样品经过管道以
的含量。化学兴趣小组的同学将空气样品经过管道以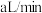 的流速通入密闭容器中的
的流速通入密闭容器中的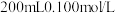 的酸性
的酸性 溶液,经过
溶液,经过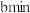 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 被
被 溶液充分氧化吸收。
溶液充分氧化吸收。
① 与酸性
与酸性 溶液反应的离子方程式为
溶液反应的离子方程式为_______ ;
②该空气样品中 的含量是
的含量是_______ 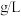 。
。
 的性质,设计了如图所示的实验装置:
的性质,设计了如图所示的实验装置: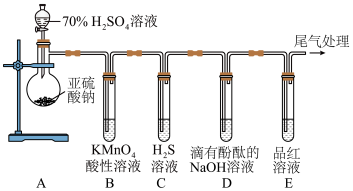
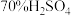 溶液的仪器名称是
溶液的仪器名称是(2)实验观察到装置C中产生淡黄色沉淀,该反应的化学方程式是
(3)实验观察到装置B、D、E中溶液均褪色,其中体现
 还原性的是
还原性的是 漂白性的是
漂白性的是(4)酸性
 溶液可用于测定空气中
溶液可用于测定空气中 的含量。化学兴趣小组的同学将空气样品经过管道以
的含量。化学兴趣小组的同学将空气样品经过管道以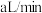 的流速通入密闭容器中的
的流速通入密闭容器中的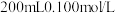 的酸性
的酸性 溶液,经过
溶液,经过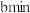 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 被
被 溶液充分氧化吸收。
溶液充分氧化吸收。①
 与酸性
与酸性 溶液反应的离子方程式为
溶液反应的离子方程式为②该空气样品中
 的含量是
的含量是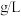 。
。
您最近一年使用:0次
3 . 硫酸亚铁铵 又称莫尔盐,是一种重要的化工原料,用途十分广泛。可用黄铁矿(主要含
又称莫尔盐,是一种重要的化工原料,用途十分广泛。可用黄铁矿(主要含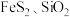 等)制备莫尔盐,该过程中产生的废气同时也可用于工业制硫酸,流程如下:
等)制备莫尔盐,该过程中产生的废气同时也可用于工业制硫酸,流程如下: 中S元素的化合价为
中S元素的化合价为_______ ;
(2)在焙烧前通常将黄铁矿粉碎,其目的是_______ ;焙烧的主要反应化学方程式是_______ ;
(3)滤渣1的主要成分是_______ ;
(4)为证实所得莫尔盐样品中不含 ,实验方案为:取其少量样品溶于试管中,加入
,实验方案为:取其少量样品溶于试管中,加入_______ (填化学式),现象是_______ ,证明不含 ;
;
(5)吸收 气体时用98.3%的浓硫酸而不用水,原因是
气体时用98.3%的浓硫酸而不用水,原因是_______ ;
(6)硫酸工厂的尾气中仍含有一定量 ,可用氨碱法进行处理。用过量氨水吸收
,可用氨碱法进行处理。用过量氨水吸收 的离子方程式为
的离子方程式为_______ 。
 又称莫尔盐,是一种重要的化工原料,用途十分广泛。可用黄铁矿(主要含
又称莫尔盐,是一种重要的化工原料,用途十分广泛。可用黄铁矿(主要含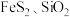 等)制备莫尔盐,该过程中产生的废气同时也可用于工业制硫酸,流程如下:
等)制备莫尔盐,该过程中产生的废气同时也可用于工业制硫酸,流程如下:
 中S元素的化合价为
中S元素的化合价为(2)在焙烧前通常将黄铁矿粉碎,其目的是
(3)滤渣1的主要成分是
(4)为证实所得莫尔盐样品中不含
 ,实验方案为:取其少量样品溶于试管中,加入
,实验方案为:取其少量样品溶于试管中,加入 ;
;(5)吸收
 气体时用98.3%的浓硫酸而不用水,原因是
气体时用98.3%的浓硫酸而不用水,原因是(6)硫酸工厂的尾气中仍含有一定量
 ,可用氨碱法进行处理。用过量氨水吸收
,可用氨碱法进行处理。用过量氨水吸收 的离子方程式为
的离子方程式为
您最近一年使用:0次
4 . 以硫酸厂矿渣(含 、
、 、
、 等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示:
等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示: 化学性质极不活泼,不溶于水也不溶于酸或碱。ii.
化学性质极不活泼,不溶于水也不溶于酸或碱。ii.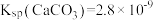 ;
;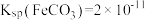 。回答下列问题:
。回答下列问题:
(1)为了提高“酸浸”的效率可以采用的措施有(写出其中一种)_______ 。
(2)“滤渣”中主要成分为(填化学式)_______ 。
(3)①“沉铁”过程中有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为_______ 。
②“沉铁”过程中往往有副产物 生成,分析原因是
生成,分析原因是_______ 。
③若用 “沉铁”,则无副产物
“沉铁”,则无副产物 产生,当反应完成时,溶液
产生,当反应完成时,溶液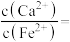
_______ 。
(4)利用制备的铁黄进行如图实验:_______ 。
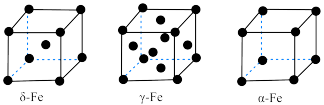
(5)铁有 、
、 、
、 三种晶型,各晶胞结构下图,则
三种晶型,各晶胞结构下图,则 、
、 两种晶胞中铁原子的配位数之比为
两种晶胞中铁原子的配位数之比为_______  -Fe的晶胞边长为
-Fe的晶胞边长为 ,则
,则 原子半径为
原子半径为_______  。
。
 、
、 、
、 等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示:
等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示: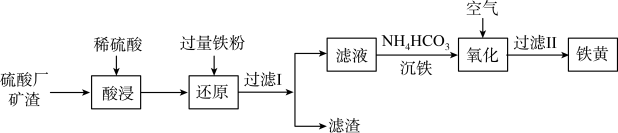
 化学性质极不活泼,不溶于水也不溶于酸或碱。ii.
化学性质极不活泼,不溶于水也不溶于酸或碱。ii.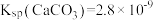 ;
;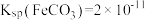 。回答下列问题:
。回答下列问题:(1)为了提高“酸浸”的效率可以采用的措施有(写出其中一种)
(2)“滤渣”中主要成分为(填化学式)
(3)①“沉铁”过程中有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为②“沉铁”过程中往往有副产物
 生成,分析原因是
生成,分析原因是③若用
 “沉铁”,则无副产物
“沉铁”,则无副产物 产生,当反应完成时,溶液
产生,当反应完成时,溶液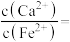
(4)利用制备的铁黄进行如图实验:
(5)铁有
 、
、 、
、 三种晶型,各晶胞结构下图,则
三种晶型,各晶胞结构下图,则 、
、 两种晶胞中铁原子的配位数之比为
两种晶胞中铁原子的配位数之比为 -Fe的晶胞边长为
-Fe的晶胞边长为 ,则
,则 原子半径为
原子半径为 。
。
您最近一年使用:0次
解题方法
5 . 我国化工专家侯德榜提出“侯氏制碱法”为国际制碱工业做出了重大贡献。他以NaCl、 、
、 等为原料先制得
等为原料先制得 ,进而生产出
,进而生产出 。某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备
。某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 。实验流程如图:
。实验流程如图:
(1)整个实验流程需要___________ 次过滤操作;能够循环利用的是___________ ;
(2)制备 的总反应的化学方程式为
的总反应的化学方程式为___________ ;
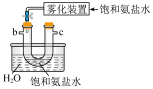
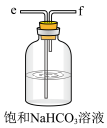
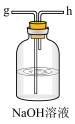
(3)模拟实验时使用下列装置制备 ,请正确的连接装置顺序是
,请正确的连接装置顺序是___________ (按气流方向,用小写字母表示):
(4)上述装置A中反应的离子方程式___________ ,装置B中使用雾化装置的优点是___________ ;装置D的作用是___________ 。
 、
、 等为原料先制得
等为原料先制得 ,进而生产出
,进而生产出 。某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备
。某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 。实验流程如图:
。实验流程如图: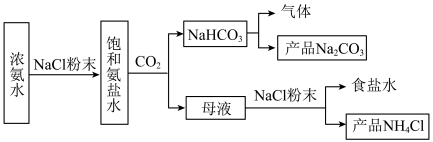
(1)整个实验流程需要
(2)制备
 的总反应的化学方程式为
的总反应的化学方程式为(3)模拟实验时使用下列装置制备
 ,请正确的连接装置顺序是
,请正确的连接装置顺序是
|
|
| |
| A | B | C | D |
您最近一年使用:0次
解题方法
6 . 一种回收锌电解阳极泥(主要成分为 、
、 和
和 ,还有少量锰铅复合氧化物
,还有少量锰铅复合氧化物 和
和 )中金属元素锌、铅和银的工艺流程如下。回答下列问题:
)中金属元素锌、铅和银的工艺流程如下。回答下列问题: 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。
(1) 中
中 的化合价为+2价,
的化合价为+2价, 的化合价有+2价和+4价,则氧化物中+2价和+4价
的化合价有+2价和+4价,则氧化物中+2价和+4价 的个数比为
的个数比为___________ ,基态 原子的价层电子排布图为
原子的价层电子排布图为___________ 。
(2)滤液1的主要溶质为___________ (填化学式)。
(3)“还原酸浸”工序中主要反应的化学方程式为___________ 。
(4)结合 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”为加热蒸发、趁热过滤、洗涤、干燥。结合
晶体的“一系列操作”为加热蒸发、趁热过滤、洗涤、干燥。结合 溶解度曲线分析趁热过滤的原因是
溶解度曲线分析趁热过滤的原因是___________ 。 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成
,在阴极放电生成 单质,有利于
单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为___________ 。
(6)通过计算说明可用 溶液将“滤渣”中的
溶液将“滤渣”中的 转化为
转化为 的原因
的原因___________ 。[已知:25℃时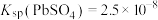 ,
,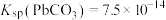 ]
]
(7)锰、镍、镓的某种磁性形状记忆型合金的晶胞结构如图所示。 表示阿伏加德罗常数的值。该晶体的密度为
表示阿伏加德罗常数的值。该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 、
、 和
和 ,还有少量锰铅复合氧化物
,还有少量锰铅复合氧化物 和
和 )中金属元素锌、铅和银的工艺流程如下。回答下列问题:
)中金属元素锌、铅和银的工艺流程如下。回答下列问题:
 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。(1)
 中
中 的化合价为+2价,
的化合价为+2价, 的化合价有+2价和+4价,则氧化物中+2价和+4价
的化合价有+2价和+4价,则氧化物中+2价和+4价 的个数比为
的个数比为 原子的价层电子排布图为
原子的价层电子排布图为(2)滤液1的主要溶质为
(3)“还原酸浸”工序中主要反应的化学方程式为
(4)结合
 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”为加热蒸发、趁热过滤、洗涤、干燥。结合
晶体的“一系列操作”为加热蒸发、趁热过滤、洗涤、干燥。结合 溶解度曲线分析趁热过滤的原因是
溶解度曲线分析趁热过滤的原因是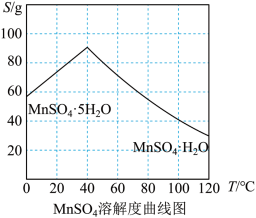
 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成
,在阴极放电生成 单质,有利于
单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为(6)通过计算说明可用
 溶液将“滤渣”中的
溶液将“滤渣”中的 转化为
转化为 的原因
的原因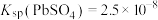 ,
,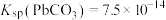 ]
](7)锰、镍、镓的某种磁性形状记忆型合金的晶胞结构如图所示。
 表示阿伏加德罗常数的值。该晶体的密度为
表示阿伏加德罗常数的值。该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。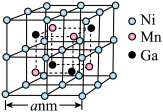
您最近一年使用:0次
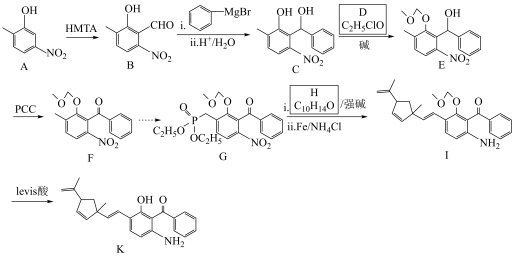
7 . 化合物K常用作医药中间体、材料中间体,其合成路线如图所示。 。
。
(1)检验苯中含有A的化学试剂为_______ ,C中官能团的名称为_______ 。
(2)H→I的反应类型为_______ ,G的结构简式为_______ ,其碳原子的杂化方式为_______ 。
(3)J→K的化学方程式为_______ 。
(4)D的同分异构体中,仅含有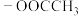 、
、 和苯环结构的有
和苯环结构的有____ 种(不考虑立体异构)。
(5)根据上述信息,写出以苯和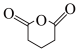 为主要原料制备
为主要原料制备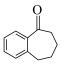 的合成路线:
的合成路线:_____ 。

 。
。②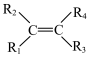
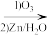
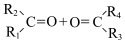 。
。
(1)检验苯中含有A的化学试剂为
(2)H→I的反应类型为
(3)J→K的化学方程式为
(4)D的同分异构体中,仅含有
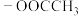 、
、 和苯环结构的有
和苯环结构的有(5)根据上述信息,写出以苯和
 为主要原料制备
为主要原料制备 的合成路线:
的合成路线:
您最近一年使用:0次
解题方法
8 . 工业上以软锰矿(主要成分为 ,还含有少量
,还含有少量 等)和辉铜矿(主要成分为
等)和辉铜矿(主要成分为 ,还含有少量Si、Ni等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。
,还含有少量Si、Ni等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。 的原理为
的原理为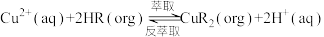 (org为有机相)。
(org为有机相)。
回答下列问题:
(1)为了加快“酸浸”速率,可采取的措施是_______ (答出一条即可),已知浸出渣中含有单质S,写出“酸浸”时 与
与 反应的离子方程式:
反应的离子方程式:______________ 。
(2)“萃取”后的溶液中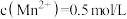 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度 时,可认为已除尽,已知“调pH除镍”时应控制溶液pH的最小值是1.8,最大值是5.8,则
时,可认为已除尽,已知“调pH除镍”时应控制溶液pH的最小值是1.8,最大值是5.8,则
_______ [已知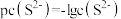 ,该溶液中
,该溶液中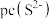 和pH的关系为
和pH的关系为 ;忽略溶液体积变化]。
;忽略溶液体积变化]。
(3)写出“碳化沉锰”过程中发生反应的离子方程式:_______ 。
(4)试剂X为_______ (填化学式);“系列操作”包括_______ 、过滤、洗涤和干燥。
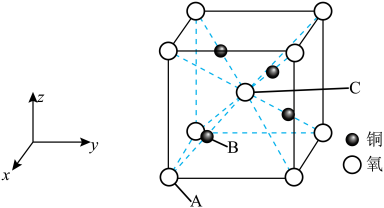
(5)铜的一种氧化物晶胞如图所示,晶胞参数为a pm, 为阿伏加德罗常数的值。A、B的原子坐标分别为
为阿伏加德罗常数的值。A、B的原子坐标分别为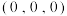 、
、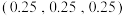 ,则C的原子坐标为
,则C的原子坐标为_______ ,该晶体密度为_______  。
。
 ,还含有少量
,还含有少量 等)和辉铜矿(主要成分为
等)和辉铜矿(主要成分为 ,还含有少量Si、Ni等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。
,还含有少量Si、Ni等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。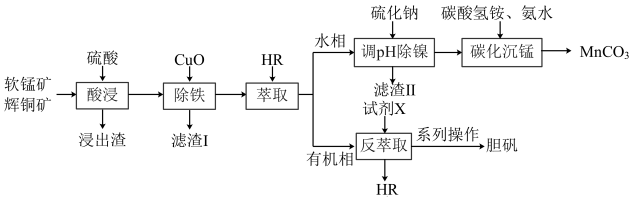
 的原理为
的原理为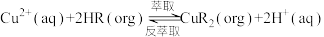 (org为有机相)。
(org为有机相)。回答下列问题:
(1)为了加快“酸浸”速率,可采取的措施是
 与
与 反应的离子方程式:
反应的离子方程式:(2)“萃取”后的溶液中
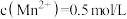 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度 时,可认为已除尽,已知“调pH除镍”时应控制溶液pH的最小值是1.8,最大值是5.8,则
时,可认为已除尽,已知“调pH除镍”时应控制溶液pH的最小值是1.8,最大值是5.8,则
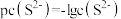 ,该溶液中
,该溶液中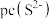 和pH的关系为
和pH的关系为 ;忽略溶液体积变化]。
;忽略溶液体积变化]。(3)写出“碳化沉锰”过程中发生反应的离子方程式:
(4)试剂X为
(5)铜的一种氧化物晶胞如图所示,晶胞参数为a pm,
 为阿伏加德罗常数的值。A、B的原子坐标分别为
为阿伏加德罗常数的值。A、B的原子坐标分别为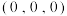 、
、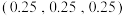 ,则C的原子坐标为
,则C的原子坐标为 。
。
您最近一年使用:0次
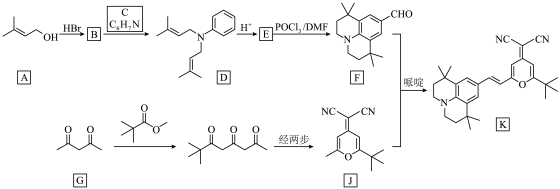
9 . 有机物K作为一种高性能发光材料,广泛用于有机电致发光器件(OLED)。K的一种合成路线如下所示,部分试剂及反应条件省略。___________ 。
(2)C的结构简式为___________ 。
(3)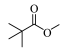 的化学名称为
的化学名称为___________ ,B与C生成D的反应类型为___________ 。
(4)F和J反应生成K的化学方程式为___________ 。
(5)G的同分异构体中,满足以下条件的同分异构体有___________ 种(不考虑立体异构体)。其中核磁共振氢谱显示有3组峰,且峰面积之比为6∶1∶1的结构简式为___________ 。
①能与NaHCO3溶液反应放出CO2气体;
②分子中没有环状结构。
(6)以乙炔(C2H2)和苯胺(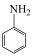 )为原料,结合上述合成路线,设计一条合成
)为原料,结合上述合成路线,设计一条合成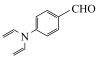 的路线(无机试剂任选)
的路线(无机试剂任选)___________ 。
已知: (R1和R2为烃基)
(R1和R2为烃基)
(2)C的结构简式为
(3)
 的化学名称为
的化学名称为(4)F和J反应生成K的化学方程式为
(5)G的同分异构体中,满足以下条件的同分异构体有
①能与NaHCO3溶液反应放出CO2气体;
②分子中没有环状结构。
(6)以乙炔(C2H2)和苯胺(
 )为原料,结合上述合成路线,设计一条合成
)为原料,结合上述合成路线,设计一条合成 的路线(无机试剂任选)
的路线(无机试剂任选)
您最近一年使用:0次
10 . 四氧化三铁俗称磁性氧化铁,常用于制造录音磁带和电讯器材,也可作颜料和抛光剂。某工厂以硫铁矿烧渣(主要含有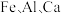 等元素的氧化物及
等元素的氧化物及 )为原料,制备
)为原料,制备 的工艺流程如图所示。
的工艺流程如图所示。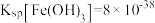 、
、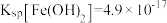 、
、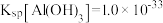 。
。
回答下列问题:
(1)“酸溶”硫铁矿烧渣时,为了加快酸溶速率可采取的措施有___________ (任写两条)。
(2)料渣1的主要成分有___________ (填化学式)。
(3)常温下,已知溶液中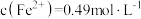 ,要使
,要使 沉淀完全,则“调
沉淀完全,则“调 ”的范围是
”的范围是___________ (保留2位有效数字,一般离子浓度 认为沉淀完全)。
认为沉淀完全)。
(4)加入 “沉铁”时,发生反应的离子方程式为
“沉铁”时,发生反应的离子方程式为___________ 。
(5)①“煅烧1”的目的是将 转化为
转化为 ,若“煅烧2”阶段发生反应时
,若“煅烧2”阶段发生反应时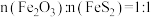 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
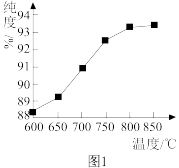
②“煅烧2”时温度对 的纯度有很大影响。已知温度对
的纯度有很大影响。已知温度对 纯度的影响如图1所示,则“煅烧2”时,温度最好控制在
纯度的影响如图1所示,则“煅烧2”时,温度最好控制在___________  。
。 )的晶胞如图2所示。已知:该晶胞底边边长为
)的晶胞如图2所示。已知:该晶胞底边边长为 ,高为
,高为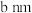 ,l号原子的高为
,l号原子的高为 。
。 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。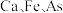 原子的个数之比为
原子的个数之比为___________ ;距2号原子最近的铁有___________ 个。
②该晶体的密度为___________  ,1号原子的坐标为
,1号原子的坐标为___________ 。
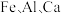 等元素的氧化物及
等元素的氧化物及 )为原料,制备
)为原料,制备 的工艺流程如图所示。
的工艺流程如图所示。
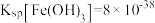 、
、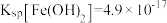 、
、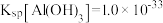 。
。回答下列问题:
(1)“酸溶”硫铁矿烧渣时,为了加快酸溶速率可采取的措施有
(2)料渣1的主要成分有
(3)常温下,已知溶液中
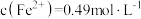 ,要使
,要使 沉淀完全,则“调
沉淀完全,则“调 ”的范围是
”的范围是 认为沉淀完全)。
认为沉淀完全)。(4)加入
 “沉铁”时,发生反应的离子方程式为
“沉铁”时,发生反应的离子方程式为(5)①“煅烧1”的目的是将
 转化为
转化为 ,若“煅烧2”阶段发生反应时
,若“煅烧2”阶段发生反应时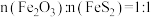 ,则该反应的化学方程式为
,则该反应的化学方程式为②“煅烧2”时温度对
 的纯度有很大影响。已知温度对
的纯度有很大影响。已知温度对 纯度的影响如图1所示,则“煅烧2”时,温度最好控制在
纯度的影响如图1所示,则“煅烧2”时,温度最好控制在 。
。
 )的晶胞如图2所示。已知:该晶胞底边边长为
)的晶胞如图2所示。已知:该晶胞底边边长为 ,高为
,高为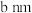 ,l号原子的高为
,l号原子的高为 。
。 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。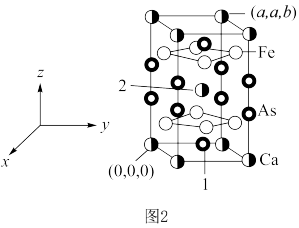
 原子的个数之比为
原子的个数之比为②该晶体的密度为
 ,1号原子的坐标为
,1号原子的坐标为
您最近一年使用:0次