名校
解题方法
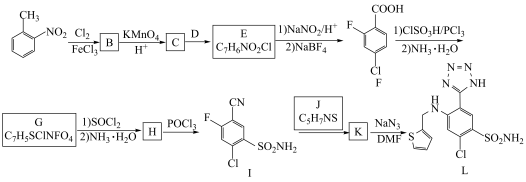
1 . L是一种重要的有机试剂,其工业合成路线如下图
①
(1)物质A的系统命名法名称为______________ 。
(2)反应条件D应选择_________ (填标号)
a. /
/ b.Fe/HCl c.NaOH/
b.Fe/HCl c.NaOH/ d.
d. /
/
(3)写出H的结构简式_____________ ,B→C的反应类型是______________ 。
(4)写出一定条件下,F生成G的第二步反应的方程式__________________________ 。
(5)有机物M是A的同系物,相对分子质量比A大28,符合下列条件的M的芳香同分异构体有_______ 种。
③能发生银镜反应
④有四种不同化学环境的H,其个数比为6∶2∶2∶1
(6)以乙醇为主要原料合成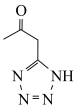 设计路线如下图,请补充该合成路线图中的反应条件和产物
设计路线如下图,请补充该合成路线图中的反应条件和产物__________ 。(反应条件请写在箭头的上下如: 中间产物写在对应的横线上)
中间产物写在对应的横线上)
①
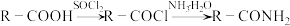
②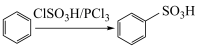
(1)物质A的系统命名法名称为
(2)反应条件D应选择
a.
 /
/ b.Fe/HCl c.NaOH/
b.Fe/HCl c.NaOH/ d.
d. /
/
(3)写出H的结构简式
(4)写出一定条件下,F生成G的第二步反应的方程式
(5)有机物M是A的同系物,相对分子质量比A大28,符合下列条件的M的芳香同分异构体有
①含吡啶(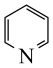 )环
)环
③能发生银镜反应
④有四种不同化学环境的H,其个数比为6∶2∶2∶1
(6)以乙醇为主要原料合成
 设计路线如下图,请补充该合成路线图中的反应条件和产物
设计路线如下图,请补充该合成路线图中的反应条件和产物 中间产物写在对应的横线上)
中间产物写在对应的横线上)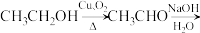 _______
_______
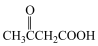 →__________→__________
→__________→__________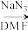
您最近一年使用:0次
名校
解题方法
2 . 某小组探究 溶液和
溶液和 溶液的反应。
溶液的反应。
实验Ⅰ:向某浓度的 酸性溶液(过量)中加入
酸性溶液(过量)中加入 溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料: 在酸性溶液氧化
在酸性溶液氧化 ,反应为
,反应为
(1)针对t秒前溶液未变蓝,小组做出如下假设:
ⅰ.t秒前未生成 ,是由于反应的活化能
,是由于反应的活化能_______ (填“大”或“小”),反应速率慢导致的。
ⅱ.t秒前生成了 ,但由于存在
,但由于存在 ,
,____________ (用离子方程式表示), 被消耗。
被消耗。
(2)下述实验证实了假设ⅰ合理。
实验Ⅱ:向实验Ⅰ的蓝色溶液中加入___________ ,蓝色迅速消失,后再次变蓝。
(3)进一步研究 溶液和
溶液和 溶液反应的过程,装置如下。
溶液反应的过程,装置如下。
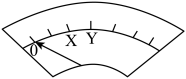
①K闭合后,判断b极区发生氧化反应的实验方案为:__________________ 。
②0~ 时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。由此判断
时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。由此判断 在a极放电的电极反应式是
在a极放电的电极反应式是_________________ 。
③结合化学方程式解释 ~
~ 时指针回到“0”处的原因:
时指针回到“0”处的原因:___________________________ 。
(4)综合实验Ⅰ、Ⅱ、Ⅲ,下列说法正确的是_________ 。
A.对比实验Ⅰ、Ⅱ,t秒后溶液变蓝,Ⅰ中 被完全氧化
被完全氧化
B.对比实验Ⅰ、Ⅲ,t秒前 未发生反应
未发生反应
C.实验Ⅲ中指针返回X处的原因,可能是 氧化
氧化
 溶液和
溶液和 溶液的反应。
溶液的反应。实验Ⅰ:向某浓度的
 酸性溶液(过量)中加入
酸性溶液(过量)中加入 溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。资料:
 在酸性溶液氧化
在酸性溶液氧化 ,反应为
,反应为
(1)针对t秒前溶液未变蓝,小组做出如下假设:
ⅰ.t秒前未生成
 ,是由于反应的活化能
,是由于反应的活化能ⅱ.t秒前生成了
 ,但由于存在
,但由于存在 ,
, 被消耗。
被消耗。(2)下述实验证实了假设ⅰ合理。
实验Ⅱ:向实验Ⅰ的蓝色溶液中加入
(3)进一步研究
 溶液和
溶液和 溶液反应的过程,装置如下。
溶液反应的过程,装置如下。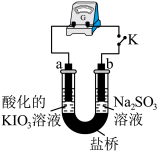
表盘 |
| ||
时间/min | 0~ |
|
|
偏转位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针归零 |
②0~
 时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。由此判断
时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。由此判断 在a极放电的电极反应式是
在a极放电的电极反应式是③结合化学方程式解释
 ~
~ 时指针回到“0”处的原因:
时指针回到“0”处的原因:(4)综合实验Ⅰ、Ⅱ、Ⅲ,下列说法正确的是
A.对比实验Ⅰ、Ⅱ,t秒后溶液变蓝,Ⅰ中
 被完全氧化
被完全氧化B.对比实验Ⅰ、Ⅲ,t秒前
 未发生反应
未发生反应C.实验Ⅲ中指针返回X处的原因,可能是
 氧化
氧化
您最近一年使用:0次
名校
3 . 锑(Sb)及其化合物广泛用于化工生产。以粗锑氧为原料制备Sb和 的工艺流程如图所示。
的工艺流程如图所示。
Ⅰ.粗锑氧主要成分为 ,含有PbO、
,含有PbO、 、
、 、ZnO、FeO等杂质;
、ZnO、FeO等杂质;
Ⅱ.浸出液主要含 、
、 和
和 ,还含有
,还含有 、
、 、
、 和
和 等杂质;
等杂质;
Ⅲ. 为两性氧化物;
为两性氧化物;
Ⅳ.25℃时, 、
、
回答下列问题:
(1)已知 在熔融状态下不导电,则
在熔融状态下不导电,则 是
是________ 化合物(填“共价”或“离子”)。
(2)“还原”是用锑粉还原高价金属离子。其中Sb将 转化为
转化为 ,该转化有利于“水解”时锑与铁的分离,避免在滤渣Ⅱ中混入杂质
,该转化有利于“水解”时锑与铁的分离,避免在滤渣Ⅱ中混入杂质_________ (填化学式)。
(3)“过滤”得到滤渣成分SbOCl,加过量氨水对其“除氯”的化学反应方程式为___________ ,“除氯”步骤能否用NaOH溶液代替氨水,原因是:____________________ 。
(4)“除砷”时有 生成,该反应的离子方程式为
生成,该反应的离子方程式为_____________________ 。
(5)“电解”过程中单位时间内锑的产率与电压大小关系如图所示。当电压在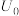 V之前时,阴极主要的电极反应式
V之前时,阴极主要的电极反应式__________ ,当电压超过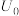 V时,单位时间内产率降低的原因可能是
V时,单位时间内产率降低的原因可能是______________ 。 的纯度,操作方法为:称取0.30g样品溶于稀硫酸中,用0.2000mol/L的硫酸铈
的纯度,操作方法为:称取0.30g样品溶于稀硫酸中,用0.2000mol/L的硫酸铈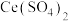 滴定,使用邻二氮菲-亚铁指示剂,发生反应:
滴定,使用邻二氮菲-亚铁指示剂,发生反应: ,重复3次实验平均消耗标准溶液15.60mL,则产物的纯度为
,重复3次实验平均消耗标准溶液15.60mL,则产物的纯度为________ %。
 的工艺流程如图所示。
的工艺流程如图所示。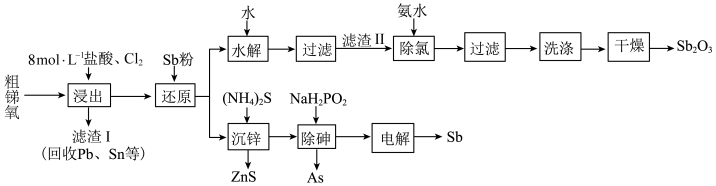
Ⅰ.粗锑氧主要成分为
 ,含有PbO、
,含有PbO、 、
、 、ZnO、FeO等杂质;
、ZnO、FeO等杂质;Ⅱ.浸出液主要含
 、
、 和
和 ,还含有
,还含有 、
、 、
、 和
和 等杂质;
等杂质;Ⅲ.
 为两性氧化物;
为两性氧化物;Ⅳ.25℃时,
 、
、
回答下列问题:
(1)已知
 在熔融状态下不导电,则
在熔融状态下不导电,则 是
是(2)“还原”是用锑粉还原高价金属离子。其中Sb将
 转化为
转化为 ,该转化有利于“水解”时锑与铁的分离,避免在滤渣Ⅱ中混入杂质
,该转化有利于“水解”时锑与铁的分离,避免在滤渣Ⅱ中混入杂质(3)“过滤”得到滤渣成分SbOCl,加过量氨水对其“除氯”的化学反应方程式为
(4)“除砷”时有
 生成,该反应的离子方程式为
生成,该反应的离子方程式为(5)“电解”过程中单位时间内锑的产率与电压大小关系如图所示。当电压在
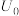 V之前时,阴极主要的电极反应式
V之前时,阴极主要的电极反应式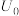 V时,单位时间内产率降低的原因可能是
V时,单位时间内产率降低的原因可能是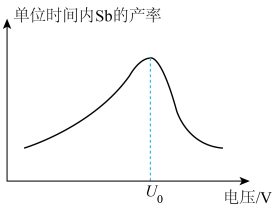
 的纯度,操作方法为:称取0.30g样品溶于稀硫酸中,用0.2000mol/L的硫酸铈
的纯度,操作方法为:称取0.30g样品溶于稀硫酸中,用0.2000mol/L的硫酸铈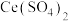 滴定,使用邻二氮菲-亚铁指示剂,发生反应:
滴定,使用邻二氮菲-亚铁指示剂,发生反应: ,重复3次实验平均消耗标准溶液15.60mL,则产物的纯度为
,重复3次实验平均消耗标准溶液15.60mL,则产物的纯度为
您最近一年使用:0次
名校
解题方法
4 . 氮是自然界中各种生物体生命活动不可缺少的重要元素,研究氮的循环和转化对生产、生活有重要的价值。
I.某工厂用氨制硝酸和铵盐的流程如图1所示。

(1)设备1中发生反应的化学方程式是___________ 。
(2)在工业上,可用浓氨水检验输送氯气的管道是否漏气,若漏气则有白烟生成,写出反应的化学方程式___________ 。同温同压下,理论上设备1与设备2中消耗空气的体积比为___________ 。
II.氨氮废水的处理是当前科学研究的热点问题。氨氮废水中的氮元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如图2所示:
的形式存在。某工厂处理氨氮废水的流程如图2所示:
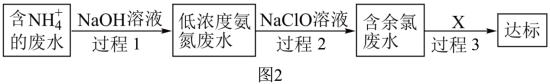
(3)过程1加NaOH的同时还需要鼓入大量空气,目的是___________ 。
(4)过程2的产物均为无毒物质,反应后含氮元素、氯元素的产物化学式分别为___________ 。
(5)含余氯废水的主要成分是NaClO以及HClO。X可选用___________(填序号)
I.某工厂用氨制硝酸和铵盐的流程如图1所示。

(1)设备1中发生反应的化学方程式是
(2)在工业上,可用浓氨水检验输送氯气的管道是否漏气,若漏气则有白烟生成,写出反应的化学方程式
II.氨氮废水的处理是当前科学研究的热点问题。氨氮废水中的氮元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如图2所示:
的形式存在。某工厂处理氨氮废水的流程如图2所示:
(3)过程1加NaOH的同时还需要鼓入大量空气,目的是
(4)过程2的产物均为无毒物质,反应后含氮元素、氯元素的产物化学式分别为
(5)含余氯废水的主要成分是NaClO以及HClO。X可选用___________(填序号)
| A.KOH | B. | C. | D.Na2SO4 |
您最近一年使用:0次
名校
解题方法
5 . 长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验FeSO4溶液的变质程度
①将方案补充完整
②若要使部分变质的FeSO4复原,方法是___________ 。(用离子反应方程式表示)
(2)利用部分变质 的FeSO4溶液制备Fe2O3。
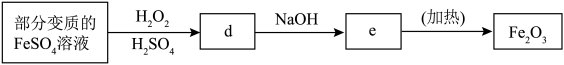
①填写下列各空:
d.___________ ;e.___________ 。
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为___________ 。
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由___________ 。
(1)设计实验检验FeSO4溶液的变质程度
①将方案补充完整
| 实验方案 | 实验现象 | 实验结论 | |
| 步骤1 | 取待检测液于试管中,向其中滴加KSCN溶液 | ii | FeSO4溶液部分变质 |
| 步骤2 | i | iii | |
(2)利用

①填写下列各空:
d.
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
| 实验方案 | 实验现象 |
| 取适量 Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 紫色褪去 |
您最近一年使用:0次
名校
解题方法
6 .  是一种重要化合物,食品中添加
是一种重要化合物,食品中添加 可以起到漂白、防腐、抗氧化的作用。某研究小组用如图装置进行
可以起到漂白、防腐、抗氧化的作用。某研究小组用如图装置进行 与
与 溶液反应相关实验(夹持装置已略去)。
溶液反应相关实验(夹持装置已略去)。
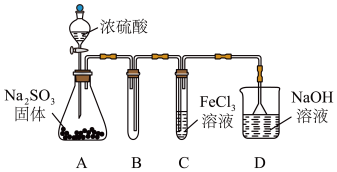
(1)盛放浓硫酸的装置名称是___________ ,D中倒置漏斗的作用___________ 。
(2)装置A中发生的化学反应方程式为___________ 。
(3)根据C中溶液由棕黄色变成浅绿色的现象,该小组同学认为 与
与 溶液发生氧化还原反应。写出
溶液发生氧化还原反应。写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(4)该小组同学向C试管反应后的溶液中加入硝酸酸化的 溶液,若出现白色沉淀,即可证明反应生成了
溶液,若出现白色沉淀,即可证明反应生成了 。该做法
。该做法___________ (填“合理”或“不合理”),理由是___________ 。
(5)为了验证SO2具有还原性,实验中不可以代替 溶液的试剂有___________(填字母)。
溶液的试剂有___________(填字母)。
 是一种重要化合物,食品中添加
是一种重要化合物,食品中添加 可以起到漂白、防腐、抗氧化的作用。某研究小组用如图装置进行
可以起到漂白、防腐、抗氧化的作用。某研究小组用如图装置进行 与
与 溶液反应相关实验(夹持装置已略去)。
溶液反应相关实验(夹持装置已略去)。
(1)盛放浓硫酸的装置名称是
(2)装置A中发生的化学反应方程式为
(3)根据C中溶液由棕黄色变成浅绿色的现象,该小组同学认为
 与
与 溶液发生氧化还原反应。写出
溶液发生氧化还原反应。写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式(4)该小组同学向C试管反应后的溶液中加入硝酸酸化的
 溶液,若出现白色沉淀,即可证明反应生成了
溶液,若出现白色沉淀,即可证明反应生成了 。该做法
。该做法(5)为了验证SO2具有还原性,实验中不可以代替
 溶液的试剂有___________(填字母)。
溶液的试剂有___________(填字母)。| A.浓硫酸 | B.酸性 溶液 溶液 | C.氯水 | D.品红溶液 |
您最近一年使用:0次
7 . 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
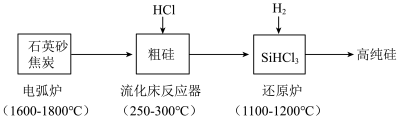
(1)工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅的化学方程式为___________ 。当有 参与反应时,该反应转移的电子数是
参与反应时,该反应转移的电子数是___________ 。
(2)还原炉中发生的化学反应方程式为___________ 。
(3)上述工艺生产中循环使用的物质除 、
、 外,还有
外,还有___________ 。
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为___________ 。
(5)工业上可利用水玻璃和盐酸反应制备硅酸凝胶(H2SiO3),进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:___________ 。
(6)关于硅及其相关化合物的叙述正确的是___________ (填字母)。
A.自然界中存在天然游离的硅单质
B.已知C与 的最高正价都是正四价,由于
的最高正价都是正四价,由于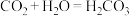 ,用类比法得知,
,用类比法得知,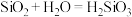
C.硅酸是一种比碳酸还弱的酸
D.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
E. 既能和
既能和 溶液反应,又能和氢氟酸反应,所以是两性氧化物
溶液反应,又能和氢氟酸反应,所以是两性氧化物
F.硅是组成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位

(1)工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅的化学方程式为
 参与反应时,该反应转移的电子数是
参与反应时,该反应转移的电子数是(2)还原炉中发生的化学反应方程式为
(3)上述工艺生产中循环使用的物质除
 、
、 外,还有
外,还有(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为
(5)工业上可利用水玻璃和盐酸反应制备硅酸凝胶(H2SiO3),进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:
(6)关于硅及其相关化合物的叙述正确的是
A.自然界中存在天然游离的硅单质
B.已知C与
 的最高正价都是正四价,由于
的最高正价都是正四价,由于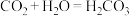 ,用类比法得知,
,用类比法得知,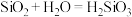
C.硅酸是一种比碳酸还弱的酸
D.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
E.
 既能和
既能和 溶液反应,又能和氢氟酸反应,所以是两性氧化物
溶液反应,又能和氢氟酸反应,所以是两性氧化物F.硅是组成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
您最近一年使用:0次
名校
8 . [Co(NH3)6]Cl3(三氯六氨合钴)是一种重要的化工产品,实验室制备过程如下:
①将一定量的氯化铵和浓氨水置于锥形瓶中,混合均匀;
②分批加入氯化钴粉末,边加边搅拌,直至溶液呈棕色稀浆;
③再向其中滴加30%H2O2,当固体完全溶解后,慢慢加入浓盐酸加热10~15min;
④在室温下冷却,过滤,可得到橙黄色[Co(NH3)6]Cl3晶体。
(1)[Co(NH3)6]Cl3中Co的化合价是___________ ,该配合物中心离子的核外电子排布式为___________ 。
(2)“加热”应控温在60℃进行,控温方式可采取___________ ,温度不宜过高的原因是___________ 。
(3)溶液中CoCl2、NH4Cl和浓氨水混合后与H2O2溶液反应生成[Co(NH3)6]Cl3的化学方程式是___________ 。
(4)沉淀滴定法测定产品中Cl-的质量分数:
i.准确称取mg的产品,配制成200mL溶液,移取20mL于锥形瓶中;。
ii.滴加几滴K2CrO4溶液为指示剂,用cmol·L-1AgNO3溶液滴定至终点;
iii.重复滴定三次,消耗AgNO3溶液体积的平均值为VmL,计算晶体中Cl-的质量分数。
已知溶解度:AgCl1.3×10-6mol·L-1,Ag2CrO4(砖红色)6.5×10-5mol·L-1
①ii中,滴定至终点的现象是___________ 。
②制备的晶体中Cl-的质量分数是___________ (列计算式即可)。
①将一定量的氯化铵和浓氨水置于锥形瓶中,混合均匀;
②分批加入氯化钴粉末,边加边搅拌,直至溶液呈棕色稀浆;
③再向其中滴加30%H2O2,当固体完全溶解后,慢慢加入浓盐酸加热10~15min;
④在室温下冷却,过滤,可得到橙黄色[Co(NH3)6]Cl3晶体。
(1)[Co(NH3)6]Cl3中Co的化合价是
(2)“加热”应控温在60℃进行,控温方式可采取
(3)溶液中CoCl2、NH4Cl和浓氨水混合后与H2O2溶液反应生成[Co(NH3)6]Cl3的化学方程式是
(4)沉淀滴定法测定产品中Cl-的质量分数:
i.准确称取mg的产品,配制成200mL溶液,移取20mL于锥形瓶中;。
ii.滴加几滴K2CrO4溶液为指示剂,用cmol·L-1AgNO3溶液滴定至终点;
iii.重复滴定三次,消耗AgNO3溶液体积的平均值为VmL,计算晶体中Cl-的质量分数。
已知溶解度:AgCl1.3×10-6mol·L-1,Ag2CrO4(砖红色)6.5×10-5mol·L-1
①ii中,滴定至终点的现象是
②制备的晶体中Cl-的质量分数是
您最近一年使用:0次
名校
9 . 《化学世界》刊载了我国科学家的研究成果:在钴锰氧化物 的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:
的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:___________ 。
(2)Co和Ni都属于第Ⅷ族元素,均能与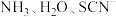 等配体组成配合物。
等配体组成配合物。
②SCN-与金属离子形成的配合物中配位原子一般是S而不是N,其原因是___________ 。
(3)比较熔点大小:CoO___________ MnO(填“<”,“=”或“>”)
(4)KMnF3晶体有钻钛矿型的立方结构,晶胞结构如图1所示。 ),则C原子的坐标参数为
),则C原子的坐标参数为___________ 。
②若阿伏加德罗常数的值为NA,晶胞参数为anm,则晶体密度为___________ g∙cm-3。
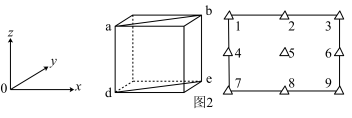
③在KMnF3晶胞结构的另一种表示中,Mn处于各顶角位置。该晶胞结构中,沿立方格子对角面取得的截图如图2所示。F在晶胞中的位置为___________ (填阿拉伯数字序号)。
 的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:
的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:
(2)Co和Ni都属于第Ⅷ族元素,均能与
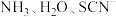 等配体组成配合物。
等配体组成配合物。①一种Ni2+配离子的结构如图所示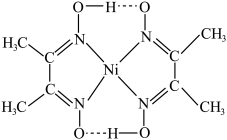 ,该配离子中存在的化学键类型有
,该配离子中存在的化学键类型有
②SCN-与金属离子形成的配合物中配位原子一般是S而不是N,其原因是
(3)比较熔点大小:CoO
(4)KMnF3晶体有钻钛矿型的立方结构,晶胞结构如图1所示。
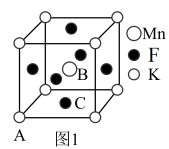
 ),则C原子的坐标参数为
),则C原子的坐标参数为②若阿伏加德罗常数的值为NA,晶胞参数为anm,则晶体密度为
③在KMnF3晶胞结构的另一种表示中,Mn处于各顶角位置。该晶胞结构中,沿立方格子对角面取得的截图如图2所示。F在晶胞中的位置为
您最近一年使用:0次
名校
10 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(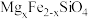 )。回答下列问题:
)。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。橄榄石中,各元素电负性由大到小的顺序为___________ 。
(2)已知一些物质的熔点数据如下表:
① 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是___________ 。
②分析同族元素的氯化物 、
、 、
、 熔点变化趋势的原因
熔点变化趋势的原因___________ 。 的空间结构为
的空间结构为___________ ,其中 的轨道杂化形式为
的轨道杂化形式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有___________ 个 。该物质化学式为
。该物质化学式为___________ ,B-B最近距离为___________ 。
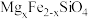 )。回答下列问题:
)。回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)已知一些物质的熔点数据如下表:
| 物质 | NaCl | SiCl4 | GeCl4 | SnCl4 |
| 熔点/℃ | 800.7 | -68.8 | -51.5 | -34.1 |
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是②分析同族元素的氯化物
 、
、 、
、 熔点变化趋势的原因
熔点变化趋势的原因 的空间结构为
的空间结构为 的轨道杂化形式为
的轨道杂化形式为(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有
 。该物质化学式为
。该物质化学式为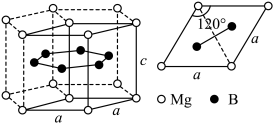
您最近一年使用:0次